Bauchaortenaneurysma - Abdominal aortic aneurysm
| Bauchaortenaneurysma | |
|---|---|
| Andere Namen | Dreifach A |
 | |
| CT- Rekonstruktionsbild eines Bauchaortenaneurysmas (weiße Pfeile) | |
| Spezialität | Gefäßchirurgie |
| Symptome | Keine, Bauch-, Rücken- oder Beinschmerzen |
| Üblicher Beginn | Über 50 Jahre alte Männer |
| Risikofaktoren | Rauchen , Bluthochdruck , andere Herz- oder Blutgefäßerkrankungen , Familienanamnese , Marfan-Syndrom |
| Diagnosemethode | Medizinische Bildgebung ( Abdominalaorta- Durchmesser > 3 cm) |
| Verhütung | Nicht rauchen, Risikofaktoren behandeln |
| Behandlung | Chirurgie ( offene Chirurgie oder endovaskuläre Aneurysma-Reparatur ) |
| Frequenz | ~5% (Männer über 65 Jahre) |
| Todesfälle | 168.200 Aortenaneurysmen (2015) |
Ein Bauchaortenaneurysma ( AAA oder Triple A ) ist eine lokalisierte Vergrößerung der Bauchaorta, so dass der Durchmesser mehr als 3 cm oder mehr als 50 % größer als normal ist. Sie verursachen normalerweise keine Symptome, außer während der Ruptur. Gelegentlich können Bauch-, Rücken- oder Beinschmerzen auftreten. Große Aneurysmen können manchmal durch Drücken auf den Bauch ertastet werden. Eine Ruptur kann zu Bauch- oder Rückenschmerzen, niedrigem Blutdruck oder Bewusstlosigkeit führen und führt oft zum Tod.
AAAs treten am häufigsten bei Personen über 50 Jahren, bei Männern und bei Personen mit einer Familienanamnese auf. Weitere Risikofaktoren sind Rauchen , Bluthochdruck und andere Erkrankungen des Herzens oder der Blutgefäße . Genetische Erkrankungen mit erhöhtem Risiko sind das Marfan-Syndrom und das Ehlers-Danlos-Syndrom . AAAs sind die häufigste Form von Aortenaneurysmen . Etwa 85 % treten unterhalb der Nieren auf, der Rest entweder auf oder oberhalb der Nieren. In den Vereinigten Staaten , Screening mit Bauch - Ultraschall wird zwischen 65 und 75 Jahren mit einer Geschichte des Rauchens bei Männern empfohlen. Im Vereinigten Königreich und in Schweden wird ein Screening aller Männer über 65 empfohlen. Sobald ein Aneurysma gefunden wurde, werden in der Regel regelmäßig weitere Ultraschalluntersuchungen durchgeführt.
Nicht zu rauchen ist der beste Weg, um die Krankheit zu verhindern. Andere Präventionsmethoden sind die Behandlung von Bluthochdruck, die Behandlung von hohem Cholesterinspiegel im Blut und kein Übergewicht . Eine Operation wird normalerweise empfohlen, wenn der Durchmesser eines AAA bei Männern >5,5 cm und bei Frauen >5,0 cm anwächst. Andere Gründe für eine Reparatur sind das Vorhandensein von Symptomen und eine schnelle Größenzunahme, definiert als mehr als einen Zentimeter pro Jahr. Die Reparatur kann entweder durch eine offene Operation oder durch eine endovaskuläre Aneurysma-Reparatur (EVAR) erfolgen. Im Vergleich zur offenen Operation hat EVAR kurzfristig ein geringeres Sterberisiko und einen kürzeren Krankenhausaufenthalt, ist jedoch möglicherweise nicht immer eine Option. Es scheint keinen Unterschied in den längerfristigen Ergebnissen zwischen den beiden zu geben. Wiederholvorgänge sind bei EVAR häufiger.
AAAs betreffen 2-8% der Männer über 65 Jahre. Die Raten bei Frauen sind ein Viertel so hoch. Bei einem Aneurysma von weniger als 5,5 cm liegt das Rupturrisiko im nächsten Jahr unter 1%. Bei einem Aneurysma zwischen 5,5 und 7 cm liegt das Risiko bei etwa 10 %, bei einem Aneurysma über 7 cm bei etwa 33 %. Die Mortalität bei Ruptur beträgt 85% bis 90%. Im Jahr 2013 führten Aortenaneurysmen zu 168.200 Todesfällen, gegenüber 100.000 im Jahr 1990. In den Vereinigten Staaten führten AAAs 2009 zu 10.000 bis 18.000 Todesfällen.
Anzeichen und Symptome
Die überwiegende Mehrheit der Aneurysmen ist asymptomatisch. Wenn sich die Bauchaorta jedoch ausdehnt und/oder reißt, kann das Aneurysma schmerzhaft werden und zu pulsierenden Empfindungen im Bauch oder Schmerzen in der Brust, im unteren Rücken, in den Beinen oder im Hodensack führen.
Komplikationen
Zu den Komplikationen zählen Ruptur, periphere Embolisation , akuter Aortenverschluss und aortocavale (zwischen Aorta und untere Hohlvene ) oder aortoduodenale (zwischen Aorta und Duodenum ) Fisteln . Bei der körperlichen Untersuchung kann eine tastbare und pulsierende Bauchmasse festgestellt werden. Bruits kann bei Nieren- oder viszeralen Arterien vorliegen Stenose .
Die Anzeichen und Symptome eines rupturierten AAA können starke Schmerzen im unteren Rücken, in der Flanke, im Bauch oder in der Leistengegend sein. Eine Masse, die mit dem Herzschlag pulsiert, kann auch gefühlt werden. Die Blutung kann zu einem hypovolämischen Schock mit niedrigem Blutdruck und schneller Herzfrequenz führen . Dies kann zu einer kurzen Ohnmacht führen . Die Sterblichkeit der AAA-Ruptur beträgt bis zu 90 Prozent. 65 bis 75 Prozent der Patienten sterben, bevor sie im Krankenhaus eintreffen, und bis zu 90 Prozent sterben, bevor sie den Operationssaal erreichen. Die Blutung kann retroperitoneal oder in die Bauchhöhle erfolgen . Eine Ruptur kann auch eine Verbindung zwischen der Aorta und dem Darm oder der unteren Hohlvene herstellen . Flank ecchymosis (Aussehen eines Prellung) ist ein Zeichen der retroperitoneale Blutungen und wird auch als Grey-Turner-Zeichen .
Ursachen
Die genauen Ursachen des degenerativen Prozesses bleiben unklar. Es gibt jedoch einige Hypothesen und klar definierte Risikofaktoren .
- Tabakrauchen: Mehr als 90% der Menschen, die ein AAA entwickeln, haben irgendwann in ihrem Leben geraucht .
- Alkohol und Bluthochdruck: Die durch längeren Alkoholkonsum verursachte Entzündung und hypertensive Wirkungen von Bauchödemen, die zu Hämorrhoiden , Ösophagusvarizen und anderen Erkrankungen führen, werden ebenfalls als langfristige Ursache von AAA angesehen.
- Genetische Einflüsse: Der Einfluss genetischer Faktoren ist hoch. Bei männlichen Geschwistern bekannter Patienten tritt ein AAA vier- bis sechsmal häufiger auf, mit einem Risiko von 20–30 %. Die hohe familiäre Prävalenz ist bei männlichen Personen am auffälligsten. Es gibt viele Hypothesen über die genaue genetische Störung, die bei männlichen Mitgliedern der betroffenen Familien zu einer höheren Inzidenz von AAA führen könnte. Einige vermuteten, dass der Einfluss des Alpha-1-Antitrypsin- Mangels entscheidend sein könnte, während andere experimentelle Arbeiten die Hypothese der X-chromosomalen Mutation begünstigten , was die geringere Inzidenz bei heterozygoten Weibchen erklären würde . Es wurden auch andere Hypothesen über genetische Ursachen formuliert. Bindegewebserkrankungen wie das Marfan-Syndrom und das Ehlers-Danlos-Syndrom wurden ebenfalls stark mit AAA in Verbindung gebracht. Sowohl die rezidivierende Polychondritis als auch das Pseudoxanthoma elasticum können ein abdominales Aortenaneurysma verursachen.
- Arteriosklerose : Das AAA wurde lange Zeit als durch Arteriosklerose verursacht angesehen , da die Wände des AAA häufig eine atherosklerotische Belastung tragen. Diese Hypothese kann jedoch nicht verwendet werden, um den anfänglichen Defekt und die dabei beobachtete Okklusionsentwicklung zu erklären .
- Andere Ursachen für die Entwicklung von AAA sind: Infektion , Trauma , Arteriitis und zystische mediale Nekrose .
Pathophysiologie

Die auffälligsten histopathologischen Veränderungen der aneurysmatischen Aorta sind in den Tunica media und Intimaschichten zu sehen . Diese Veränderungen umfassen die Ansammlung von Lipiden in Schaumzellen , extrazelluläre freie Cholesterinkristalle , Verkalkungen , Thrombosen und Geschwüre und Risse der Schichten. Adventitielles entzündliches Infiltrat ist vorhanden. Der Abbau der Tunica media durch einen proteolytischen Prozess scheint jedoch der grundlegende pathophysiologische Mechanismus der AAA-Entwicklung zu sein. Einige Forscher berichten von einer erhöhten Expression und Aktivität von Matrix- Metalloproteinasen bei Personen mit AAA. Dies führt zu einer Elimination von Elastin aus der Media, wodurch die Aortenwand anfälliger für den Einfluss des Blutdrucks wird . Andere Berichte haben vorgeschlagen, dass die Serinprotease Granzym B durch die Spaltung von Decorin zur Ruptur des Aortenaneurysmas beitragen kann , was zu einer gestörten Kollagenorganisation und einer verringerten Zugfestigkeit der Adventitia führt. Auch in der Bauchschlagader (im Vergleich zur Brustschlagader) ist die Menge an Vasa vasorum reduziert ; Folglich muss die Tunica media hauptsächlich auf Diffusion als Nahrung angewiesen sein, was sie anfälliger für Schäden macht.
Die Hämodynamik beeinflusst die Entwicklung des AAA, das eine Vorliebe für die infrarenale Aorta hat. Die histologische Struktur und die mechanischen Eigenschaften der infrarenalen Aorta unterscheiden sich von denen der thorakalen Aorta . Der Durchmesser nimmt von der Wurzel bis zur Aortenbifurkation , und die Wand der infrarenalen Aorta enthält auch einen geringeren Anteil an Elastin . Die mechanische Spannung in der Bauchaortenwand ist daher höher als in der Brustaortenwand. Auch die Elastizität und Dehnbarkeit nehmen mit zunehmendem Alter ab, was zu einer allmählichen Erweiterung des Segments führen kann. Ein erhöhter intraluminaler Druck bei Patienten mit arterieller Hypertonie trägt deutlich zum Fortschreiten des pathologischen Prozesses bei. Geeignete hämodynamische Bedingungen können mit spezifischen intraluminalen Thrombusmustern (ILT) entlang des Aortenlumens verbunden sein, die wiederum die Entwicklung des AAA beeinflussen können.
Diagnose
Ein abdominales Aortenaneurysma wird normalerweise durch körperliche Untersuchung , Ultraschall des Abdomens oder CT diagnostiziert . Einfache Röntgenaufnahmen des Abdomens können den Umriss eines Aneurysmas zeigen, wenn seine Wände verkalkt sind. Bei weniger als der Hälfte aller Aneurysmen ist der Umriss jedoch im Röntgenbild sichtbar. Die Ultraschalluntersuchung wird verwendet, um nach Aneurysmen zu suchen und die Größe eines Geschenks zu bestimmen. Zusätzlich kann freie Peritonealflüssigkeit nachgewiesen werden. Es ist nicht invasiv und empfindlich, aber das Vorhandensein von Darmgas oder Fettleibigkeit kann seine Nützlichkeit einschränken. Der CT-Scan hat eine fast 100-prozentige Sensitivität für ein Aneurysma und ist auch bei der präoperativen Planung nützlich, da er die Anatomie und die Möglichkeit einer endovaskulären Reparatur detailliert beschreibt. Bei Verdacht auf eine Ruptur kann es auch retroperitoneale Flüssigkeit zuverlässig erkennen. Alternative, weniger häufig verwendete Methoden zur Visualisierung eines Aneurysmas sind MRT und Angiographie .
Ein Aneurysma reißt, wenn die mechanische Belastung (Spannung pro Fläche) die lokale Wandstärke überschreitet; Folglich haben sich die maximale Wandspannung (PWS) und das maximale Wandbruchrisiko (PWRR) als zuverlässigere Parameter als der Durchmesser zur Beurteilung des AAA-Bruchrisikos erwiesen. Medizinische Software ermöglicht die Berechnung dieser Rupturrisikoindizes aus klinischen Standard-CT-Daten und bietet eine patientenspezifische AAA-Rupturrisikodiagnose. Es hat sich gezeigt, dass diese Art von biomechanischem Ansatz den Ort einer AAA-Ruptur genau vorhersagt.
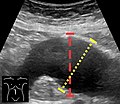
Aortenmessung im abdominalen Ultraschall in der axialen Ebene zwischen den äußeren Rändern der Aortenwand.
Ultraschall in der Sagittalebene , der das Maß der axialen Ebene (gestrichelte rote Linie) sowie den maximalen Durchmesser (gestrichelte gelbe Linie) zeigt, der bevorzugt wird.
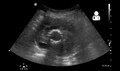
Ultraschall zeigt ein zuvor repariertes AAA, das mit Fluss um das Transplantat undicht wird
Einstufung
| Ektatische oder leichte Dilatation |
>2,0 cm und <3,0 cm |
| Mäßig | 3,0 - 5,0 cm |
| Groß oder schwer | >5,0 oder 5,5 cm |
Bauchaortenaneurysmen werden häufig nach ihrer Größe und Symptomatik unterteilt. Ein Aneurysma wird normalerweise als ein äußerer Aortendurchmesser von mehr als 3 cm (der normale Durchmesser der Aorta beträgt etwa 2 cm) oder mehr als 50% des normalen Durchmessers definiert. Wenn der Außendurchmesser 5,5 cm überschreitet, gilt das Aneurysma als groß. Bei jeder älteren Person (Alter > 60) mit Kollaps, unerklärlichem niedrigem Blutdruck oder plötzlich einsetzenden Rücken- oder Bauchschmerzen sollte ein AAA-Ruptur vermutet werden. Bauchschmerzen, Schock und eine pulsierende Raumforderung sind nur in einer Minderheit der Fälle vorhanden. Obwohl eine instabile Person mit einem bekannten Aneurysma ohne weitere Bildgebung operiert werden kann, wird die Diagnose in der Regel durch CT- oder Ultraschalluntersuchungen bestätigt.
Die suprarenale Aorta ist normalerweise etwa 0,5 cm größer als die infrarenale Aorta.
Differenzialdiagnose
Eine Aortenaneurysmaruptur kann mit Nierensteinschmerzen oder muskelbedingten Rückenschmerzen verwechselt werden .
Verhütung
- Raucherentwöhnung
- Behandlung von Bluthochdruck
Screening
Die US Preventive Services Task Force (USPSTF) empfiehlt bei Männern im Alter von 65 bis 75 Jahren, die in der Vorgeschichte geraucht haben, eine einmalige Ultraschalluntersuchung des Bauchraums auf ein Bauchaortenaneurysma. Unter dieser Gruppe, die kein Rauchscreening durchführt, kann es sein, dass sie selektiv sind. Es ist unklar, ob ein Screening bei Frauen, die geraucht haben, sinnvoll ist, und die USPSTF empfiehlt von einem Screening bei Frauen, die noch nie geraucht haben.
Im Vereinigten Königreich lädt das NHS AAA Screening Program Männer in England zu einem Screening im Jahr ihres 65. Lebensjahres ein. Männer über 65 können sich an das Programm wenden, um ein Screening zu vereinbaren.
In Schweden wird ein einmaliges Screening bei allen Männern über 65 Jahren empfohlen. Es wurde festgestellt, dass dies das Sterberisiko durch AAA um 42 % verringert, wobei eine Anzahl von etwas mehr als 200 für das Screening erforderlich ist. Bei Patienten mit einem nahen Verwandten, bei dem ein Aortenaneurysma diagnostiziert wurde, empfehlen schwedische Leitlinien eine Ultraschalluntersuchung im Alter von etwa 60 Jahren.
Australien hat keine Richtlinie zum Screening.
Bei Patienten mit einer Aortengröße von mehr als 3,0 cm sollten wiederholte Ultraschalluntersuchungen durchgeführt werden. Bei Patienten mit einer Aorta zwischen 3,0 und 3,9 cm sollte dies alle drei Jahre sein, wenn zwischen 4,0 und 4,4 cm alle zwei Jahre und wenn zwischen 4,5 und 5,4 cm jedes Jahr.
Verwaltung
Die Behandlungsoptionen für asymptomatisches AAA sind konservative Behandlung, Überwachung im Hinblick auf eine eventuelle Reparatur und sofortige Reparatur. Für ein AAA stehen zwei Reparaturmethoden zur Verfügung: offene Aneurysma-Reparatur und endovaskuläre Aneurysma-Reparatur ( EVAR ). Ein Eingriff wird oft empfohlen, wenn das Aneurysma mehr als 1 cm pro Jahr wächst oder größer als 5,5 cm ist. Eine Reparatur ist auch bei symptomatischen Aneurysmen indiziert. Zehn Jahre nach der offenen AAA-Reparatur betrug die Gesamtüberlebensrate 59 %.
Konservativ
Eine konservative Behandlung ist angezeigt bei Patienten, bei denen die Reparatur ein hohes Mortalitätsrisiko birgt, und bei Patienten, bei denen eine Verbesserung der Lebenserwartung unwahrscheinlich ist. Die tragende Säule der konservativen Behandlung ist das Rauchen Aufhören.
Eine Überwachung ist bei kleinen asymptomatischen Aneurysmen (weniger als 5,5 cm) angezeigt, bei denen das Risiko einer Reparatur das Risiko einer Ruptur übersteigt. Mit zunehmendem Durchmesser eines AAA steigt das Risiko einer Ruptur. Die Überwachung bis ein Aneurysma einen Durchmesser von 5,5 cm erreicht hat, hat kein höheres Risiko als eine Frühintervention.
Medikation
Es hat sich keine medizinische Therapie als wirksam erwiesen, die Wachstumsrate oder Rupturrate asymptomatischer AAAs zu verringern. Blutdruck und Lipide sollten jedoch wie gewohnt behandelt werden.
Operation
Der Schwellenwert für eine Reparatur variiert leicht von Person zu Person, je nach dem Verhältnis von Risiken und Nutzen bei der Betrachtung einer Reparatur gegenüber einer laufenden Überwachung. Die Größe der natürlichen Aorta einer Person kann dies beeinflussen, zusammen mit dem Vorhandensein von Komorbiditäten, die das Operationsrisiko erhöhen oder die Lebenserwartung verringern. Beweise unterstützen jedoch normalerweise keine Reparatur, wenn die Größe weniger als 5,5 cm beträgt.
Reparatur öffnen
Die offene Reparatur ist bei jungen Patienten als elektiven Eingriff indiziert, bei wachsenden oder großen symptomatischen oder rupturierten Aneurysmen. Die Aorta muss während der Reparatur abgeklemmt werden, um den Bauchorganen und Abschnitten des Rückenmarks Blut zu verweigern ; dies kann eine Reihe von Komplikationen verursachen. Es ist wichtig, den kritischen Teil der Operation schnell zu machen, daher wird der Schnitt normalerweise groß genug gemacht, um die schnellste Reparatur zu ermöglichen. Die Genesung nach einer offenen AAA-Operation nimmt viel Zeit in Anspruch. Das Minimum beträgt einige Tage auf der Intensivstation, insgesamt eine Woche im Krankenhaus und einige Monate bis zur vollständigen Genesung.
Endovaskuläre Reparatur
Die endovaskuläre Reparatur wurde erstmals in den 1990er Jahren praktikabel und obwohl sie heute eine etablierte Alternative zur offenen Reparatur ist, muss ihre Rolle noch klar definiert werden. Es ist im Allgemeinen bei älteren Hochrisikopatienten oder Patienten angezeigt, die für eine offene Reparatur nicht geeignet sind. Je nach Morphologie des Aneurysmas ist jedoch nur bei einem Teil der AAA eine endovaskuläre Reparatur möglich. Die Hauptvorteile gegenüber der offenen Rekonstruktion sind die geringere perioperative Mortalität, weniger Zeit auf der Intensivstation , insgesamt weniger Zeit im Krankenhaus und eine frühere Rückkehr zur normalen Aktivität. Nachteile der endovaskulären Reparatur sind die Notwendigkeit häufigerer laufender Krankenhausuntersuchungen und eine höhere Wahrscheinlichkeit, dass weitere Verfahren erforderlich sind. Nach neuesten Studien bietet das EVAR-Verfahren keinen Vorteil für das Gesamtüberleben oder die gesundheitsbezogene Lebensqualität gegenüber der offenen Operation, obwohl die aneurysmabedingte Mortalität geringer ist. Bei Patienten, die für eine offene Behandlung nicht geeignet waren, war EVAR plus konservative Behandlung im Vergleich zur alleinigen konservativen Behandlung mit keinem Nutzen, mehr Komplikationen, Folgeeingriffen und höheren Kosten verbunden. Auch eine endovaskuläre Behandlung paraanastomotischer Aneurysmen nach aortobiiliakaler Rekonstruktion ist möglich. Ein Cochrane-Review aus dem Jahr 2017 ergab vorläufige Hinweise darauf, dass es keinen Unterschied in den Ergebnissen zwischen endovaskulärer und offener Reparatur von rupturiertem AAA im ersten Monat gibt.
Bruch
Bei Patienten mit Aortenruptur des AAA besteht die Behandlung in einer sofortigen chirurgischen Reparatur. Es scheint Vorteile zu geben, eine permissive Hypotonie zuzulassen und die Verwendung von intravenösen Flüssigkeiten während des Transports in den Operationssaal einzuschränken.
Prognose
| AAA-Größe (cm) | Wachstumsrate (cm/Jahr) | Jährliches Bruchrisiko (%) |
|---|---|---|
| 3,0-3,9 | 0,39 | 0 |
| 4,0-4,9 | 0,36 | 0,5-5 |
| 5,0-5,9 | 0,43 | 3-15 |
| 6,0-6,9 | 0,64 | 10-20 |
| >=7,0 | - | 20-50 |
Obwohl der aktuelle Standard zur Bestimmung des Rupturrisikos auf dem maximalen Durchmesser basiert, ist bekannt, dass auch kleinere AAAs, die unter diesen Schwellenwert fallen (Durchmesser <5,5 cm), rupturieren können und größere AAAs (Durchmesser >5,5 cm) stabil bleiben können. In einem Bericht wurde gezeigt, dass 10–24 % der rupturierten AAAs einen Durchmesser von weniger als 5 cm aufwiesen. Es wurde auch berichtet, dass von 473 nicht reparierten AAAs, die anhand von Autopsieberichten untersucht wurden, 118 Rupturen auftraten, von denen 13% einen Durchmesser von weniger als 5 cm hatten. Diese Studie zeigte auch, dass 60 % der AAAs größer als 5 cm (einschließlich 54 % der AAAs zwischen 7,1 und 10 cm) nie eine Ruptur erlitten. Vorp et al. später aus den Erkenntnissen von Darling et al. dass bei Einhaltung des Kriteriums des maximalen Durchmessers für die 473 Patienten nur 7 % (34/473) der Fälle vor dem chirurgischen Eingriff einer Ruptur erlegen wären, da der Durchmesser weniger als 5 cm betrug, mit 25 % (116/473) von Fälle, die möglicherweise einer unnötigen Operation unterzogen werden, da diese AAAs möglicherweise nie geplatzt sind.
Kürzlich wurde über alternative Methoden der Bruchbeurteilung berichtet. Die meisten dieser Ansätze beinhalten die numerische Analyse von AAAs unter Verwendung der üblichen Ingenieurtechnik der Finite-Elemente-Methode (FEM), um die Wandspannungsverteilungen zu bestimmen. Jüngste Berichte haben gezeigt, dass diese Spannungsverteilungen mit der Gesamtgeometrie des AAA korrelieren und nicht nur mit dem maximalen Durchmesser. Es ist auch bekannt, dass die Wandspannung allein das Versagen nicht vollständig regelt, da ein AAA normalerweise reißt, wenn die Wandspannung die Wandfestigkeit überschreitet. Vor diesem Hintergrund kann die Rupturbeurteilung genauer sein, wenn sowohl die patientenspezifische Wandspannung mit der patientenspezifischen Wandstärke gekoppelt wird. Kürzlich wurde über eine nicht-invasive Methode zur Bestimmung der patientenabhängigen Wandstärke berichtet, wobei traditionellere Ansätze zur Festigkeitsbestimmung durch Zugversuche von anderen Forschern auf diesem Gebiet durchgeführt wurden. Einige der in jüngerer Zeit vorgeschlagenen AAA-Ruptur-Risikobewertungsmethoden umfassen: AAA-Wandbelastung; AAA-Expansionsrate; Grad der Asymmetrie; Vorhandensein eines intraluminalen Thrombus (ILT); ein Bruchpotentialindex (RPI); ein Bruchindex der Finite-Elemente-Analyse (FEARI); biomechanische Faktoren gekoppelt mit Computeranalyse; Wachstum von ILT; geometrische Parameter des AAA; und auch ein Verfahren zur Bestimmung von AAA-Wachstum und -Ruptur basierend auf mathematischen Modellen.
Die postoperative Mortalität eines bereits rupturierten AAA ist über mehrere Jahrzehnte langsam zurückgegangen, liegt aber nach wie vor bei über 40%. Wenn das AAA jedoch vor der Ruptur chirurgisch repariert wird, ist die postoperative Sterblichkeitsrate wesentlich niedriger: ca. 1-6%.
Epidemiologie
Das Auftreten von AAA variiert je nach ethnischer Zugehörigkeit. Im Vereinigten Königreich beträgt die AAA-Rate bei kaukasischen Männern über 65 Jahren etwa 4,7%, während sie bei asiatischen Männern 0,45% beträgt. Es ist auch weniger verbreitet bei Personen afrikanischer und hispanischer Herkunft. Sie treten bei Männern viermal häufiger auf als bei Frauen.
In den USA gibt es jährlich mindestens 13.000 Todesfälle infolge einer AAA-Ruptur. Die Spitzenzahl der Neuerkrankungen pro Jahr bei Männern liegt bei etwa 70 Jahren, der Anteil der Männer über 60 Jahre liegt bei 2–6%. Die Häufigkeit ist bei Rauchern viel höher als bei Nichtrauchern (8:1), und das Risiko nimmt nach Beendigung des Rauchens langsam ab . In den USA beträgt die Inzidenz von AAA 2–4% in der erwachsenen Bevölkerung.
Eine Ruptur des AAA tritt bei 1–3% der Männer ab 65 Jahren auf, die Mortalität beträgt 70–95%.
Geschichte
Die ersten historischen Aufzeichnungen über AAA sind von antiken Rom im 2. Jahrhundert nach Christus, als griechische Chirurg Antyllus versucht , die AAA mit zu behandeln proximalen und distalen Ligatur , zentralen Einschnitt und das Entfernen von thrombotischen Material aus dem Aneurysma . Versuche, das AAA chirurgisch zu behandeln, waren jedoch bis 1923 erfolglos. In diesem Jahr führte Rudolph Matas (der auch das Konzept der Endoaneurysmorrhaphie vorschlug) die erste erfolgreiche Aortenligatur an einem Menschen durch. Andere Verfahren, die bei der Behandlung des AAA erfolgreich waren, umfassten das Umhüllen der Aorta mit Polyethylencellophan , was Fibrose induzierte und das Wachstum des Aneurysmas einschränkte. Die endovaskuläre Aneurysma-Reparatur wurde erstmals in den späten 1980er Jahren durchgeführt und in den folgenden Jahrzehnten weit verbreitet. Die endovaskuläre Reparatur wurde erstmals 1994 in Nottingham zur Behandlung eines rupturierten Aneurysmas eingesetzt.
Gesellschaft und Kultur
Theoretische Physiker Albert Einstein wurde für ein Bauchaortenaneurysma 1949 von operierten Rudolph Nissen , der die Aorta mit polyethene umwickelt Zellophan . Einsteins Aneurysma platzte am 13. April 1955. Er lehnte eine Operation ab und sagte: "Ich möchte gehen, wann ich will. Es ist geschmacklos, das Leben künstlich zu verlängern. Ich habe meinen Beitrag geleistet, es ist Zeit zu gehen. Ich werde es elegant machen. " Er starb fünf Tage später im Alter von 76 Jahren.
Die Schauspielerin Lucille Ball starb am 26. April 1989 an einem Bauchaortenaneurysma. Zum Zeitpunkt ihres Todes befand sie sich im Cedars-Sinai Medical Center und erholte sich von einer Notoperation, die nur sechs Tage zuvor wegen eines präparierenden Aortenaneurysmas in der Nähe ihres Herzens durchgeführt worden war. Ball war einem erhöhten Risiko ausgesetzt, da sie seit Jahrzehnten starke Raucherin war.
Der Musiker Conway Twitty starb im Juni 1993 im Alter von 59 Jahren an einem Bauchaortenaneurysma, zwei Monate vor der Veröffentlichung seines letzten Studioalbums Final Touches .
Der Schauspieler George C. Scott starb 1999 im Alter von 71 Jahren an einem gerissenen Bauchaortenaneurysma.
Im Jahr 2001 wurde der ehemalige Präsidentschaftskandidat Bob Dole wegen eines Bauchaortenaneurysmas operiert, bei dem ein Team um den Gefäßchirurgen Kenneth Ouriel einen Stentgraft eingesetzt hat:
Ouriel sagte, dass das Team einen Y-förmigen Schlauch durch einen Schnitt in Doles Bein eingeführt und in den geschwächten Teil der Aorta platziert hat. Das Aneurysma zieht sich schließlich um den Stent herum zusammen, der für den Rest von Doles Leben an Ort und Stelle bleibt.
Schauspieler Robert Jacks , der Leatherface in Texas Chainsaw Massacre: The Next Generation spielte , starb am 8. August 2001, nur einen Tag vor seinem 42. Geburtstag, an einem Bauchaneurysma. Sein Vater starb auch an der gleichen Ursache, als Robert ein Kind war.
Der Schauspieler Tommy Ford starb im Oktober 2016 im Alter von 52 Jahren an einem Bauchaneurysma.
Gary Gygax, Mitschöpfer von Dungeons and Dragons, starb 2008 im Alter von 69 Jahren an einem Bauchaortenaneurysma.
Forschung
Risikoabschätzung
In den letzten Jahren gab es viele Forderungen nach alternativen Ansätzen zur Risikobewertung von Rupturen, wobei viele der Ansicht waren, dass ein biomechanikbasierter Ansatz besser geeignet sein könnte als der aktuelle Durchmesseransatz. Numerische Modellierung ist ein wertvolles Werkzeug für Forscher, das es ermöglicht, ungefähre Wandspannungen zu berechnen und so das Rupturpotenzial eines bestimmten Aneurysmas aufzudecken. Experimentelle Modelle sind erforderlich, um diese numerischen Ergebnisse zu validieren und einen weiteren Einblick in das biomechanische Verhalten des AAA zu geben. In vivo zeigen AAAs einen variierenden Bereich von Materialstärken von lokalisierten schwach hypoxischen Regionen bis zu viel stärkeren Regionen und Bereichen mit Verkalkungen.
Die Suche nach Wegen zur Vorhersage des zukünftigen AAA-Wachstums wird als Forschungspriorität angesehen.
Experimentelle Modelle
Experimentelle Modelle können nun mit einer neuartigen Technik hergestellt werden, die das Spritzgussverfahren zur Herstellung von Wachsausschmelzverfahren umfasst, um patientenspezifische anatomisch korrekte AAA-Replikate zu erstellen. Die Arbeit konzentrierte sich auch auf die Entwicklung realistischerer Materialanaloga zu denen in vivo , und kürzlich wurde eine neue Reihe von Silikonkautschuken entwickelt, die es ermöglichen, die unterschiedlichen Materialeigenschaften des AAA genauer darzustellen. Diese Gummimodelle können auch in einer Vielzahl von experimentellen Situationen verwendet werden, von der Stressanalyse mit der photoelastischen Methode Es werden neue endovaskuläre Geräte entwickelt, die in der Lage sind, komplexere und gewundenere Anatomien zu behandeln .
Prävention und Behandlung
Eine Tierstudie zeigte, dass die Entfernung eines einzelnen Proteins verhindert, dass eine frühzeitige Schädigung der Blutgefäße Komplikationen im späteren Stadium auslöst. Durch die Eliminierung des Gens für ein Signalprotein namens Cyclophilin A (CypA) aus einem Mäusestamm konnten die Forscher einen vollständigen Schutz vor einem Bauchaortenaneurysma bieten.
Andere neuere Forschungen identifizierten Granzyme B ( GZMB ) (ein proteinabbauendes Enzym) als potenzielles Ziel bei der Behandlung von Bauchaortenaneurysmen. Die Eliminierung dieses Enzyms in Mausmodellen verlangsamte sowohl das Fortschreiten von Aneurysmen als auch das Überleben.
Präklinische Forschung
Die Mechanismen, die zur Entwicklung von AAA führen, sind auf zellulärer und molekularer Ebene noch nicht vollständig verstanden. Um die Pathophysiologie des AAA besser zu verstehen, ist es oft notwendig, experimentelle Tiermodelle zu verwenden. Es wird oft in Frage gestellt, wie gut sich diese Modelle auf menschliche Krankheiten übertragen lassen. Auch wenn es kein Tiermodell gibt, das den menschlichen Zustand exakt abbildet, konzentrieren sich alle existierenden auf einen anderen pathophysiologischen Aspekt der Krankheit. Die Kombination der Ergebnisse aus verschiedenen Tiermodellen mit klinischer Forschung kann einen besseren Überblick über die Pathophysiologie des AAA geben. Die häufigsten Tiermodelle sind Nagetiere (Mäuse und Ratten), obwohl für bestimmte Studien, wie das Testen präklinischer Geräte oder chirurgischer Eingriffe, häufiger Großtiermodelle (Schwein, Schaf) verwendet werden. Die Nagermodelle des AAA lassen sich nach verschiedenen Aspekten klassifizieren. Es gibt präparierende Modelle vs. nicht präparierende Modelle und genetisch bedingte Modelle vs. chemisch induzierte Modelle. Die am häufigsten verwendeten Modelle sind die Angiotensin-II-Infusion in ApoE-Knockout-Mäuse (sezierendes Modell, chemisch induziert), das Calciumchlorid-Modell (nicht sezierend, chemisch induziert) und das Elastase-Modell (nicht sezierendes, chemisch induziertes Modell).
Verweise
Externe Links
| Einstufung | |
|---|---|
| Externe Ressourcen |