Alkohol - Alcohol

In der Chemie ist Alkohol eine organische Verbindung , die mindestens eine funktionelle Hydroxylgruppe (-OH) trägt, die an ein gesättigtes Kohlenstoffatom gebunden ist. Der Begriff Alkohol bezog sich ursprünglich auf den primären Alkohol Ethanol (Ethylalkohol), der als Droge verwendet wird und der Hauptalkohol in alkoholischen Getränken ist . Eine wichtige Klasse von Alkoholen, von denen Methanol und Ethanol die einfachsten Vertreter sind, umfasst alle Verbindungen mit der allgemeinen Formel C n H 2n+1 OH. Einfache Monoalkohole, die Gegenstand dieses Artikels sind, umfassen primäre (RCH 2 OH), sekundäre (R 2 CHOH) und tertiäre (R 3 COH) Alkohole.
Das Suffix -ol erscheint im chemischen Namen der IUPAC aller Stoffe, bei denen die Hydroxylgruppe die funktionelle Gruppe mit der höchsten Priorität ist. Wenn eine Gruppe mit höherer Priorität in der Verbindung vorhanden ist, wird das Präfix Hydroxy- in ihrem IUPAC- Namen verwendet. Das Suffix -ol in Nicht-IUPAC-Namen (wie Paracetamol oder Cholesterin ) weist typischerweise auch darauf hin, dass es sich bei der Substanz um einen Alkohol handelt. Viele Substanzen, die funktionelle Hydroxylgruppen enthalten (insbesondere Zucker, wie Glucose und Saccharose ), haben jedoch Namen, die weder das Suffix -ol noch das Präfix Hydroxy- enthalten .
Geschichte
Die brennbaren Natur der Ausdünstungen von Wein wurde schon zu den alten Naturphilosophen bekannt sind, wie Aristoteles (384-322 BCE), Theophrastus (c. 371-287 BCE), und Plinius der Ältere (23 / 24-79 CE). Dies führte jedoch nicht sofort zur Isolierung von Alkohol, auch wenn im römischen Ägypten des zweiten und dritten Jahrhunderts fortschrittlichere Destillationstechniken entwickelt wurden . Eine wichtige Anerkennung, zuerst in einen der Schriften zugeschrieben gefunden Jābir ibn Ḥayyān (neunte Jahrhundert CE), das durch war die Zugabe von Salz zum Kochen Wein, der der Weines erhöht relative Flüchtigkeit kann die Entflammbarkeit der resultierenden Dämpfe verbessert. Die Destillation von Wein wird in Arabisch attestiert Werke zugeschrieben al-Kindi und (c 801-873 CE.) Al-Farabi , und in der 28. Buch von (c 872-950.) Albucasis ‚s (lateinisch: Abulcasis , 936–1013) Kitāb al-Taṣrīf (später als Liber servatoris ins Lateinische übersetzt ). Im 12. Jahrhundert tauchten in einer Reihe von lateinischen Werken Rezepte für die Herstellung von aqua ardens ("brennendes Wasser", dh Alkohol) durch Destillieren von Wein mit Salz auf, und bis zum Ende des 13. Jahrhunderts wurde es zu einem weit verbreiteten bekannte Substanz unter westeuropäischen Chemikern. Seine medizinischen Eigenschaften wurden durch sucht Arnald von Villanova (1240-1311 CE) und John von Rupescissa (c. 1310-1366), von denen der letztere betrachtet es als lebenserhaltende Substanz in der Lage , alle Krankheiten zu verhindern (die aqua vitae oder " Wasser des Lebens", von Johannes auch die Quintessenz des Weines genannt).
Nomenklatur
Etymologie
Das Wort "Alkohol" kommt vom arabischen Kajal ( arabisch : الكحل , romanisiert : al-kuḥl ), einem Puder, das als Eyeliner verwendet wird. Al- ist der arabische bestimmte Artikel , der dem im Englischen entspricht. Alkohol wurde ursprünglich für das sehr feine Pulver verwendet, das durch die Sublimation des natürlichen Minerals Stibnit zu Antimontrisulfid Sb . entsteht
2S
3. Es galt als die Essenz oder der "Geist" dieses Minerals. Es wurde als Antiseptikum , Eyeliner und Kosmetik verwendet . Die Bedeutung von Alkohol wurde auf destillierte Substanzen im Allgemeinen ausgedehnt und dann auf Ethanol verengt, als "Spirituosen" ein Synonym für Schnaps war .
Bartholomäus Traheron führt in seiner Übersetzung von John of Vigo aus dem Jahr 1543 das Wort als Begriff ein, der von "barbarischen" Autoren für "feines Pulver" verwendet wird. Vigo schrieb: "Die barbarischen Auctours verwenden Alkohol oder (wie ich es manchmal schreibe) Alcofoll für die feinste Puder."
Das Lexicon Chymicum von 1657 von William Johnson beschönigt das Wort als "antimonium sive stibium". Als Erweiterung bezeichnete das Wort jede durch Destillation gewonnene Flüssigkeit, einschließlich "Alkohol von Wein", der destillierten Essenz des Weines. Libavius in Alchymia (1594) bezieht sich auf "vini Alkohol vel vinum alcalisatum". Johnson (1657) Glosses Alkohol Vini als "quando Omnis- superfluitas Vini a vino separatur, ITA ut accensum ardeat donec totum consumatur, nihilque fæcum aut phlegmatis in fundo remaneat." Die Bedeutung des Wortes wurde zu „Weingeist“ beschränkt (die heute als bekannte chemische Ethanol ) im 18. Jahrhundert und wurde in die Klasse von Substanzen ausgedehnt sogenannten als „Alkohole“ in der modernen Chemie nach 1850.
Der Begriff Ethanol wurde 1892 erfunden und vermischte „ Ethan “ mit der „-ol“-Endung von „Alkohol“, die als Libfix verallgemeinert wurde .
Systematische Namen
Die IUPAC-Nomenklatur wird in wissenschaftlichen Veröffentlichungen verwendet und dort, wo eine genaue Identifizierung des Stoffes wichtig ist, insbesondere in Fällen, in denen die relative Komplexität des Moleküls einen so systematischen Namen nicht unhandlich macht. Bei der Benennung einfacher Alkohole verliert der Name der Alkankette das terminale e und fügt das Suffix -ol hinzu , zB , wie in "Ethanol" aus dem Alkankettennamen "Ethan". Falls erforderlich, wird die Position der Hydroxylgruppe durch eine Zahl zwischen dem Alkannamen und dem -ol angegeben : Propan-1-ol für CH
3CH
2CH
2OH , Propan-2-ol für CH
3CH(OH)CH
3. Wenn eine Gruppe mit höherer Priorität vorhanden ist (wie ein Aldehyd , Keton oder Carbonsäure ), dann wird das Präfix Hydroxy- verwendet, z. B. wie in 1-Hydroxy-2-propanon ( CH
3C(O)CH
2OH ).
In Fällen, in denen die OH-funktionelle Gruppe an einen sp 2 -Kohlenstoff an einem aromatischen Ring gebunden ist, wird das Molekül als Phenol bezeichnet und nach den IUPAC-Regeln für die Benennung von Phenolen benannt.
Gebräuchliche Namen
In anderen weniger formalen Zusammenhängen wird ein Alkohol oft mit dem Namen der entsprechenden Alkylgruppe gefolgt von dem Wort "Alkohol" bezeichnet, zB Methylalkohol , Ethylalkohol . Propyl- Alkohol kann n - Propylalkohol oder Isopropylalkohol , je nachdem , ob sich die Hydroxylgruppe am Ende oder in der Mitte Kohlenstoff auf der geraden gebunden ist Propan - Kette. Wie bei der systematischen Benennung beschrieben, wird, wenn eine andere Gruppe am Molekül Priorität hat, die Alkoholgruppe oft mit dem Präfix "Hydroxy-" angegeben.
Alkohole werden dann in primäre, sekundäre ( sec- , s- ) und tertiäre ( tert- , t- ) klassifiziert , basierend auf der Anzahl der Kohlenstoffatome, die mit dem Kohlenstoffatom verbunden sind, das die funktionelle Hydroxylgruppe trägt . (Die entsprechenden numerischen Abkürzungen 1°, 2° und 3° werden manchmal auch in informellen Umgebungen verwendet.) Die primären Alkohole haben die allgemeinen Formeln RCH 2 OH. Der einfachste primäre Alkohol ist Methanol (CH 3 OH), für den R = H ist, und der nächste ist Ethanol, für den R = CH 3 , die Methylgruppe, ist . Sekundäre Alkohole sind solche der Form RR'CHOH, die einfachste, die 2-propanol (R = R '= CH 3 ). Für die tertiären Alkohole ist die allgemeine Form RR'R"COH. Das einfachste Beispiel ist tert.-Butanol (2-Methylpropan-2-ol), für das jedes von R, R' und R" CH 3 ist . In diesen Abkürzungen bedeuten R, R' und R" Substituenten , Alkyl oder andere gebundene, im Allgemeinen organische Gruppen.
In der archaischen Nomenklatur können Alkohole als Derivate von Methanol mit "-carbinol" als Endung bezeichnet werden. (CH 3 ) 3 COH kann beispielsweise als Trimethylcarbinol bezeichnet werden.
| Typ | Formel | IUPAC- Name | Gemeinsamen Namen |
|---|---|---|---|
|
Einwertige Alkohole |
CH 3 OH | Methanol | Holzalkohol |
| C 2 H 5 OH | Ethanol | Alkohol | |
| C 3 H 7 OH | Propan-2-ol | Isopropylalkohol, Reinigungsalkohol |
|
| C 4 H 9 OH | Butan-1-ol | Butanol, Butylalkohol |
|
| C 5 H 11 OH | Pentan-1-ol | Pentanol, Amylalkohol |
|
| C 16 H 33 OH | Hexadecan-1-ol | Cetylalkohol | |
|
Mehrwertige Alkohole |
C 2 H 4 (OH) 2 | Ethan-1,2-diol | Ethylenglykol |
| C 3 H 6 (OH) 2 | Propan-1,2-diol | Propylenglykol | |
| C 3 H 5 (OH) 3 | Propan-1,2,3-triol | Glycerin | |
| C 4 H 6 (OH) 4 | Butan-1,2,3,4-tetraol |
Erythrit , Threitol |
|
| C 5 H 7 (OH) 5 | Pentan-1,2,3,4,5-pentol | Xylit | |
| C 6 H 8 (OH) 6 | Hexan-1,2,3,4,5,6-hexol |
Mannit , Sorbit |
|
| C 7 H 9 (OH) 7 | Heptan-1,2,3,4,5,6,7-Heptol | Volemitol | |
|
Ungesättigte aliphatische Alkohole |
C 3 H 5 OH | Prop-2-en-1-ol | Allylalkohol |
| C 10 H 17 OH | 3,7-Dimethylocta-2,6-dien-1-ol | Geraniol | |
| C 3 H 3 OH | Prop-2-in-1-ol | Propargylalkohol | |
|
Alicyclische Alkohole |
C 6 H 6 (OH) 6 | Cyclohexan-1,2,3,4,5,6-hexol | Inositol |
| C 10 H 19 OH | 5-Methyl-2-(propan-2-yl)cyclohexan-1-ol | Menthol |
Anwendungen

Alkohole haben eine lange Geschichte der unzähligen Anwendungen. Für einfache Monoalkohole, die in diesem Artikel im Mittelpunkt stehen, sind die wichtigsten Industriealkohole:
- Methanol, hauptsächlich zur Herstellung von Formaldehyd und als Kraftstoffzusatz
- Ethanol, hauptsächlich für alkoholische Getränke, Kraftstoffzusatz, Lösungsmittel
- 1-Propanol, 1-Butanol und Isobutylalkohol zur Verwendung als Lösungsmittel und Vorläufer von Lösungsmitteln
- C6–C11-Alkohole für Weichmacher , z. B. in Polyvinylchlorid
- Fettalkohol (C12–C18), Vorstufen von Waschmitteln
Methanol ist der am weitesten verbreitete Industriealkohol mit einer Produktion von etwa 12 Millionen Tonnen pro Jahr im Jahr 1980. Die Gesamtkapazität der anderen Alkohole ist ungefähr gleich, etwa gleich verteilt.
Toxizität
Hinsichtlich der akuten Toxizität weisen einfache Alkohole geringe akute Toxizitäten auf. Dosen von mehreren Millilitern werden toleriert. Für Pentanole , Hexanole , Octanole und längere Alkohole liegt die LD50 im Bereich von 2–5 g/kg (Ratten, oral). Methanol und Ethanol sind weniger akut toxisch. Alle Alkohole sind milde Hautreizstoffe.
Der Metabolismus von Methanol (und Ethylenglykol) wird durch die Anwesenheit von Ethanol beeinflusst, das eine höhere Affinität zur Leberalkoholdehydrogenase aufweist . Auf diese Weise wird Methanol intakt über den Urin ausgeschieden.
Physikalische Eigenschaften
Im Allgemeinen macht die Hydroxylgruppe Alkohole polar . Diese Gruppen können untereinander und zu den meisten anderen Verbindungen Wasserstoffbrückenbindungen bilden . Aufgrund der Anwesenheit der polaren OH sind Alkohole wasserlöslicher als einfache Kohlenwasserstoffe. Methanol, Ethanol und Propanol sind mit Wasser mischbar . Butanol mit einer Vier-Kohlenstoff-Kette ist mäßig löslich.
Wegen der Wasserstoffbrückenbindung neigen Alkohole zu höheren Siedepunkten als vergleichbare Kohlenwasserstoffe und Ether . Der Siedepunkt des Alkohols Ethanol beträgt 78,29 °C, verglichen mit 69 °C für den Kohlenwasserstoff Hexan und 34,6 °C für Diethylether .
Vorkommen in der Natur
Einfache Alkohole sind in der Natur weit verbreitet. Ethanol ist das bekannteste, weil es das Produkt der Fermentation ist, einem wichtigen Energiegewinnungsweg. Die anderen einfachen Alkohole werden nur in Spuren gebildet. Komplexere Alkohole sind jedoch weit verbreitet, was sich in Zuckern, einigen Aminosäuren und Fettsäuren manifestiert.
Produktion
Ziegler- und Oxo-Verfahren
Beim Ziegler-Verfahren werden aus Ethylen und Triethylaluminium lineare Alkohole hergestellt, gefolgt von Oxidation und Hydrolyse. Eine idealisierte Synthese von 1-Octanol wird gezeigt:
- Al(C 2 H 5 ) 3 + 9 C 2 H 4 → Al(C 8 H 17 ) 3
- Al(C 8 H 17 ) 3 + 3 O + 3 H 2 O → 3HOC 8 H 17 + Al(OH) 3
Der Prozess erzeugt eine Reihe von Alkoholen, die durch Destillation getrennt werden .
Viele höhere Alkohole werden durch Hydroformylierung von Alkenen gefolgt von Hydrierung hergestellt. Bei Anwendung auf ein endständiges Alken, wie üblich, erhält man typischerweise einen linearen Alkohol:
- RCH=CH 2 + H 2 + CO → RCH 2 CH 2 CHO
- RCH 2 CH 2 CHO + 3 H 2 → RCH 2 CH 2 CH 2 OH
Solche Verfahren ergeben Fettalkohole , die für Waschmittel nützlich sind.
Hydratationsreaktionen
Einige niedermolekulare Alkohole von technischer Bedeutung werden durch Anlagerung von Wasser an Alkene hergestellt. Ethanol, Isopropanol, 2-Butanol und tert-Butanol werden nach diesem allgemeinen Verfahren hergestellt. Es werden zwei Implementierungen verwendet, die direkte und die indirekte Methode. Die direkte Methode vermeidet die Bildung stabiler Zwischenstufen, typischerweise unter Verwendung von Säurekatalysatoren. Bei der indirekten Methode wird das Alken in den Sulfatester umgewandelt, der anschließend hydrolysiert wird. Die direkte Hydratation mit Ethylen ( Ethylenhydratation ) oder anderen Alkenen aus dem Cracken von Fraktionen von destilliertem Rohöl .
Die Hydratation wird auch industriell genutzt, um aus Ethylenoxid das Diol Ethylenglykol herzustellen .
Biologische Routen
Ethanol wird durch Fermentation mit Glukose gewonnen, die aus Zucker durch Hydrolyse von Stärke gewonnen wird , in Gegenwart von Hefe und einer Temperatur von weniger als 37 °C, um Ethanol zu produzieren. Beispielsweise könnte ein solcher Prozess durch die Umwandlung von Saccharose durch das Enzym Invertase in Glucose und Fructose und dann durch die Umwandlung von Glucose durch den Enzymkomplex Zymase in Ethanol und Kohlendioxid ablaufen .
Einige Arten der gutartigen Bakterien im Darm nutzen die Fermentation als eine Form des anaeroben Stoffwechsels . Bei dieser Stoffwechselreaktion entsteht Ethanol als Abfallprodukt. Daher enthält der menschliche Körper eine gewisse Menge an Alkohol, die von diesen Bakterien endogen produziert wird. In seltenen Fällen kann dies ausreichen, um ein „ Auto-Brauerei-Syndrom “ auszulösen, bei dem berauschende Mengen Alkohol produziert werden.
Butanol kann wie Ethanol durch Fermentationsverfahren hergestellt werden. Es ist bekannt, dass Saccharomyces-Hefe diese höheren Alkohole bei Temperaturen über 24 ° C produziert. Das Bakterium Clostridium acetobutylicum kann sich von Cellulose ernähren , um im industriellen Maßstab Butanol herzustellen.
Auswechslung
Primäre Alkylhalogenide reagieren mit wässriger NaOH oder KOH hauptsächlich zu primären Alkoholen in nukleophiler aliphatischer Substitution . (Sekundäre und insbesondere tertiäre Alkylhalogenide ergeben stattdessen das Eliminierungsprodukt (Alken).) Grignard-Reagenzien reagieren mit Carbonylgruppen zu sekundären und tertiären Alkoholen. Verwandte Reaktionen sind die Barbier-Reaktion und die Nozaki-Hiyama-Reaktion .
Die Ermäßigung
Aldehyde oder Ketone werden mit Natriumborhydrid oder Lithiumaluminiumhydrid (nach saurer Aufarbeitung) reduziert . Eine weitere Reduktion durch Aluminiumisopropylate ist die Meerwein-Ponndorf-Verley-Reduktion . Die asymmetrische Noyori-Hydrierung ist die asymmetrische Reduktion von β-Ketoestern.
Hydrolyse
Alkene gehen eine säurekatalysierte Hydratationsreaktion ein, wobei konzentrierte Schwefelsäure als Katalysator verwendet wird, die normalerweise sekundäre oder tertiäre Alkohole ergibt. Die Hydroborierung-Oxidation und Oxymercuration-Reduktion von Alkenen sind in der organischen Synthese zuverlässiger. Alkene reagieren mit NBS und Wasser in einer Halogenhydrin-Bildungsreaktion . Amine können in Diazoniumsalze umgewandelt werden , die dann hydrolysiert werden.
Die Bildung eines sekundären Alkohols durch Reduktion und Hydratation wird gezeigt:
Reaktionen
Deprotonierung
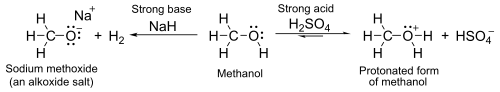
Mit einem pK a von etwa 16 bis 19, sind sie in der Regel etwas schwächer Säuren als Wasser . Mit starken Basen wie Natriumhydrid oder Natrium bilden sie Salze, sogenannte Alkoxide , mit der allgemeinen Formel R O – M + .
- 2 R-OH + 2 NaH → 2 RO − Na + + 2 H 2
- 2 R-OH + 2 Na → 2 RO − Na + + H 2
Der Säuregehalt von Alkoholen wird stark durch Solvatation beeinflusst . Alkohole sind in der Gasphase saurer als in Wasser.
Nucleophile Substitution
Die OH-Gruppe ist bei nukleophilen Substitutionsreaktionen keine gute Abgangsgruppe , daher reagieren neutrale Alkohole bei solchen Reaktionen nicht. Wenn der Sauerstoff jedoch zuerst zu R−OH 2 + protoniert wird , ist die Abgangsgruppe ( Wasser ) viel stabiler und die nukleophile Substitution kann stattfinden. Tertiäre Alkohole reagieren beispielsweise mit Salzsäure zu tertiären Alkylhalogeniden , bei denen die Hydroxylgruppe durch unimolekulare nukleophile Substitution durch ein Chloratom ersetzt wird . Sollen primäre oder sekundäre Alkohole mit Salzsäure umgesetzt werden , wird ein Aktivator wie Zinkchlorid benötigt. Alternativ kann die Umwandlung direkt unter Verwendung von Thionylchlorid durchgeführt werden . [1]
Alkohole können ebenfalls mit Bromwasserstoffsäure oder Phosphortribromid in Alkylbromide umgewandelt werden , zum Beispiel:
- 3 R-OH + PBr 3 → 3 RBr + H 3 PO 3
Bei der Barton-McCombie-Desoxygenierung wird ein Alkohol mit Tributylzinnhydrid oder einem Trimethylboran- Wasser-Komplex in einer radikalischen Substitutionsreaktion zu einem Alkan desoxygeniert .
Dehydration
Unterdessen hat das Sauerstoffatom einsame Paare nichtgebundener Elektronen, die es in Gegenwart starker Säuren wie Schwefelsäure schwach basisch machen . Zum Beispiel mit Methanol:
Bei Behandlung mit starken Säuren durchlaufen Alkohole die E1- Eliminierungsreaktion , um Alkene zu erzeugen . Die Reaktion folgt im Allgemeinen der Zaitsev-Regel , die besagt, dass das stabilste (normalerweise das am stärksten substituierte) Alken gebildet wird. Tertiäre Alkohole eliminieren leicht oberhalb der Raumtemperatur, aber primäre Alkohole erfordern eine höhere Temperatur.
Dies ist ein Diagramm der säurekatalysierten Dehydratisierung von Ethanol zur Herstellung von Ethylen :
Eine kontrolliertere Eliminierungsreaktion erfordert die Bildung des Xanthatesters .
Protonolyse
Tertiäre Alkohole reagieren mit starken Säuren zu Carbokationen. Die Reaktion hängt mit ihrer Dehydratisierung zusammen, zB von Isobutylen aus tert-Butylalkohol. Eine besondere Art der Dehydratisierungsreaktion ist Triphenylmethanol und insbesondere seine aminsubstituierten Derivate. Bei Behandlung mit Säure verlieren diese Alkohole Wasser, um stabile Carbokationen zu ergeben, die handelsübliche Farbstoffe sind.

Veresterung
Alkohol und Carbonsäuren reagieren bei der sogenannten Fischer-Veresterung . Die Reaktion erfordert normalerweise einen Katalysator wie konzentrierte Schwefelsäure:
- R-OH + R'-CO 2 H → R'-CO 2 R + H 2 O
Andere Estertypen werden auf ähnliche Weise hergestellt – zum Beispiel werden Tosyl (Tosylate) ester durch Reaktion des Alkohols mit p- Toluolsulfonylchlorid in Pyridin hergestellt.
Oxidation
Primäre Alkohole (R-CH 2 OH) können entweder zu Aldehyden (R-CHO) oder zu Carbonsäuren (R-CO 2 H) oxidiert werden . Die Oxidation sekundärer Alkohole (R 1 R 2 CH-OH) endet normalerweise auf der Ketonstufe (R 1 R 2 C=O). Tertiäre Alkohole (R 1 R 2 R 3 C-OH) sind oxidationsbeständig.
Die Direktoxidation von primären Alkoholen zu Carbonsäuren verläuft normalerweise über den entsprechenden Aldehyd, der über ein Aldehydhydrat (R-CH(OH) 2 ) durch Reaktion mit Wasser umgesetzt wird, bevor es weiter zur Carbonsäure oxidiert werden kann.

Für die Umwandlung von primären Alkoholen zu Aldehyden geeignete Reagenzien sind normalerweise auch für die Oxidation von sekundären Alkoholen zu Ketonen geeignet . Dazu gehören das Collins-Reagens und das Dess-Martin-Periodinan . Die direkte Oxidation von primären Alkoholen zu Carbonsäuren kann mit Kaliumpermanganat oder dem Jones-Reagenz durchgeführt werden .
Siehe auch
Anmerkungen
Verweise
- Metcalf, Allan A. (1999). Die Welt in so vielen Worten . Houghton Mifflin. ISBN 0-395-95920-9.