Arsenpentoxid - Arsenic pentoxide

|
|
| Namen | |
|---|---|
| Andere Namen
Arsen(V)
-oxid Arsenoxid Arsenanhydrid |
|
| Kennungen | |
|
3D-Modell ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard |
100.013.743 |
| EG-Nummer | |
|
PubChem CID
|
|
| RTECS-Nummer | |
| UNII | |
| UN-Nummer | 1559 |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Eigenschaften | |
| Als 2 O 5 | |
| Molmasse | 229.8402 g/mol |
| Aussehen | weißes hygroskopisches Pulver |
| Dichte | 4,32 g / cm 3 |
| Schmelzpunkt | 315 ° C (599 ° F; 588 K) (zersetzt sich) |
| 59,5 g / 100 ml (0 ° C) 65,8 g / 100 ml (20 ° C) 8,20 g / 100 ml (100 ° C) |
|
| Löslichkeit | löslich in Alkohol |
| Säure (p K a ) | 7 |
| Gefahren | |
| GHS-Piktogramme |
  
|
| GHS Signalwort | Achtung |
| H301 , H331 , H350 , H400 , H410 | |
| P201 , P202 , P261 , P264 , P270 , P271 , P273 , P281 , P301 + 310 , P304 + 340 , P308 + 313 , P311 , P321 , P330 , P391 , P403 + 233 , P405 , P501 | |
| NFPA 704 (Feuerdiamant) | |
| Tödliche Dosis oder Konzentration (LD, LC): | |
|
LD 50 ( mittlere Dosis )
|
8 mg / kg (Ratte, oral) |
| NIOSH (US-amerikanische Expositionsgrenzwerte): | |
|
PEL (zulässig)
|
[1910.1018] TWA 0,010 mg/m 3 |
|
REL (empfohlen)
|
Ca C 0,002 mg / m 3 [15 Minuten] |
|
IDLH (unmittelbare Gefahr)
|
Ca [5 mg / m 3 (als As)] |
| Verwandte Verbindungen | |
|
Andere Kationen
|
Phosphorpentoxid Antimonpentoxid |
|
Verwandte Verbindungen
|
Arsentrioxid Arsensäure |
|
Sofern nicht anders angegeben, werden Daten für Materialien in ihrem Standardzustand (bei 25 ° C, 100 kPa) angegeben. |
|
|
|
|
| Infobox-Referenzen | |
Arsenpentoxid ist die anorganische Verbindung mit der Formel As 2 O 5 . Dieser glasartige, weiße, zerfließende Feststoff ist relativ instabil, was mit der Seltenheit der As (V) -Oxidationsstufe übereinstimmt. Üblicher und kommerziell weitaus wichtiger ist Arsen (III) -oxid (As 2 O 3 ). Alle Arsenverbindungen sind hochgiftig und finden daher nur begrenzte kommerzielle Anwendungen.
Struktur
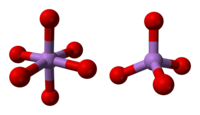
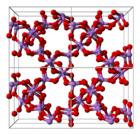
Die Struktur besteht aus tetraedrischen {AsO 4 } und oktaedrischen {AsO 6 } Zentren, die durch gemeinsame Ecken verbunden sind. Die Struktur unterscheidet sich von der des entsprechenden Phosphor (V) -oxids ; Obwohl dieses Oxid noch eine feste Lösung enthält, gelangt es nur zum äquimolaren Punkt, an dem an allen tetraedrischen Stellen Arsen durch Phosphor ersetzt wurde. Ebenso kann sich Arsenpentoxid bis zu einer äquimolaren Menge Antimonpentoxid auflösen , da Antimon Arsen nur an seinen oktaedrischen Stellen ersetzt.
 |
 |
|
| Als Koordination | Einheitszelle | Zellverpackung |
Synthese
Historisch
Paracelsus Macquer fand ein kristallisierbares Salz, das er „sel neutre arsenical“ nannte. Dieses Salz war der Rückstand, der nach dem Destillieren von Salpetersäure aus einer Mischung von Kaliumnitrat und Arsentrioxid erhalten wurde . Zuvor erhitzte Paracelsus eine Mischung aus Arsentrioxid und Kaliumnitrat. Er verwendete den Begriff "Arsenicum Fixum" auf das Produkt. A. Libavius nannte das gleiche Produkt „Butyrum arsenici“ (Arsenbutter), obwohl dieser Begriff eigentlich für Arsentrichlorid verwendet wurde. Die Produkte, die Paracelsus und Libavius fanden, waren alle unreine Alkaliarsenate. Scheele stellte eine Reihe von Arsenaten durch Einwirkung von Arsensäure auf die Alkalien her. Eines der von ihm hergestellten Arsenate war Arsenpentoxid. Das Wasser in den Alkalien verdampfte bei 180 ° C und das Arsenpentoxid war unter 400 ° C stabil.
Moderne Methoden
Arsenpentoxid kann durch Erhitzen von As 2 O 3 unter Sauerstoff kristallisiert werden . Diese Reaktion ist reversibel:
- Als 2 O 5 ⇌ Als 2 O 3 + O 2
Starke Oxidationsmittel wie Ozon , Wasserstoffperoxid und Salpetersäure wandeln Arsentrioxid in Pentoxid um.
Arsen kann durch routinemäßige Verarbeitung von Arsenverbindungen einschließlich der Oxidation von Arsen und arsenhaltigen Mineralien in der Luft erzeugt werden. Beispielhaft ist das Rösten von Orpiment , einem typischen Arsen-Sulfid-Erz:
- 2 As 2 S 3 + 11 O 2 → 2 As 2 O 5 + 6 SO 2
Sicherheit
Wie alle Arsenverbindungen ist das Pentoxid hochgiftig. Sein reduziertes Derivat Arsenit, das eine As (III) -Verbindung ist, ist noch toxischer, da es eine hohe Affinität für Thiolgruppen von Cysteinresten in Proteinen aufweist.
Es ist in den USA als äußerst gefährlicher Stoff gemäß Abschnitt 302 des US-amerikanischen Gesetzes über Notfallplanung und das Recht auf Kenntnisnahme der Gemeinschaft (42 USC 11002) eingestuft und unterliegt strengen Meldepflichten von Einrichtungen, die produzieren, lagern, oder in größeren Mengen verwenden.
Verweise
- ^ a b c NIOSH Pocket Guide für chemische Gefahren. "# 0038" . Nationales Institut für Sicherheit und Gesundheitsschutz am Arbeitsplatz (NIOSH).
- ^ Greenwood, Norman N . ; Earnshaw, Alan (1997). Chemie der Elemente (2. Aufl.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ^ a b Martin Jansen (1977). "Kristallstruktur von As 2 O 5 ". Angewandte Chemie Internationale Ausgabe in Englisch . 16 (5): 314–315. doi : 10.1002 / anie.197703142 .
- ^ Greenwood, Norman N . ; Earnshaw, Alan (1997). Chemie der Elemente (2. Aufl.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ^ a b J.W. Mellor. "Umfassende Abhandlung über anorganische und theoretische Chemie" . Archiviert vom Original am 11.05.2012 . Abgerufen am 30.03.2013 .
- ^ CW Zenger; et al. "Arsen 149" . Archiviert vom Original am 09.04.2013.
- ^ Grund, SC; Hanusch, K.; Wolf, HU "Arsen und Arsenverbindungen". Ullmanns Enzyklopädie der Industriechemie . Weinheim: Wiley-VCH. doi : 10.1002/14356007.a03_113.pub2 .
-
^ „40 CFR: Anhang A zu Teil 355 – Die Liste der extrem gefährlichen Stoffe und ihre Schwellenwertplanungsmengen“ (PDF) (Ausgabe 1. Juli 2008). Regierungsdruckerei . Archiviert vom Original (PDF) am 25. Februar 2012 . Abgerufen am 29. Oktober 2011 . Zitierjournal benötigt
|journal=( Hilfe )
Externe Links
- NIOSH Pocket Guide für chemische Gefahren
- IARC-Monographie - Arsen und Arsenverbindungen
- NTP-Bericht zu Karzinogenen – Anorganische Arsenverbindungen
- ESIS: Europäisches Informationssystem für chemische Substanzen
- Linstrom, Peter J.; Mallard, William G. (Hrsg.); NIST Chemistry WebBook, NIST-Standardreferenzdatenbank Nr. 69 , Nationales Institut für Standards und Technologie, Gaithersburg (MD), http://webbook.nist.gov

