Biosynthese -Biosynthesis
Die Biosynthese ist ein mehrstufiger, enzymkatalysierter Prozess , bei dem Substrate in lebenden Organismen in komplexere Produkte umgewandelt werden. In der Biosynthese werden einfache Verbindungen modifiziert, in andere Verbindungen umgewandelt oder zu Makromolekülen verbunden . Dieser Prozess besteht oft aus Stoffwechselwegen . Einige dieser Biosynthesewege befinden sich in einer einzelnen Zellorganelle , während andere Enzyme umfassen, die sich in mehreren Zellorganellen befinden. Beispiele für diese Biosynthesewege schließen die Produktion von Lipidmembrankomponenten und Nukleotiden ein. Biosynthese ist normalerweise gleichbedeutend mit Anabolismus .
Zu den Voraussetzungen für die Biosynthese gehören: Vorläuferverbindungen , chemische Energie (z. B. ATP ) und katalytische Enzyme, die Coenzyme erfordern können (z . B. NADH , NADPH ). Diese Elemente bilden Monomere , die Bausteine für Makromoleküle. Einige wichtige biologische Makromoleküle umfassen: Proteine , die aus Aminosäuremonomeren bestehen, die über Peptidbindungen verbunden sind , und DNA - Moleküle, die aus Nukleotiden bestehen, die über Phosphodiesterbindungen verbunden sind .
Eigenschaften chemischer Reaktionen
Die Biosynthese erfolgt aufgrund einer Reihe chemischer Reaktionen. Damit diese Reaktionen stattfinden können, sind die folgenden Elemente notwendig:
- Vorläuferverbindungen : Diese Verbindungen sind die Ausgangsmoleküle oder Substrate in einer Reaktion. Diese können auch als Reaktanten in einem bestimmten chemischen Prozess angesehen werden.
- Chemische Energie : Chemische Energie kann in Form von hochenergetischen Molekülen gefunden werden. Diese Moleküle werden für energetisch ungünstige Reaktionen benötigt. Außerdem treibt die Hydrolyse dieser Verbindungen eine Reaktion voran. Energiereiche Moleküle wie ATP haben drei Phosphate . Oft wird das endständige Phosphat bei der Hydrolyse abgespalten und auf ein anderes Molekül übertragen.
- Katalytische Enzyme : Diese Moleküle sind spezielle Proteine , die eine Reaktion katalysieren, indem sie die Reaktionsgeschwindigkeit erhöhen und die Aktivierungsenergie senken .
- Coenzyme oder Cofaktoren : Cofaktoren sind Moleküle, die bei chemischen Reaktionen helfen. Dies können Metallionen , Vitaminderivate wie NADH und Acetyl-CoA oder Nicht-Vitaminderivate wie ATP sein. Im Fall von NADH überträgt das Molekül einen Wasserstoff, während Acetyl-CoA eine Acetylgruppe überträgt und ATP ein Phosphat überträgt.
Im einfachsten Sinne haben die bei der Biosynthese ablaufenden Reaktionen folgendes Format:
Einige Variationen dieser Grundgleichung, auf die später noch genauer eingegangen wird, sind:
- Einfache Verbindungen, die in andere Verbindungen umgewandelt werden, normalerweise als Teil eines mehrstufigen Reaktionswegs. Zwei Beispiele für diese Art von Reaktion finden während der Bildung von Nukleinsäuren und der Beladung von tRNA vor der Translation statt . Für einige dieser Schritte wird chemische Energie benötigt:
- Einfache Verbindungen, die mit Hilfe von Cofaktoren in andere Verbindungen umgewandelt werden. Beispielsweise erfordert die Synthese von Phospholipiden Acetyl-CoA, während die Synthese einer anderen Membrankomponente, Sphingolipide , NADH und FADH für die Bildung des Sphingosin - Rückgrats erfordert. Die allgemeine Gleichung für diese Beispiele lautet:
- Einfache Verbindungen, die sich zu einem Makromolekül verbinden. Beispielsweise verbinden sich Fettsäuren zu Phospholipiden. Phospholipide und Cholesterin wiederum interagieren nichtkovalent , um die Lipiddoppelschicht zu bilden . Diese Reaktion kann wie folgt dargestellt werden:
Lipid
Viele komplizierte Makromoleküle werden in einem Muster einfacher, sich wiederholender Strukturen synthetisiert. Die einfachsten Strukturen von Lipiden sind zum Beispiel Fettsäuren . Fettsäuren sind Kohlenwasserstoffderivate ; sie enthalten eine Carboxylgruppe "Kopf" und eine Kohlenwasserstoffkette "Schwanz". Diese Fettsäuren bilden größere Komponenten, die wiederum nichtkovalente Wechselwirkungen eingehen, um die Lipiddoppelschicht zu bilden. Fettsäureketten kommen in zwei Hauptkomponenten von Membranlipiden vor: Phospholipiden und Sphingolipiden . Eine dritte Hauptmembrankomponente, Cholesterin , enthält diese Fettsäureeinheiten nicht.
Phospholipide
Die Grundlage aller Biomembranen besteht aus einer Doppelschichtstruktur von Phospholipiden. Das Phospholipidmolekül ist amphipathisch ; es enthält einen hydrophilen polaren Kopf und einen hydrophoben unpolaren Schwanz. Die Phospholipidköpfe interagieren miteinander und mit wässrigen Medien, während sich die Kohlenwasserstoffschwänze in der Mitte, weg vom Wasser, orientieren. Diese letzteren Wechselwirkungen treiben die Doppelschichtstruktur an, die als Barriere für Ionen und Moleküle wirkt.
Es gibt verschiedene Arten von Phospholipiden; folglich unterscheiden sich ihre Synthesewege. Der erste Schritt bei der Phospholipidsynthese beinhaltet jedoch die Bildung von Phosphatidat oder Diacylglycerin-3-phosphat am endoplasmatischen Retikulum und an der äußeren Mitochondrienmembran . Der Syntheseweg ist unten zu finden:
Der Stoffwechselweg beginnt mit Glycerol-3-phosphat, das durch die Addition einer Fettsäurekette, die von Acyl-Coenzym A bereitgestellt wird, in Lysophosphatidat umgewandelt wird . Dann wird Lysophosphatidat über die Addition einer weiteren Fettsäurekette, die von einem zweiten Acyl-CoA beigesteuert wird, in Phosphatidat umgewandelt; Alle diese Schritte werden durch das Enzym Glycerolphosphat- Acyltransferase katalysiert. Die Phospholipidsynthese wird im endoplasmatischen Retikulum fortgesetzt, und der Biosyntheseweg weicht in Abhängigkeit von den Komponenten des jeweiligen Phospholipids ab.
Sphingolipide
Wie Phospholipide haben diese Fettsäurederivate einen polaren Kopf und unpolare Schwänze. Im Gegensatz zu Phospholipiden haben Sphingolipide ein Sphingosin- Rückgrat. Sphingolipide kommen in eukaryotischen Zellen vor und sind besonders reichlich im Zentralnervensystem vorhanden . Sphingomyelin ist beispielsweise Teil der Myelinscheide von Nervenfasern.
Sphingolipide werden aus Ceramiden gebildet , die aus einer Fettsäurekette bestehen, die an die Aminogruppe eines Sphingosin-Rückgrats gebunden ist. Diese Ceramide werden aus der Acylierung von Sphingosin synthetisiert. Der Biosyntheseweg für Sphingosin ist unten zu finden:
Wie das Bild zeigt, durchlaufen Palmitoyl-CoA und Serin während der Sphingosinsynthese eine Kondensationsreaktion, die zur Bildung von Dehydrosphingosin führt. Dieses Produkt wird dann reduziert, um Dihydrospingosin zu bilden, das durch die Oxidationsreaktion von FAD in Sphingosin umgewandelt wird .
Cholesterin
Dieses Lipid gehört zu einer Klasse von Molekülen, die Sterole genannt werden . Sterole haben vier kondensierte Ringe und eine Hydroxylgruppe . Cholesterin ist ein besonders wichtiges Molekül. Es dient nicht nur als Bestandteil von Lipidmembranen, sondern ist auch ein Vorläufer mehrerer Steroidhormone , darunter Cortisol , Testosteron und Östrogen .
Cholesterin wird aus Acetyl-CoA synthetisiert . Der Weg ist unten dargestellt:
Allgemeiner erfolgt diese Synthese in drei Stufen, wobei die erste Stufe im Zytoplasma stattfindet und die zweite und dritte Stufe im endoplasmatischen Retikulum stattfinden. Die Stufen sind wie folgt:
- 1. Die Synthese von Isopentenylpyrophosphat , dem „Baustein“ von Cholesterin
- 2. Die Bildung von Squalen durch Kondensation von sechs Molekülen Isopentenylphosphat
- 3. Die Umwandlung von Squalen in Cholesterin über mehrere enzymatische Reaktionen
Nukleotide
Die Biosynthese von Nukleotiden umfasst enzymkatalysierte Reaktionen, die Substrate in komplexere Produkte umwandeln. Nukleotide sind die Bausteine von DNA und RNA . Nukleotide bestehen aus einem fünfgliedrigen Ring, der aus Ribosezucker in RNA und Desoxyribosezucker in DNA gebildet wird; diese Zucker sind an eine Purin- oder Pyrimidinbase mit einer glykosidischen Bindung und einer Phosphatgruppe an der 5'-Position des Zuckers gebunden.
Purin-Nukleotide
Die DNA-Nukleotide Adenosin und Guanosin bestehen aus einer Purinbase, die glykosidisch an einen Ribosezucker gebunden ist. Bei den RNA-Nukleotiden Desoxyadenosin und Desoxyguanosin sind die Purinbasen glykosidisch an einen Desoxyribose-Zucker gebunden. Die Purinbasen auf DNA- und RNA-Nukleotiden werden in einem zwölfstufigen Reaktionsmechanismus synthetisiert, der in den meisten einzelligen Organismen vorhanden ist. Höhere Eukaryoten verwenden einen ähnlichen Reaktionsmechanismus in zehn Reaktionsschritten. Purinbasen werden synthetisiert, indem Phosphoribosylpyrophosphat (PRPP) in Inosinmonophosphat (IMP) umgewandelt wird, das das erste Schlüsselzwischenprodukt in der Biosynthese von Purinbasen ist. Eine weitere enzymatische Modifikation von IMP erzeugt die Adenosin- und Guanosinbasen von Nukleotiden.
- Der erste Schritt der Purin-Biosynthese ist eine Kondensationsreaktion , die von der Glutamin-PRPP-Amidotransferase durchgeführt wird . Dieses Enzym überträgt die Aminogruppe von Glutamin auf PRPP, wodurch 5-Phosphoribosylamin gebildet wird . Der folgende Schritt erfordert die Aktivierung von Glycin durch Hinzufügen einer Phosphatgruppe von ATP .
- GAR-Synthetase führt die Kondensation von aktiviertem Glycin auf PRPP durch, wodurch Glycinamid-Ribonukleotid (GAR) gebildet wird.
- GAR-Transformylase fügt eine Formylgruppe an die Aminogruppe von GAR an, wodurch Formylglycinamid-Ribonukleotid (FGAR) gebildet wird.
- FGAR-Amidotransferase katalysiert die Addition einer Stickstoffgruppe an FGAR unter Bildung von Formylglycinamidin-Ribonukleotid (FGAM).
- Die FGAM-Cyclase katalysiert den Ringschluss , bei dem ein Wassermolekül entfernt wird, wodurch der 5-gliedrige Imidazolring 5-Aminoimidazol-Ribonukleotid (AIR) gebildet wird.
- Die N5-CAIR-Synthetase überträgt eine Carboxylgruppe und bildet das intermediäre N5-Carboxyaminoimidazol-Ribonukleotid (N5-CAIR).
- N5-CAIR-Mutase ordnet die funktionelle Carboxylgruppe neu an und überträgt sie auf den Imidazolring, wodurch Carboxyaminoimidazol-Ribonukleotide (CAIR) gebildet werden. Der zweistufige Mechanismus der CAIR-Bildung aus AIR findet sich hauptsächlich in einzelligen Organismen. Höhere Eukaryoten enthalten das Enzym AIR-Carboxylase, das eine Carboxylgruppe direkt auf den AIR-Imidazolring überträgt und CAIR bildet.
- SAICAR-Synthetase bildet eine Peptidbindung zwischen Aspartat und der hinzugefügten Carboxylgruppe des Imidazolrings, wodurch N-Succinyl-5-aminoimidazol-4-carboxamid-Ribonukleotid (SAICAR) gebildet wird.
- SAICAR-Lyase entfernt das Kohlenstoffskelett des hinzugefügten Aspartats, hinterlässt die Aminogruppe und bildet 5-Aminoimidazol-4-carboxamid-Ribonukleotid (AICAR).
- AICAR-Transformylase überträgt eine Carbonylgruppe auf AICAR und bildet N-Formylaminoimidazol-4-carboxamid-Ribonukleotid (FAICAR).
- Der letzte Schritt beinhaltet das Enzym IMP-Synthase , das den Purinringschluss durchführt und das Inosinmonophosphat-Zwischenprodukt bildet.
Pyrimidin-Nukleotide
Andere DNA- und RNA-Nukleotidbasen, die über eine glykosidische Bindung mit dem Ribosezucker verbunden sind, sind Thymin , Cytosin und Uracil (das nur in RNA vorkommt). Die Biosynthese von Uridinmonophosphat umfasst ein Enzym, das sich in der inneren Membran der Mitochondrien befindet, und multifunktionale Enzyme, die sich im Zytosol befinden .
- Der erste Schritt beinhaltet das Enzym Carbamoylphosphat-Synthase , das Glutamin mit CO 2 in einer ATP-abhängigen Reaktion kombiniert , um Carbamoylphosphat zu bilden .
- Aspartat-Carbamoyltransferase kondensiert Carbamoylphosphat mit Aspartat, um Uridosuccinat zu bilden.
- Dihydroorotase führt einen Ringschluss durch, eine Reaktion, bei der Wasser verloren geht, um Dihydroorotat zu bilden .
- Dihydroorotat-Dehydrogenase , die sich in der inneren Membran der Mitochondrien befindet, oxidiert Dihydroorotat zu Orotat .
- Orotat-Phosphoribosyl-Hydrolase (OMP-Pyrophosphorylase) kondensiert Orotat mit PRPP , um Orotidin-5'-Phosphat zu bilden .
- OMP-Decarboxylase katalysiert die Umwandlung von Orotidin-5'-phosphat zu UMP .
Nachdem die Uridin-Nukleotidbase synthetisiert ist, werden die anderen Basen Cytosin und Thymin synthetisiert. Die Cytosin-Biosynthese ist eine zweistufige Reaktion, die die Umwandlung von UMP in UTP beinhaltet . Die Phosphataddition an UMP wird durch ein Kinaseenzym katalysiert. Das Enzym CTP-Synthase katalysiert den nächsten Reaktionsschritt: die Umwandlung von UTP zu CTP durch Übertragung einer Aminogruppe von Glutamin auf Uridin; dies bildet die Cytosinbase von CTP. Der Mechanismus, der die Reaktion UTP + ATP + Glutamin ⇔ CTP + ADP + Glutamat darstellt, ist unten:
Cytosin ist ein Nukleotid, das sowohl in DNA als auch in RNA vorhanden ist. Uracil kommt jedoch nur in RNA vor. Nachdem UTP synthetisiert wurde, muss es daher in eine Desoxyform umgewandelt werden, um in DNA eingebaut zu werden. An dieser Umwandlung ist das Enzym Ribonukleosid-Triphosphat-Reduktase beteiligt . Diese Reaktion, die das 2'-OH des Ribosezuckers entfernt, um Desoxyribose zu erzeugen, wird nicht durch die an den Zucker gebundenen Basen beeinflusst. Diese Unspezifität ermöglicht der Ribonukleosidtriphosphatreduktase, alle Nukleotidtriphosphate durch einen ähnlichen Mechanismus in Desoxyribonukleotide umzuwandeln.
Im Gegensatz zu Uracil kommen Thyminbasen hauptsächlich in DNA und nicht in RNA vor. Zellen enthalten normalerweise keine Thyminbasen, die mit Ribosezuckern in RNA verknüpft sind, was darauf hindeutet, dass Zellen nur Desoxyribose-verknüpftes Thymin synthetisieren. Das Enzym Thymidylatsynthetase ist für die Synthese von Thyminresten von dUMP zu dTMP verantwortlich . Diese Reaktion überträgt eine Methylgruppe auf die Uracilbase von dUMP, um dTMP zu erzeugen. Die Thymidylat-Synthase-Reaktion, dUMP + 5,10-Methylentetrahydrofolat ⇔ dTMP + Dihydrofolat, ist rechts gezeigt.
DNS
Obwohl es Unterschiede zwischen der eukaryotischen und der prokaryotischen DNA-Synthese gibt, beschreibt der folgende Abschnitt die Schlüsselmerkmale der DNA-Replikation, die von beiden Organismen geteilt werden.
DNA besteht aus Nukleotiden , die durch Phosphodiesterbindungen verbunden sind . Die DNA-Synthese , die im Zellkern stattfindet , ist ein semikonservativer Prozess, was bedeutet, dass das resultierende DNA-Molekül einen ursprünglichen Strang aus der Ausgangsstruktur und einen neuen Strang enthält. Die DNA-Synthese wird durch eine Familie von DNA-Polymerasen katalysiert , die vier Desoxynukleosidtriphosphate, einen Matrizenstrang und einen Primer mit einem freien 3'OH benötigen, in das Nukleotide eingebaut werden können.
Damit die DNA-Replikation stattfinden kann, wird eine Replikationsgabel durch Enzyme namens Helikasen erzeugt , die die DNA-Helix abwickeln. Topoisomerasen an der Replikationsgabel entfernen Supercoils , die durch das Abwickeln der DNA verursacht werden, und einzelsträngige DNA-bindende Proteine halten die beiden einzelsträngigen DNA-Matrizen vor der Replikation stabilisiert.
Die DNA-Synthese wird von der RNA-Polymerase - Primase initiiert , die einen RNA-Primer mit einem freien 3'OH herstellt. Dieser Primer wird an die einzelsträngige DNA-Matrize angehängt, und die DNA-Polymerase verlängert die Kette durch Einbau von Nukleotiden; Die DNA-Polymerase liest auch den neu synthetisierten DNA-Strang Korrektur.
Während der durch DNA-Polymerase katalysierten Polymerisationsreaktion erfolgt ein nukleophiler Angriff durch das 3'OH der wachsenden Kette auf das innerste Phosphoratom eines Desoxynukleosidtriphosphats; dies führt zur Bildung einer Phosphodiesterbrücke , die ein neues Nukleotid bindet und Pyrophosphat freisetzt .
Während der Replikation entstehen gleichzeitig zwei Arten von Strängen: der führende Strang , der kontinuierlich synthetisiert wird und in Richtung der Replikationsgabel wächst, und der nacheilende Strang , der diskontinuierlich in Okazaki-Fragmenten hergestellt wird und von der Replikationsgabel wegwächst. Okazaki-Fragmente werden durch DNA-Ligase kovalent verbunden , um einen kontinuierlichen Strang zu bilden. Anschließend werden zur Vervollständigung der DNA-Replikation die RNA-Primer entfernt und die entstandenen Lücken durch DNA ersetzt und über DNA-Ligase verbunden.
Aminosäuren
Ein Protein ist ein Polymer, das aus Aminosäuren besteht , die durch Peptidbindungen verbunden sind . In der Natur kommen mehr als 300 Aminosäuren vor, von denen nur zwanzig, die sogenannten Standardaminosäuren , die Bausteine für Proteine sind. Nur grüne Pflanzen und die meisten Mikroben sind in der Lage, alle 20 Standardaminosäuren zu synthetisieren , die von allen lebenden Arten benötigt werden. Säugetiere können nur zehn der zwanzig Standard-Aminosäuren synthetisieren. Die anderen Aminosäuren Valin , Methionin , Leucin , Isoleucin , Phenylalanin , Lysin , Threonin und Tryptophan für Erwachsene und Histidin und Arginin für Babys werden über die Nahrung aufgenommen.
Grundstruktur der Aminosäure
Die allgemeine Struktur der Standardaminosäuren umfasst eine primäre Aminogruppe , eine Carboxylgruppe und die an den α-Kohlenstoff gebundene funktionelle Gruppe . Die verschiedenen Aminosäuren werden durch die funktionelle Gruppe identifiziert. Aufgrund der drei verschiedenen Gruppen am α-Kohlenstoff sind Aminosäuren asymmetrische Moleküle . Für alle Standard-Aminosäuren, außer Glycin , ist das α-Kohlenstoff ein Chiralitätszentrum . Im Fall von Glycin hat das α-Kohlenstoffatom zwei Wasserstoffatome, wodurch diesem Molekül Symmetrie verliehen wird. Mit Ausnahme von Prolin haben alle im Leben vorkommenden Aminosäuren die L-Isoform- Konformation. Prolin hat eine funktionelle Gruppe am α-Kohlenstoff, die mit der Aminogruppe einen Ring bildet.
Stickstoffquelle
Ein Hauptschritt in der Aminosäurebiosynthese beinhaltet den Einbau einer Stickstoffgruppe in den α-Kohlenstoff. In Zellen gibt es zwei Hauptwege für den Einbau von Stickstoffgruppen. Ein Weg beinhaltet das Enzym Glutamin-Oxoglutarat-Aminotransferase (GOGAT), das die Amidaminogruppe von Glutamin entfernt und auf 2-Oxoglutarat überträgt , wodurch zwei Glutamatmoleküle produziert werden. Bei dieser Katalysereaktion dient Glutamin als Stickstoffquelle. Ein Bild, das diese Reaktion veranschaulicht, befindet sich rechts.
Der andere Weg zum Einbau von Stickstoff in das α-Kohlenstoffatom von Aminosäuren beinhaltet das Enzym Glutamatdehydrogenase (GDH). GDH ist in der Lage, Ammoniak auf 2-Oxoglutarat zu übertragen und Glutamat zu bilden. Darüber hinaus ist das Enzym Glutaminsynthetase (GS) in der Lage, Ammoniak auf Glutamat zu übertragen und Glutamin zu synthetisieren, wodurch Glutamin wieder aufgefüllt wird.
Die Glutamatfamilie der Aminosäuren
Die Glutamat -Aminosäurenfamilie umfasst die Aminosäuren, die sich von der Aminosäure Glutamat ableiten. Diese Familie umfasst: Glutamat, Glutamin , Prolin und Arginin . Zu dieser Familie gehört auch die Aminosäure Lysin , die sich von α-Ketoglutarat ableitet .
Die Biosynthese von Glutamat und Glutamin ist ein Schlüsselschritt bei der oben diskutierten Stickstoffassimilation. Die Enzyme GOGAT und GDH katalysieren die Stickstoffassimilationsreaktionen .
In Bakterien initiiert das Enzym Glutamat-5-Kinase die Biosynthese von Prolin, indem es eine Phosphatgruppe von ATP auf Glutamat überträgt. Die nächste Reaktion wird durch das Enzym Pyrrolin-5-Carboxylat-Synthase (P5CS) katalysiert, das die Reduktion der ϒ-Carboxylgruppe von L-Glutamat-5-phosphat katalysiert. Dabei entsteht Glutamat-Semialdehyd, der spontan zu Pyrrolin-5-carboxylat cyclisiert. Pyrrolin-5-Carboxylat wird durch das Enzym Pyrrolin-5-Carboxylat-Reduktase (P5CR) weiter reduziert, um eine Prolin-Aminosäure zu ergeben.
Im ersten Schritt der Arginin-Biosynthese in Bakterien wird Glutamat acetyliert , indem die Acetylgruppe von Acetyl-CoA auf die N-α-Position übertragen wird; dies verhindert eine spontane Cyclisierung. Das Enzym N-Acetylglutamat-Synthase (Glutamat-N-Acetyltransferase) ist für die Katalyse des Acetylierungsschrittes verantwortlich. Nachfolgende Schritte werden durch die Enzyme N-Acetylglutamat-Kinase , N-Acetyl-Gamma-Glutamyl-Phosphat-Reduktase und Acetylornithin/Succinyldiamino-Pimelat-Aminotransferase katalysiert und ergeben das N-Acetyl-L-Ornithin. Die Acetylgruppe von Acetylornithin wird durch das Enzym Acetylornithinase (AO) oder Ornithinacetyltransferase (OAT) entfernt, und dies ergibt Ornithin . Dann wandeln die Enzyme Citrullin und Argininosuccinat Ornithin in Arginin um.
Es gibt zwei unterschiedliche Lysin-Biosynthesewege: den Diaminopimelinsäure-Weg und den α-Aminoadipat-Weg . Der häufigste der beiden Synthesewege ist der Diaminopimelinsäure-Weg; Es besteht aus mehreren enzymatischen Reaktionen, die Aspartat Kohlenstoffgruppen hinzufügen, um Lysin zu ergeben:
- Aspartatkinase initiiert den Diaminopimelinsäureweg durch Phosphorylierung von Aspartat und Produktion von Aspartylphosphat.
- Aspartat-Semialdehyd-Dehydrogenase katalysiert die NADPH -abhängige Reduktion von Aspartylphosphat, um Aspartat-Semialdehyd zu ergeben.
- 4-Hydroxy-tetrahydrodipicolinat-Synthase fügt dem β-Aspartyl-4-semialdehyd eine Pyruvatgruppe hinzu , und ein Wassermolekül wird entfernt. Dies verursacht eine Cyclisierung und führt zu (2S,4S)-4-Hydroxy-2,3,4,5-tetrahydrodipicolinat.
- 4-Hydroxy-tetrahydrodipicolinat-Reduktase katalysiert die Reduktion von (2S,4S)-4-Hydroxy-2,3,4,5-tetrahydrodipicolinat durch NADPH zu Δ'-Piperidin-2,6-dicarboxylat (2,3,4, 5-Tetrahydrodipicolinat) und H 2 O.
- Tetrahydrodipicolinat-Acyltransferase katalysiert die Acetylierungsreaktion, die zur Ringöffnung führt und N-Acetyl-α-amino-ε-ketopimelat ergibt.
- N-Succinyl-α-amino-ε-ketopimelat-glutamataminotransaminase katalysiert die Transaminierungsreaktion, die die Ketogruppe von N-Acetyl-α-amino-ε-ketopimelat entfernt und durch eine Aminogruppe ersetzt, um N-Succinyl-L-diaminopimelat zu ergeben .
- N-Acyldiaminopimelat-Deacylase katalysiert die Deacylierung von N-Succinyl-L-diaminopimelat, um L,L-Diaminopimelat zu ergeben.
- DAP-Epimerase katalysiert die Umwandlung von L,L-Diaminopimelat in die meso - Form von L,L-Diaminopimelat.
- DAP-Decarboxylase katalysiert die Entfernung der Carboxylgruppe, wodurch L-Lysin erhalten wird.
Die Familie der Serine von Aminosäuren
Die Serin -Aminosäurefamilie umfasst: Serin, Cystein und Glycin . Die meisten Mikroorganismen und Pflanzen gewinnen den Schwefel für die Synthese von Methionin aus der Aminosäure Cystein. Darüber hinaus liefert die Umwandlung von Serin in Glycin die Kohlenstoffe, die für die Biosynthese von Methionin und Histidin benötigt werden .
Während der Serin-Biosynthese katalysiert das Enzym Phosphoglycerat-Dehydrogenase die anfängliche Reaktion, die 3-Phospho-D-Glycerat oxidiert , um 3-Phosphonooxypyruvat zu ergeben . Die folgende Reaktion wird durch das Enzym Phosphoserin-Aminotransferase katalysiert , das eine Aminogruppe von Glutamat auf 3-Phosphonooxypyruvat überträgt, um L-Phosphoserin zu ergeben . Der letzte Schritt wird durch das Enzym Phosphoserinphosphatase katalysiert , das L-Phosphoserin zu L-Serin dephosphoryliert .
Es gibt zwei bekannte Wege für die Biosynthese von Glycin. Organismen, die Ethanol und Acetat als Hauptkohlenstoffquelle verwenden, nutzen den glykoneogenen Weg, um Glycin zu synthetisieren . Der andere Weg der Glycinbiosynthese ist als glykolytischer Weg bekannt. Dieser Weg wandelt aus den Zwischenprodukten der Glykolyse synthetisiertes Serin in Glycin um. Im glykolytischen Weg katalysiert das Enzym Serin-Hydroxymethyltransferase die Spaltung von Serin zu Glycin und überträgt die abgespaltene Kohlenstoffgruppe von Serin auf Tetrahydrofolat , wodurch 5,10-Methylentetrahydrofolat entsteht .
Die Cystein-Biosynthese ist eine zweistufige Reaktion, die den Einbau von anorganischem Schwefel beinhaltet . In Mikroorganismen und Pflanzen katalysiert das Enzym Serin-Acetyltransferase die Übertragung der Acetylgruppe von Acetyl-CoA auf L-Serin, um O-Acetyl-L-Serin zu ergeben . Der folgende Reaktionsschritt, katalysiert durch das Enzym O-Acetyl-Serin (Thiol)-Lyase , ersetzt die Acetylgruppe von O-Acetyl-L-Serin durch Sulfid, um Cystein zu ergeben.
Die Aspartatfamilie der Aminosäuren
Die Familie der Aspartat- Aminosäuren umfasst: Threonin , Lysin , Methionin , Isoleucin und Aspartat. Lysin und Isoleucin werden als Teil der Aspartatfamilie betrachtet, obwohl ein Teil ihres Kohlenstoffskeletts von Pyruvat abgeleitet ist . Im Fall von Methionin leitet sich der Methylkohlenstoff von Serin und der Schwefelgruppe ab, aber in den meisten Organismen stammt er von Cystein.
Die Biosynthese von Aspartat ist eine einstufige Reaktion, die durch ein einziges Enzym katalysiert wird. Das Enzym Aspartat-Aminotransferase katalysiert die Übertragung einer Aminogruppe von Aspartat auf α-Ketoglutarat , um Glutamat und Oxalacetat zu ergeben . Asparagin wird durch eine ATP-abhängige Addition einer Aminogruppe an Aspartat synthetisiert; Asparagin-Synthetase katalysiert die Addition von Stickstoff aus Glutamin oder löslichem Ammoniak an Aspartat, um Asparagin zu ergeben.
Der Diaminopimelinsäure-Biosyntheseweg von Lysin gehört zur Aspartat-Familie der Aminosäuren. Dieser Weg umfasst neun enzymkatalysierte Reaktionen, die Aspartat in Lysin umwandeln.
- Aspartatkinase katalysiert den Anfangsschritt im Diaminopimelinsäure-Weg, indem sie ein Phosphoryl von ATP auf die Carboxylatgruppe von Aspartat überträgt, was Aspartyl-β-phosphat ergibt.
- Aspartat-Semialdehyd-Dehydrogenase katalysiert die Reduktionsreaktion durch Dephosphorylierung von Aspartyl-β-phosphat, um Aspartat-β-Semialdehyd zu ergeben.
- Dihydrodipicolinat-Synthase katalysiert die Kondensationsreaktion von Aspartat-β-semialdehyd mit Pyruvat, um Dihydrodipicolinsäure zu ergeben.
- 4-Hydroxy-tetrahydrodipicolinat-Reduktase katalysiert die Reduktion von Dihydrodipicolinsäure zu Tetrahydrodipicolinsäure.
- Tetrahydrodipicolinat-N-succinyltransferase katalysiert die Übertragung einer Succinylgruppe von Succinyl-CoA auf Tetrahydrodipicolinsäure, um N-Succinyl-L-2,6-diaminoheptandioat zu ergeben.
- N-Succinyldiaminopimelat-Aminotransferase katalysiert die Übertragung einer Aminogruppe von Glutamat auf N-Succinyl-L-2,6-diaminoheptandioat, um N-Succinyl-L,L-diaminopimelinsäure zu ergeben.
- Succinyl-Diaminopimelat-Desuccinylase katalysiert die Entfernung der Acylgruppe von N-Succinyl-L,L-Diaminopimelinsäure, um L,L-Diaminopimelinsäure zu ergeben.
- Diaminopimelat-Epimerase katalysiert die Inversion des α-Kohlenstoffs von L,L-Diaminopimelinsäure, um meso-Diaminopimelinsäure zu ergeben .
- Siaminopimelat-Decarboxylase katalysiert den letzten Schritt in der Lysin-Biosynthese, der die Kohlendioxidgruppe von meso-Diaminopimelinsäure entfernt, um L-Lysin zu ergeben.
Proteine
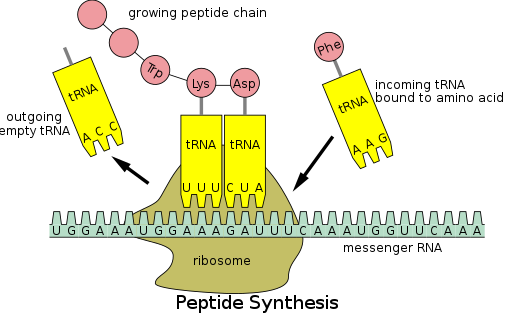
Die Proteinsynthese erfolgt über einen Prozess, der Translation genannt wird . Während der Translation wird genetisches Material namens mRNA von Ribosomen gelesen , um eine Protein- Polypeptidkette zu erzeugen . Dieser Prozess erfordert Transfer-RNA (tRNA), die als Adapter dient, indem sie an einem Ende Aminosäuren bindet und am anderen Ende mit mRNA interagiert; die letztere Paarung zwischen tRNA und mRNA stellt sicher, dass die richtige Aminosäure an die Kette angefügt wird. Die Proteinsynthese erfolgt in drei Phasen: Initiation, Elongation und Termination. Die prokaryotische ( archaeale und bakterielle ) Übersetzung unterscheidet sich von der eukaryotischen Übersetzung ; Dieser Abschnitt konzentriert sich jedoch hauptsächlich auf die Gemeinsamkeiten zwischen den beiden Organismen.
Zusätzlicher Hintergrund
Bevor die Translation beginnen kann, muss der Prozess der Bindung einer bestimmten Aminosäure an die entsprechende tRNA stattfinden. Diese als tRNA-Aufladung bezeichnete Reaktion wird durch die Aminoacyl-tRNA-Synthetase katalysiert . Eine spezifische tRNA-Synthetase ist für die Erkennung und Aufladung einer bestimmten Aminosäure verantwortlich. Darüber hinaus verfügt dieses Enzym über spezielle Diskriminatorregionen, um die korrekte Bindung zwischen tRNA und ihrer verwandten Aminosäure sicherzustellen. Der erste Schritt zum Verbinden einer Aminosäure mit ihrer entsprechenden tRNA ist die Bildung von Aminoacyl-AMP:
Anschließend erfolgt die Übertragung der Aminoacylgruppe von Aminoacyl-AMP auf ein tRNA-Molekül. Das resultierende Molekül ist Aminoacyl-tRNA :
Die Kombination dieser beiden Schritte, die beide durch Aminoacyl-tRNA-Synthetase katalysiert werden, erzeugt eine geladene tRNA, die bereit ist, Aminosäuren an die wachsende Polypeptidkette anzufügen.
Zusätzlich zur Bindung einer Aminosäure hat tRNA eine Drei-Nukleotid-Einheit, die als Anticodon bezeichnet wird und Basenpaare mit spezifischen Nukleotid-Tripletts auf der mRNA bildet, die Codons genannt werden ; Codons codieren eine bestimmte Aminosäure. Diese Interaktion ist dank des Ribosoms möglich, das als Ort der Proteinsynthese dient. Das Ribosom besitzt drei tRNA-Bindungsstellen: die Aminoacylstelle (A-Stelle), die Peptidylstelle (P-Stelle) und die Austrittsstelle (E-Stelle).
Es gibt zahlreiche Codons innerhalb eines mRNA-Transkripts, und es ist sehr üblich, dass eine Aminosäure durch mehr als ein Codon spezifiziert wird; dieses Phänomen wird als Entartung bezeichnet . Insgesamt gibt es 64 Codons, von denen jeweils 61 für eine der 20 Aminosäuren kodieren, während die restlichen Codons den Kettenabbruch spezifizieren.
Übersetzung in Schritten
Wie bereits erwähnt, erfolgt die Translation in drei Phasen: Initiation, Elongation und Termination.
Schritt 1: Einleitung
Der Abschluss der Initiierungsphase ist von den folgenden drei Ereignissen abhängig:
1. Die Rekrutierung des Ribosoms zu mRNA
2. Die Bindung einer geladenen Initiator-tRNA an die P-Stelle des Ribosoms
3. Die richtige Ausrichtung des Ribosoms mit dem Startcodon der mRNA
Schritt 2: Verlängerung
Nach der Initiierung wird die Polypeptidkette über Anticodon:Codon-Wechselwirkungen verlängert, wobei das Ribosom der Polypeptidkette jeweils eine Aminosäure hinzufügt. Folgende Schritte müssen ablaufen, um die korrekte Zugabe von Aminosäuren zu gewährleisten:
1. Die Bindung der richtigen tRNA in die A-Stelle des Ribosoms
2. Die Bildung einer Peptidbindung zwischen der tRNA in der A-Stelle und der Polypeptidkette, die an der tRNA in der P-Stelle befestigt ist
3. Translokation oder Fortschreiten des tRNA-mRNA-Komplexes um drei Nukleotide
Die Translokation "startet" die tRNA an der E-Stelle und verschiebt die tRNA von der A-Stelle in die P-Stelle, wodurch die A-Stelle frei bleibt, damit eine ankommende tRNA eine weitere Aminosäure hinzufügen kann.
Schritt 3: Kündigung
Die letzte Stufe der Translation findet statt, wenn ein Stoppcodon in die A-Stelle eintritt. Dann erfolgen die folgenden Schritte:
1. Die Erkennung von Codons durch Freisetzungsfaktoren , die die Hydrolyse der Polypeptidkette von der in der P-Stelle befindlichen tRNA bewirkt
2. Die Freisetzung der Polypeptidkette
3. Die Dissoziation und "Wiederverwertung" des Ribosoms für zukünftige Translationsprozesse
Nachfolgend finden Sie eine zusammenfassende Tabelle der Schlüsselakteure in der Übersetzung:
| Schlüsselakteure in der Übersetzung | Übersetzungsphase | Zweck |
|---|---|---|
| tRNA-Synthetase | vor der Einweihung | Verantwortlich für das Aufladen der tRNA |
| mRNA | Initiierung, Verlängerung, Beendigung | Vorlage für die Proteinsynthese; enthält als Codons bezeichnete Regionen, die Aminosäuren codieren |
| tRNA | Initiierung, Verlängerung, Beendigung | Bindet die Ribosomenstellen A, P, E; Anticodon-Basenpaare mit mRNA-Codon, um sicherzustellen, dass die richtige Aminosäure in die wachsende Polypeptidkette eingebaut wird |
| Ribosom | Initiierung, Verlängerung, Beendigung | Lenkt die Proteinsynthese und katalysiert die Bildung der Peptidbindung |
Krankheiten im Zusammenhang mit Makromolekülmangel
Fehler in Biosynthesewegen können schädliche Folgen haben, einschließlich der Fehlbildung von Makromolekülen oder der Unterproduktion von funktionellen Molekülen. Nachfolgend finden Sie Beispiele, die die Störungen veranschaulichen, die aufgrund dieser Ineffizienzen auftreten.
- Familiäre Hypercholesterinämie : Diese Störung ist durch das Fehlen funktioneller Rezeptoren für LDL gekennzeichnet . Mängel bei der Bildung von LDL-Rezeptoren können fehlerhafte Rezeptoren verursachen, die den endozytischen Weg stören und den Eintritt von LDL in die Leber und andere Zellen hemmen. Dies führt zu einer Anhäufung von LDL im Blutplasma, was zu atherosklerotischen Plaques führt , die Arterien verengen und das Risiko von Herzinfarkten erhöhen.
- Lesch-Nyhan-Syndrom : Diese genetische Erkrankung ist durch Selbstverstümmelung , geistige Schwäche und Gicht gekennzeichnet . Es wird durch das Fehlen von Hypoxanthin-Guanin-Phosphoribosyltransferase verursacht , die ein notwendiges Enzym für die Bildung von Purinnukleotiden ist. Der Mangel an Enzym reduziert die Menge an notwendigen Nukleotiden und verursacht die Akkumulation von Biosynthese- Zwischenprodukten , was zu dem oben erwähnten ungewöhnlichen Verhalten führt.
- Schwere kombinierte Immunschwäche (SCID) : SCID ist durch einen Verlust von T-Zellen gekennzeichnet . Ein Mangel an diesen Komponenten des Immunsystems erhöht die Anfälligkeit für Infektionserreger, da die betroffenen Personen kein immunologisches Gedächtnis entwickeln können . Diese immunologische Störung resultiert aus einem Mangel an Adenosin-Deanimase- Aktivität, der eine Anhäufung von dATP verursacht . Diese dATP-Moleküle hemmen dann die Ribonukleotid-Reduktase, die die DNA-Synthese verhindert.
- Huntington-Krankheit : Diese neurologische Erkrankung wird durch Fehler verursacht, die während der DNA-Synthese auftreten. Diese Fehler oder Mutationen führen zur Expression eines mutierten Huntingtin -Proteins, das sich wiederholende Glutaminreste enthält, die durch expandierende CAG-Trinukleotid-Wiederholungen im Gen kodiert werden. Die Huntington-Krankheit ist durch neuronalen Verlust und Gliose gekennzeichnet . Zu den Symptomen der Krankheit gehören: Bewegungsstörung, kognitiver Verfall und Verhaltensstörung.
Siehe auch
- Lipide
- Phospholipid Doppelschicht
- Nukleotide
- DNS
- DNA Replikation
- Proteinogene Aminosäure
- Codon-Tabelle
- Prostaglandin
- Porphyrine
- Chlorophylle und Bakteriochlorophylle
- Vitamin B12

![{\displaystyle {\ce {Reaktant ->[][Enzym] Produkt}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d97fbef58f64fb0b7d05d90fa0a73b05f5919fc8)

![{\displaystyle {\ce {{Vorläufer~Molekül}+Cofaktor->[][Enzym]Makromolekül}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b192f25eec9ceebed179bfeb43ae27795f3a91be)