Zirkulierende Tumorzelle - Circulating tumor cell
Eine zirkulierende Tumorzelle ( CTC ) ist eine Zelle, die von einem Primärtumor in das Gefäß- oder Lymphsystem ausgeschieden ist und im Blutkreislauf durch den Körper getragen wird . CTCs können extravasieren und zu Keimen für das anschließende Wachstum weiterer Tumoren ( Metastasen ) in entfernten Organen werden, ein Mechanismus, der für die überwiegende Mehrheit der krebsbedingten Todesfälle verantwortlich ist. Die Erkennung und Analyse von CTCs kann eine frühe Patientenprognose unterstützen und geeignete maßgeschneiderte Behandlungen bestimmen. Derzeit gibt es eine FDA-zugelassene Verfahren zur CTC - Erkennung, Cellsearch, die verwendet wird , zu diagnostizieren , Brust , colorectal und Prostata - Krebs.
Der Nachweis von CTCs oder Flüssigbiopsie bietet mehrere Vorteile gegenüber herkömmlichen Gewebebiopsien. Sie sind nicht-invasiv, können wiederholt verwendet werden und liefern nützlichere Informationen über das Metastasierungsrisiko, den Krankheitsverlauf und die Wirksamkeit der Behandlung. Beispielsweise hat die Analyse von Blutproben von Krebspatienten eine Neigung zu einer erhöhten CTC-Erkennung mit fortschreitender Krankheit festgestellt. Bluttests sind einfach und sicher durchzuführen und es können im Laufe der Zeit mehrere Proben entnommen werden. Im Gegensatz dazu erfordert die Analyse von soliden Tumoren invasive Verfahren, die die Patienten-Compliance einschränken könnten. Die Möglichkeit, den Krankheitsverlauf im Laufe der Zeit zu überwachen, könnte eine angemessene Änderung der Therapie eines Patienten erleichtern und möglicherweise seine Prognose und Lebensqualität verbessern. Der wichtige Aspekt der Fähigkeit, das zukünftige Fortschreiten der Krankheit zu prognostizieren, ist die Eliminierung (zumindest vorübergehend) der Notwendigkeit einer Operation, wenn die wiederholten CTC-Zahlen niedrig sind und nicht ansteigen; Zu den offensichtlichen Vorteilen der Vermeidung der Operation gehört die Vermeidung des Risikos, das mit der angeborenen Tumorgenität von Krebsoperationen verbunden ist. Zu diesem Zweck wurden in jüngster Zeit Technologien mit der erforderlichen Sensitivität und Reproduzierbarkeit zum Nachweis von CTCs bei Patienten mit metastasierten Erkrankungen entwickelt. Auf der anderen Seite sind CTCs sehr selten und liegen oft nur als wenige Zellen pro Milliliter Blut vor, was ihren Nachweis ziemlich schwierig macht. Darüber hinaus exprimieren sie oft eine Vielzahl von Markern, die von Patient zu Patient variieren, was die Entwicklung von Techniken mit hoher Sensitivität und Spezifität erschwert .
Typen
CTCs, die von Karzinomen (Krebsen epithelialen Ursprungs, die am weitesten verbreitet sind) stammen, können nach der Expression von epithelialen Markern sowie nach ihrer Größe und ob sie apoptotisch sind, klassifiziert werden. Im Allgemeinen sind CTCs Anoikis-resistent , was bedeutet, dass sie im Blutkreislauf überleben können, ohne sich an ein Substrat anzuheften .
- Herkömmliche CTCs zeichnen sich durch einen intakten, lebensfähigen Zellkern aus; die Expression von EpCAM und Cytokeratinen , die einen epithelialen Ursprung zeigen; das Fehlen von CD45, was anzeigt, dass die Zelle nicht hämatopoetischen Ursprungs ist; und ihre größere Größe , unregelmäßige Form oder subzelluläre Morphologie.
- Zytokeratin-negative CTCs sind durch das Fehlen von EpCAM oder Zytokeratinen gekennzeichnet, was auf einen undifferenzierten Phänotyp (zirkulierende Krebsstammzellen ) oder den Erwerb eines mesenchymalen Phänotyps (bekannt als epithelial-mesenchymaler Übergang oder EMT) hinweisen kann . Diese Populationen von CTCs können die resistentesten und anfälligsten für Metastasen sein. Sie sind auch schwieriger zu isolieren, da sie weder Zytokeratine noch CD45 exprimieren. Ansonsten ähneln Morphologie, Genexpression und Genomik denen anderer Krebszellen.
- Apoptotische CTCs sind traditionelle CTCs, die Apoptose (programmierter Zelltod) durchlaufen . Diese können verwendet werden, um das Ansprechen auf die Behandlung zu überwachen, wie es experimentell durch das Epic Sciences-Verfahren durchgeführt wird, das eine Kernfragmentierung oder zytoplasmatische Bläschenbildung im Zusammenhang mit Apoptose identifiziert. Die Messung des Verhältnisses von traditionellen CTCs zu apoptotischen CTCs – von der Grundlinie bis zur Therapie – liefert Hinweise auf die Wirksamkeit der Behandlung beim Targeting und Abtöten von Krebszellen.
- Kleine CTCs sind Zytokeratin-positiv und CD45-negativ, haben aber ähnliche Größen und Formen wie weiße Blutkörperchen. Wichtig ist, dass kleine CTCs krebsspezifische Biomarker haben, die sie als CTCs identifizieren. Kleine CTCs wurden mit der progressiven Erkrankung und der Differenzierung zu kleinzelligen Karzinomen in Verbindung gebracht, die oft einen anderen therapeutischen Verlauf erfordern.
CTC-Cluster
CTC-Cluster sind zwei oder mehr einzelne CTCs, die miteinander verbunden sind. Der CTC-Cluster kann traditionelle, kleine oder CK-CTCs enthalten. Diese Cluster haben krebsspezifische Biomarker, die sie als CTCs identifizieren. Mehrere Studien haben berichtet, dass das Vorhandensein dieser Cluster mit einem erhöhten Metastasierungsrisiko und einer schlechten Prognose verbunden ist. Zum Beispiel zeigte eine Studie mit Prostatakrebs eine achtmal längere durchschnittliche Überlebensrate für Patienten mit nur einzelnen CTCs im Vergleich zu denen mit CTC-Clustern, während andere Studien ähnliche Korrelationen für Dickdarmkrebs gezeigt haben. Darüber hinaus kann die Aufzählung von CTC-Clustern nützliche prognostische Informationen für Patienten mit bereits erhöhten CTC-Werten liefern.
Eine Studie hat jedoch berichtet, dass entgegen dem bestehenden Konsens zumindest eine einzelne Population dieser Cluster nicht bösartig ist und stattdessen aus dem Tumorendothel stammt. Diese zirkulierenden Tumor-Endothel-Cluster weisen ebenfalls epithelial-mesenchymale Marker auf, spiegeln jedoch nicht die Genetik des Primärtumors wider.
Bisher wurde angenommen, dass CTC-Cluster aufgrund ihrer Gesamtgröße keine engen Gefäße wie Kapillaren passieren können. Es wurde jedoch gezeigt, dass sich CTC-Cluster durch "selektive Spaltung interzellulärer Adhäsionen" "abwickeln" können, um diese Verengungen einzeln zu durchqueren und dann den Prozess nach der Auflösung umzukehren. Dieses Verhalten könnte ein Faktor dafür sein, warum CTC-Cluster ein so signifikantes metastatisches Potenzial haben.
Frequenz
Der Nachweis von CTCs kann wichtige prognostische und therapeutische Implikationen haben, aber da ihre Anzahl sehr gering sein kann, sind diese Zellen nicht leicht nachzuweisen. Es wird geschätzt, dass von den Zellen, die sich vom Primärtumor abgelöst haben, nur 0,01 % Metastasen bilden können.
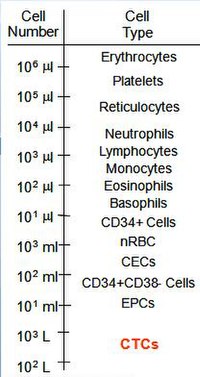
Zirkulierende Tumorzellen werden bei Patienten mit metastasierter Erkrankung in Häufigkeiten in der Größenordnung von 1-10 CTC pro ml Vollblut gefunden. Zum Vergleich: Ein ml Blut enthält einige Millionen weiße Blutkörperchen und eine Milliarde rote Blutkörperchen. Diese geringe Häufigkeit, verbunden mit der Schwierigkeit, Krebszellen zu identifizieren, bedeutet, dass eine Schlüsselkomponente zum Verständnis der biologischen Eigenschaften von CTCs Technologien und Ansätze erfordert, die in der Lage sind, 1 CTC pro ml Blut zu isolieren, entweder durch Anreicherung oder besser noch mit anreicherungsfreien Assays, die alle CTC-Subtypen in ausreichend hoher Auflösung, um die Bildquantitätsanforderungen der diagnostischen Pathologie bei Patienten mit einer Vielzahl von Krebsarten zu erfüllen. Bis heute wurden CTCs bei mehreren epithelialen Krebsarten (Brust-, Prostata-, Lungen- und Dickdarmkrebs) nachgewiesen und klinische Hinweise deuten darauf hin, dass Patienten mit metastasierten Läsionen eher isolierte CTCs aufweisen.
CTCs werden normalerweise (im Jahr 2011) aus dem Gefäßsystem abgefangen, indem spezifische Antikörper verwendet werden, die in der Lage sind, spezifische Tumormarker (normalerweise EpCAM ) zu erkennen; dieser Ansatz wird jedoch durch die Notwendigkeit einer ausreichenden Expression des ausgewählten Proteins auf der Zelloberfläche beeinflusst, was für den Anreicherungsschritt erforderlich ist. Da EpCAM und andere Proteine (zB Zytokeratine ) in manchen Tumoren nicht exprimiert werden und während der epithelialen zu mesenchymalen Transition ( EMT ) herunterreguliert werden können , sind darüber hinaus neue Anreicherungsstrategien erforderlich.
Erste Hinweise deuten darauf hin, dass in der Humanmedizin eingesetzte CTC-Marker bei anderen Spezies konserviert sind. Fünf der häufigeren Marker, einschließlich CK19, sind auch nützlich, um CTC im Blut von Hunden mit malignen Brusttumoren nachzuweisen. Neuere Ansätze sind in der Lage, mehr Zellen aus 7,5 ml Blut zu identifizieren, wie IsofFux oder Maintrac. In sehr seltenen Fällen sind CTCs in ausreichender Menge vorhanden, um bei routinemäßigen Blutausstrichuntersuchungen sichtbar zu sein . Dies wird als Karzinozythämie oder Karzinomzell-Leukämie bezeichnet und ist mit einer schlechten Prognose verbunden.
Erkennungsmethoden

Bis heute wurden verschiedene Forschungsmethoden entwickelt, um CTCs zu isolieren und aufzuzählen. Die einzige von der US-amerikanischen Food and Drug Administration (FDA) zugelassene Methode zur Zählung von CTC in Vollblut ist das CellSearch-System. Umfangreiche klinische Tests, die mit dieser Methode durchgeführt wurden, zeigen, dass das Vorhandensein von CTCs ein starker prognostischer Faktor für das Gesamtüberleben bei Patienten mit metastasiertem Brust-, Darm- oder Prostatakrebs ist.
CTCs sind entscheidend für das Verständnis der Biologie der Metastasierung und versprechen Potenzial als Biomarker zur nichtinvasiven Bewertung der Tumorprogression und des Ansprechens auf die Behandlung. Die Isolierung und Charakterisierung von CTCs stellt jedoch eine große technologische Herausforderung dar, da CTCs eine winzige Anzahl der Gesamtzellen im zirkulierenden Blut ausmachen, 1–10 CTCs pro ml Vollblut im Vergleich zu einigen Millionen weißen Blutkörperchen und einer Milliarde roten Blutkörperchen Zellen. Daher ist die größte Herausforderung für CTC-Forscher die vorherrschende Schwierigkeit der CTC-Aufreinigung, die die molekulare Charakterisierung von CTCs ermöglicht. Zur Isolierung von CTCs im peripheren Blut wurden mehrere Methoden entwickelt, die im Wesentlichen in zwei Kategorien eingeteilt werden: biologische Methoden und physikalische Methoden sowie Hybridmethoden, die beide Strategien kombinieren. Techniken können auch danach klassifiziert werden, ob sie CTCs zur Isolierung auswählen (positive Selektion) oder ob sie alle Blutzellen ausschließen (negative Selektion).
Biologische Methoden
Biologische Methoden isolieren Zellen auf Basis hochspezifischer Antigenbindung, am häufigsten durch monoklonale Antikörper zur positiven Selektion. Es wurden Antikörper gegen tumorspezifische Biomarker einschließlich EpCAM , HER2 und PSA verwendet. Die gebräuchlichste Technik ist die magnetische Nanopartikel-basierte Trennung (immunmagnetischer Assay), wie sie in CellSearch oder MACS verwendet wird . Andere in der Forschung befindliche Techniken umfassen die mikrofluidische Trennung und die Kombination von immunomagnetischem Assay und mikrofluidischer Trennung. Als Entwicklung der Mikrofabrikationstechnologie werden mikroskalige magnetische Strukturen implementiert, um eine bessere Kontrolle des Magnetfelds zu ermöglichen und die Erkennung von CTCs zu unterstützen. Onkolytische Viren wie Vacciniaviren werden entwickelt, um CTCs nachzuweisen und zu identifizieren. Es gibt alternative Verfahren, die konstruierte Proteine anstelle von Antikörpern verwenden, wie das Malaria- VAR2CSA- Protein, das an onkofetales Chondroitinsulfat auf der Oberfläche von CTCs bindet . CTCs können auch durch eine modifizierte Seldinger-Technik , wie sie von der GILUPI GmbH entwickelt wurde, direkt aus dem Blut gewonnen werden . Ein antikörperbeschichteter Metalldraht wird in eine periphere Vene eingeführt und verweilt dort für einen definierten Zeitraum (30 min). Während dieser Zeit können CTCs aus dem Blut an die Antikörper (derzeit anti-EpCAM) binden. Nach der Inkubationszeit wird der Draht entfernt, gewaschen und die nativen CTCs, isoliert aus dem Blut des Patienten, können weiter analysiert werden. Molekulargenetik sowie Immunfluoreszenzfärbung und verschiedene andere Methoden sind möglich. Vorteil dieser Methode ist das höhere Blutvolumen, das auf CTCs analysiert werden kann (ca. 750 ml in 30 min im Vergleich zu 7,5 ml einer entnommenen Blutprobe).
CellSearch-Methode
CellSearch ist die einzige von der FDA zugelassene Plattform für die CTC-Isolierung. Diese Methode basiert auf der Verwendung von Eisen- Nanopartikeln, die mit einer Polymerschicht beschichtet sind, die Biotin- Analoga trägt und mit Antikörpern gegen EpCAM konjugiert ist, um CTCs einzufangen. Die Isolierung wird an einen Analysator gekoppelt, um Bilder von isolierten Zellen nach ihrer Färbung mit spezifischen fluoreszierenden Antikörper-Konjugaten aufzunehmen. Blutproben werden in einem EDTA- Röhrchen mit einem zugesetzten Konservierungsmittel entnommen . Nach Ankunft im Labor werden 7,5 ml Blut zentrifugiert und in ein Aufbereitungssystem gegeben. Dieses System reichert die Tumorzellen zunächst immunomagnetisch mit Ferrofluid-Nanopartikeln und einem Magneten an. Anschließend werden die gewonnenen Zellen permeabilisiert und mit einer Kernfärbung, einem fluoreszierenden Antikörperkonjugat gegen CD45 (Leukozytenmarker) und Zytokeratinen 8 , 18 und 19 (epitheliale Marker) gefärbt . Die Probe wird dann auf einem Analysator gescannt, der Bilder der Kern-, Zytokeratin- und CD45-Färbungen aufnimmt. Um als CTC angesehen zu werden, muss eine Zelle einen Zellkern enthalten, positiv für die zytoplasmatische Expression von Cytokeratin sowie negativ für die Expression des CD45-Markers sein und einen Durchmesser von mehr als 5 µm aufweisen. Wenn die Gesamtzahl der Tumorzellen, die die oben genannten Kriterien erfüllen, 5 oder mehr beträgt, ist eine Blutprobe positiv. In Studien, die an Patienten mit Prostata-, Brust- und Dickdarmkrebs durchgeführt wurden, beträgt die mediane Überlebenszeit von Patienten mit Metastasen mit positiven Proben etwa die Hälfte der medianen Überlebenszeit von Patienten mit Metastasen mit negativen Proben. Dieses System zeichnet sich durch eine Wiederfindungskapazität von 93% und eine Nachweisgrenze von einem CTC pro 7,5 ml Vollblut aus. Bei bestimmten Krebsarten haben alternative Methoden wie IsoFlux eine höhere Sensitivität gezeigt .
Parsortix-Methode
Dieses automatisierte Verfahren verwendet Größenfiltration, um größere und weniger komprimierbare zirkulierende Tumorzellen aus anderen Blutkomponenten anzureichern. Das Parsortix-System kann Blutproben von 1 ml bis 40 ml aufnehmen. Eine mikrofluidische Einwegkassette mit einem 6,5 Mikrometer hohen Spalt lässt die überwiegende Mehrheit der roten und weißen Blutkörperchen durch, während größere seltene Zellen, einschließlich zirkulierender Tumorzellen und fetaler Zellen, gefangen werden. Gefangene Zellen können entweder automatisch mit Antikörpern zur Identifizierung angefärbt oder aus der Kassette freigesetzt werden. Diese freigesetzten/geernteten Zellen sind lebendig und können durch nachgeschaltete zelluläre und molekulare Techniken analysiert sowie kultiviert werden. Die Filterkassette fängt eine Vielzahl verschiedener Krebszelltypen ein.
Epic Sciences Methode
Diese Methode beinhaltet eine Technologie, um kernhaltige Zellen von roten Blutkörperchen zu trennen, denen ein Zellkern fehlt. Alle kernhaltigen Zellen, einschließlich normaler weißer Blutkörperchen und CTCs, werden fluoreszenzmarkierten Antikörpern ausgesetzt, die für Krebs-Biomarker spezifisch sind. Darüber hinaus erfasst das Bildgebungssystem von Epic Bilder aller Zellen auf dem Objektträger (ungefähr 3 Millionen), zeichnet die genauen Koordinaten jeder Zelle auf und analysiert jede Zelle auf 90 verschiedene Parameter, darunter die Fluoreszenzintensität der vier Fluoreszenzmarker und 86 verschiedene morphologische Parameter. Epic kann auch FISH und andere Färbetechniken verwenden, um nach Anomalien wie Duplikationen, Deletionen und Neuanordnungen zu suchen. Die Bildgebungs- und Analysetechnologie ermöglicht es auch, die Koordinaten jeder Zelle auf einem Objektträger zu kennen, sodass eine einzelne Zelle aus dem Objektträger zur Analyse mit Next-Generation-Sequencing entnommen werden kann. Ein in der Hämatopathologie trainierter Algorithmus umfasst zahlreiche Morphologiemessungen sowie die Expression von Zytokeratin und CD45. Der Algorithmus schlägt dann CTC-Kandidaten vor, die ein geschulter Leser bestätigt. Die interessierenden Zellen werden auf relevante phänotypische und genotypische Marker analysiert, wobei regionale weiße Blutkörperchen als negative Kontrollen eingeschlossen sind. Die molekularen Assays von Epic messen die Proteinexpression und fragen auch genomische Anomalien in CTCs für mehr als 20 verschiedene Krebsarten ab.
Maintrac
Maintrac ist eine diagnostische Bluttestplattform , die mikroskopische In-vitro- Diagnosemethoden zur Identifizierung seltener Zellen in Körperflüssigkeiten und ihrer molekularen Eigenschaften anwendet . Es basiert auf einer positiven Selektion mit EpCAM-spezifischen Antikörpern. Maintrac verwendet einen Ansatz, der auf der mikroskopischen Identifizierung zirkulierender Tumorzellen basiert. Um Schäden und Verlust der Zellen während des Prozesses zu vermeiden, verwendet Maintrac nur zwei Schritte zur Identifizierung. Im Gegensatz zu vielen anderen Methoden reinigt maintrac die Zellen nicht oder reichert sie an, sondern identifiziert sie im Kontext der anderen Blutverbindungen. Um lebenswichtige Zellen zu erhalten und den Stress dieser Zellen zu reduzieren, werden Blutzellen durch nur einen Zentrifugationsschritt und Erythrozyten-Lyse hergestellt. maintrac verwendet wie CellSearch einen EpCAM-Antikörper. Es wird jedoch nicht zur Anreicherung verwendet, sondern eher als Fluoreszenzmarker, um diese Zellen zu identifizieren. Zusammen mit der Kernfärbung mit Propidiumiodid kann die maintrac-Methode zwischen toten und lebenden Zellen unterscheiden. Als potentielle Tumorzellen werden nur vitale Propidiumzellen ohne EpCAM-positive Zellen gezählt. Nur lebende Zellen können zu Tumoren heranwachsen, daher können absterbende EpCAM-positive Zellen keinen Schaden anrichten. Die Suspension wird durch Fluoreszenzmikroskopie analysiert, die die Ereignisse automatisch zählt. Gleichzeitig werden Ereignisgalerien aufgezeichnet, um zu überprüfen, ob die Software eine echte lebende Zelle gefunden hat, und um beispielsweise zwischen Hautepithelzellen zu unterscheiden. Eine genaue Validierung der Methode zeigte, dass zusätzliche Antikörper von Zytokeratinen oder CD45 keinen Vorteil hatten.
Im Gegensatz zu anderen Methoden verwendet maintrac nicht die Einzelzellzahl als prognostischen Marker, sondern Maintrac nutzt die Dynamik der Zellzahl. Steigende Tumorzellzahlen sind ein wichtiger Faktor für die anhaltende Tumoraktivität. Sinkende Zellzahlen sind ein Zeichen für eine erfolgreiche Therapie. Daher kann maintrac verwendet werden, um den Erfolg einer Chemotherapie zu überprüfen und die Behandlung während einer Hormon- oder Erhaltungstherapie zu überwachen. Maintrac wurde experimentell zur Überwachung von Krebsrezidiven eingesetzt. Studien mit Maintrac haben gezeigt, dass bei Patienten ohne Krebs EpCAM-positive Zellen im Blut gefunden werden können. Entzündliche Erkrankungen wie Morbus Crohn zeigen ebenfalls erhöhte Spiegel von EpCAM-positiven Zellen. Patienten mit schweren Hautverbrennungen können auch EpCAM-positive Zellen im Blut tragen. Daher ist die Verwendung von EpCAM-positiven Zellen als Werkzeug zur Früherkennung nicht optimal.
Physikalische Methoden
Physikalische Methoden sind oft filterbasiert und ermöglichen die Erfassung von CTCs nach Größe und nicht nach spezifischen Epitopen . ScreenCell ist ein filtrationsbasiertes Gerät, das eine empfindliche und spezifische Isolierung von CTCs aus menschlichem Vollblut in wenigen Minuten ermöglicht. Peripheres Blut wird entnommen und innerhalb von 4 Stunden mit einem ScreenCell-Isolationsgerät verarbeitet, um CTCs zu erfassen. Die eingefangenen Zellen sind bereit für die Zellkultur oder für die direkte Charakterisierung mit dem ViewRNA-in-situ-Hybridisierungsassay. Die Parsortix-Methode trennt CTCs nach ihrer Größe und Verformbarkeit.
Hybride Methoden
Hybridmethoden kombinieren physikalische Trennung (durch Gradienten, Magnetfelder etc.) mit Antikörper-vermittelter Zellgewinnung. Ein Beispiel hierfür ist ein empfindliches Doppelgradientenzentrifugations- und magnetisches Zellsortierungs-Nachweis- und -Zählverfahren, das verwendet wurde, um zirkulierende epitheliale Krebszellen bei Brustkrebspatientinnen durch negative Selektion nachzuweisen. Das Prinzip der Negativselektion basiert auf der Gewinnung aller Blutzellen unter Verwendung eines Antikörper-Panels sowie der traditionellen Gradientenzentrifugation mit Ficoll . Eine ähnliche Methode, bekannt als ISET-Test, wurde verwendet, um zirkulierende Prostatakrebszellen zu erkennen, und eine andere als RosetteStep bekannte Methode wurde verwendet, um CTCs von Patienten mit kleinzelligem Lungenkrebs zu isolieren . In ähnlicher Weise haben Forscher des Massachusetts General Hospital eine negative Selektionsmethode entwickelt, bei der Trägheitsfokussierung auf ein Mikrofluidikgerät verwendet wird . Die Technik namens CTC-iChip entfernt zuerst Zellen, die zu klein sind, um CTCs zu sein, wie rote Blutkörperchen, und verwendet dann magnetische Partikel, um weiße Blutkörperchen zu entfernen.
CTC-Charakterisierung
Einige Medikamente sind besonders wirksam gegen Krebserkrankungen, die bestimmte Anforderungen erfüllen. Herceptin ist beispielsweise bei Patienten mit Her2- positiv sehr wirksam , aber bei Patienten mit Her2-negativ viel weniger wirksam. Sobald der Primärtumor entfernt ist, ist eine Biopsie des aktuellen Krebszustandes durch traditionelle Gewebetypisierung nicht mehr möglich. Für die Typisierung werden oft Gewebeschnitte des Primärtumors verwendet, die vor Jahren entnommen wurden. Eine weitere Charakterisierung von CTC kann helfen, den aktuellen Tumorphänotyp zu bestimmen. Es wurden FISH-Assays mit CTC sowie die Bestimmung des IGF-1R- , Her2-, Bcl-2- , ERG- , PTEN- und AR- Status mittels Immunfluoreszenz durchgeführt . Die qPCR auf Einzelzellebene kann auch mit den aus Blut isolierten CTCs durchgeführt werden.
Der Organtropismus von Patienten-abgeleiteten CTC wurde in einem Mausmodell untersucht. CTCs, die aus Brustkrebspatientinnen isoliert und in vitro vermehrt wurden, zeigten, dass sie bei Mäusen Knochen-, Lungen-, Eierstock- und Hirnmetastasen erzeugen können, was teilweise die sekundären Läsionen widerspiegelt, die bei den entsprechenden Patienten gefunden wurden. Bemerkenswerterweise war eine CTC-Linie, die lange vor dem Auftreten von Hirnmetastasen bei Patienten isoliert wurde, hoch kompetent, Hirnmetastasen bei Mäusen zu erzeugen. Dies war der erste prädiktive Fall für Hirnmetastasen und ein Beweis für das Konzept, dass intrinsische molekulare Merkmale von metastatischen Vorläufern unter CTCs neue Einblicke in die Mechanismen der Metastasierung liefern könnten.
Zellmorphologie
Das morphologische Erscheinungsbild wird von menschlichen Bedienern beurteilt und unterliegt daher großen Schwankungen zwischen den Bedienern. Es gibt mehrere CTC-Zählverfahren, die das morphologische Erscheinungsbild verwenden, um CTC zu identifizieren, die auch unterschiedliche morphologische Kriterien anwenden können. Eine kürzlich durchgeführte Studie zu Prostatakrebs zeigte, dass viele verschiedene morphologische Definitionen von zirkulierenden Tumorzellen einen ähnlichen prognostischen Wert haben, obwohl die absolute Anzahl der Zellen, die bei Patienten und normalen Spendern gefunden wurden, zwischen verschiedenen morphologischen Definitionen um mehr als ein Jahrzehnt variierte.
Geschichte
CTCs wurden zum ersten Mal 1869 im Blut eines Mannes mit metastasierendem Krebs von Thomas Ashworth beobachtet, der postulierte, dass "Zellen, die mit denen des Krebses selbst im Blut zu sehen sind, dazu neigen, etwas Licht auf den Entstehungsmodus zu werfen". von mehreren Tumoren, die bei derselben Person vorhanden sind". Ein gründlicher Vergleich der Morphologie der zirkulierenden Zellen mit Tumorzellen aus verschiedenen Läsionen führte Ashworth zu dem Schluss, dass "eine Sache sicher ist, dass, wenn sie [CTC] aus einer bestehenden Krebsstruktur stammen, sie den größten Teil der Kreislaufsystem an der Vena saphena interna des gesunden Beines angekommen ist".
Die Bedeutung von CTCs in der modernen Krebsforschung begann Mitte der 1990er Jahre mit dem Nachweis, dass CTCs schon früh im Krankheitsverlauf existieren. Diese Ergebnisse wurden durch eine äußerst empfindliche Magnettrenntechnologie mit Ferrofluiden (kolloidalen magnetischen Nanopartikeln) und Magnetseparatoren mit hohem Gradienten ermöglicht, die von Paul Liberti erfunden und durch theoretische Berechnungen von Liberti und Leon Terstappen motiviert wurden, die darauf hindeuteten, dass sehr kleine Tumore Zellen mit weniger als 1,0% pro Tag sollte zu nachweisbaren Zellen im Blut führen. Eine Vielzahl anderer Technologien wurde seit dieser Zeit auf die CTC-Aufzählung und -Identifikation angewendet.
Die moderne Krebsforschung hat gezeigt, dass CTCs von Klonen im Primärtumor abstammen, was Ashworths Bemerkungen bestätigt. Die erheblichen Anstrengungen zum Verständnis der biologischen Eigenschaften der CTCs haben die entscheidende Rolle zirkulierender Tumorzellen bei der metastatischen Ausbreitung von Karzinomen gezeigt . Darüber hinaus zeigte eine hochempfindliche Einzelzellanalyse ein hohes Maß an Heterogenität auf Einzelzellebene sowohl für die Proteinexpression als auch für die Proteinlokalisierung, und die CTCs spiegelten sowohl die primäre Biopsie als auch die an den metastatischen Stellen beobachteten Veränderungen wider.