Übersprechen (Biologie) - Crosstalk (biology)
Biologisches Crosstalk bezieht sich auf Fälle, in denen eine oder mehrere Komponenten eines Signalübertragungsweges einen anderen beeinflussen. Dies kann auf verschiedene Weise erreicht werden, wobei die häufigste Form das Übersprechen zwischen Proteinen von Signalkaskaden ist. In diesen Signalübertragungswegen gibt es oft gemeinsame Komponenten, die mit beiden Signalwegen interagieren können. Ein komplexerer Fall von Crosstalk kann beim transmembranen Crosstalk zwischen der extrazellulären Matrix (ECM) und dem Zytoskelett beobachtet werden .
Übersprechen zwischen Signalwegen
Ein Beispiel für das Crosstalk zwischen Proteinen in einem Signalweg ist die Rolle des zyklischen Adenosinmonophosphats (cAMP) bei der Regulierung der Zellproliferation durch Interaktion mit dem Mitogen-aktivierten Protein (MAP)-Kinaseweg. cAMP ist eine Verbindung, die in Zellen durch Adenylatcyclase als Reaktion auf eine Vielzahl extrazellulärer Signale synthetisiert wird. cAMP wirkt hauptsächlich als intrazellulärer zweiter Messenger, dessen wichtigster intrazellulärer Rezeptor die cAMP-abhängige Proteinkinase (PKA) ist, die durch die Phosphorylierung von Zielproteinen wirkt. Der Signaltransduktionsweg beginnt mit Ligand-Rezeptor-Interaktionen extrazellulär. Dieses Signal wird dann durch die Membran transduziert, wodurch die Adenylylcyclase auf der inneren Membranoberfläche stimuliert wird, um die Umwandlung von ATP in cAMP zu katalysieren.
ERK, ein am MAPK-Signalweg beteiligtes Protein, kann durch cAMP aktiviert oder gehemmt werden. cAMP kann ERKs auf verschiedene Weise hemmen, von denen die meisten die cAMP-abhängige Proteinkinase (PKA) und die Hemmung von Ras-abhängigen Signalen für Raf-1 beinhalten. cAMP kann jedoch auch die Zellproliferation stimulieren, indem es ERKs stimuliert. Dies geschieht durch die Induktion bestimmter Gene durch Phosphorylierung des Transkriptionsfaktors CREB durch PKA. Obwohl ERKs keine Voraussetzung für diese Phosphorylierung von CREB zu sein scheinen, spielt der MAPK-Weg wieder beim Crosstalk eine Rolle, da ERKs erforderlich sind, um Proteine stromabwärts von CREB zu phosphorylieren. Andere bekannte Beispiele für das Erfordernis von ERKs für cAMP-induzierte transkriptionelle Wirkungen umfassen die Induktion des Prolaktin-Gens in Hypophysenzellen und des Dopamin-beta-Hydroxylat-Gens in phäochromozytomalen Zellen (PC12). Es gibt eine Reihe verschiedener Mechanismen, durch die cAMP die ERK-Signalgebung beeinflussen kann. Die meisten Mechanismen, die eine cAMP-Hemmung von ERKs beinhalten, entkoppeln Raf-1 von der Ras-Aktivierung durch direkte Interaktion von PKA mit Raf-1 oder indirekt durch PKA-Interaktion mit der GTPase Rap1 (siehe Abbildung 1). PKA kann auch ERKs durch die Aktivierung von PTPasen negativ regulieren. Die Mechanismen zur Aktivierung von ERKs durch cAMP sind noch vielfältiger und umfassen normalerweise Rap1 oder Ras und sogar direkt cAMP.
Transmembranes Übersprechen
Crosstalk kann sogar über Membranen hinweg beobachtet werden. Membraninteraktionen mit der extrazellulären Matrix (ECM) und mit benachbarten Zellen können eine Vielzahl von Reaktionen innerhalb der Zelle auslösen. Aber auch die Topographie und die mechanischen Eigenschaften der ECM spielen eine wichtige Rolle für ein starkes, komplexes Übersprechen mit den Zellen, die auf oder in der Matrix wachsen. Zum Beispiel werden der Integrin- vermittelte Zytoskelettaufbau und sogar die Zellmotilität durch den physikalischen Zustand der ECM beeinflusst. Die Bindung des α5β1-Integrins an seinen Liganden ( Fibronektin ) aktiviert die Bildung von fibrillären Adhäsionen und Aktinfilamenten . Wird die ECM jedoch immobilisiert, wird eine solche Matrixreorganisation und die Bildung fibrillärer Adhäsionen gehemmt. Die Bindung desselben Integrins (α5β1) an einen immobilisierten Fibronektin-Liganden wiederum bildet stark phosphorylierte fokale Kontakte/ fokale Adhäsion (Zellen, die an der Matrixadhäsion beteiligt sind) innerhalb der Membran und reduziert die Zellmigrationsraten in der Zusammensetzung von fokalen Kontakten im Zytoskelett können durch Mitglieder noch eines anderen Stoffwechselwegs gehemmt werden: Inhibitoren von Myosin-Leichtketten-Kinasen oder Rho-Kinasen, H-7 oder ML-7, die die Zellkontraktilität und folglich die Motilität reduzieren. (siehe Abbildung 2).

Crosstalk bei der Lymphozytenaktivierung
Ein komplexeres, spezifischeres Beispiel für Crosstalk zwischen zwei Hauptsignalwegen kann bei der Interaktion der cAMP- und MAPK-Signalwege bei der Aktivierung von Lymphozyten beobachtet werden . In diesem Fall beeinflussen Komponenten des cAMP-Signalwegs direkt und indirekt den MAPK-Signalweg, der Gene aktivieren soll , die Immunität und Lymphozyten betreffen .
Neu gebildetes cAMP wird von der Membran freigesetzt und diffundiert durch den intrazellulären Raum, wo es zur Aktivierung von PKA dient. Die katalytische Untereinheit von PKA muss vier Moleküle cAMP binden, um aktiviert zu werden, woraufhin die Aktivierung in einer Spaltung zwischen der regulatorischen und der katalytischen Untereinheit besteht. Diese Spaltung wiederum aktiviert PKA, indem sie die katalytischen Zentren der C-Untereinheiten freilegt, die dann eine Reihe von Proteinen in der Zelle phosphorylieren können.
In Lymphozyten steigen die intrazellulären cAMP-Spiegel bei Antigenrezeptor-Stimulation und noch stärker als Reaktion auf Prostaglandin E und andere Immunsuppressionsmittel . In diesem Fall dient cAMP dazu, Immunitätsspieler zu hemmen. PKA Typ I kolokalisiert mit den T-Zell- und B-Zell- Antigenrezeptoren und bewirkt eine Hemmung der T- und B-Zell-Aktivierung. PKA wurde sogar als direkter Induktor von Genen hervorgehoben, die zur Immunsuppression beitragen.
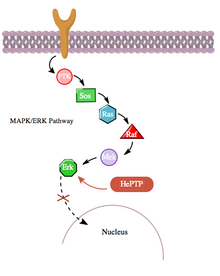
Darüber hinaus interagiert der cAMP-Weg auch auf indirektere Weise mit dem MAPK-Weg durch seine Wechselwirkung mit der hämatopoetischen PTPase (HePTP). HePTP wird in allen Leukozyten exprimiert. Bei Überexpression in T-Zellen reduziert HePTP die transkriptionelle Aktivierung des Interleukin-2- Promotors, die typischerweise durch den aktivierten T-Zell-Rezeptor durch eine MAPK-Signalkaskade induziert wird. Die Art und Weise, wie HePTP die MAPK-Signalgebung effektiv hemmt, besteht darin, mit den MAP-Kinasen Erk1, Erk2 und p38 über eine kurze Sequenz in HePTPs nicht-katalytischem N-Terminus zu interagieren, die als Kinase-Interaktionsmotiv (KIM) bezeichnet wird., Die hochspezifische Bindung von Erk und p38 zu dieser Untereinheit von HePTP führt zu einer schnellen Inaktivierung der Signalkaskade (siehe Abbildung 3).
Da jedoch sowohl HePTP als auch Erk zytosolische Enzyme sind , ist der Schluss naheliegend , dass es einen Mechanismus für die Hemmung von Erk durch HePTP gibt, um die Translokation von aktiviertem Erk in den Zellkern zu ermöglichen . Tatsächlich scheint HePTP, wie in vielen anderen Fällen von Protein-Protein-Interaktion, von Erk und p38 an den Stellen Thr45 und Ser72 phosphoryliert zu werden. Wichtig ist jedoch, dass eine dritte Phosphorylierungsstelle im nicht-katalytischen N-Terminus (der KIM-Region) von HePTP gefunden wurde – eine, die durch den cAMP-Weg zu einer viel höheren Stöchiometrie phosphoryliert wird, in einem weiteren Fall von Crosstalk zwischen cAMP und MAPK Wege.
Die Phosphorylierung dieser dritten Stelle durch PKAs aus dem cAMP-Weg hemmt die Bindung von MAP-Kinasen an HePTP und reguliert dadurch die MAPK/ERK-Signalkaskade hoch. Der MAPK-Weg über Ras, Raf, Mek und Erk zeigt in Gegenwart von nicht phosphoryliertem (aktivem) HePTP eine geringe Aktivität. Die Aktivierung des cAMP-Wegs stimuliert jedoch die Aktivierung von PKA, die wiederum HePTP an Ser23 phosphoryliert. Dies verhindert, dass HePTP an Erk bindet, und befreit den MAPK-Signalweg von der Hemmung, wodurch die stromabwärts gerichtete Signalübertragung fortgesetzt werden kann (siehe Abbildung 4).

Darüber hinaus haben Studien mit glatten Muskelzellen aus dem Atrium des Herzens gezeigt, dass PKA die Aktivierung von MAP-Kinasen als Reaktion auf den Platelet-derived Growth Factor ( PDGF ) durch Phosphorylierung der Kinase c-Raf reduzieren kann . Somit erscheint es plausibel, dass PKA im cAMP-Signalweg sogar noch weiter an der Regulation der Lymphozytenaktivierung beteiligt sein könnte, nicht nur durch Hemmung des Antigen-Rezeptor-MAPK-Signalwegs in seinem Endstadium, sondern sogar noch weiter stromaufwärts.