Cyclohexan-Konformation - Cyclohexane conformation
In der organischen Chemie , Cyclohexan Konformationen sind beliebige von mehreren dreidimensionalen Formen , die durch angenommene Moleküle von Cyclohexan . Da viele Verbindungen strukturell ähnlich sechsglied verfügen Ringe , die Struktur und Dynamik von Cyclohexan sind wichtige Prototypen einer Vielzahl von Verbindungen.
Die Innenwinkel eines regelmäßigen , flachen Sechsecks betragen 120 °, während der bevorzugte Winkel zwischen aufeinanderfolgenden Bindungen in einer Kohlenstoffkette etwa 109,5 ° beträgt, der tetraedrische Winkel ( Bogenkosinus von –1/3). Daher neigt der Cyclohexanring dazu, nicht planare (verzogene) Konformationen anzunehmen , die alle Winkel näher an 109,5 ° und daher eine geringere Verformungsenergie als die flache hexagonale Form aufweisen.
Wenn wir die Kohlenstoffatome 1, 2 und 3 mit den richtigen Bindungslängen und dem tetraedrischen Winkel zwischen den beiden Bindungen stationär halten und dann die Kohlenstoffatome 4, 5 und 6 mit der richtigen Bindungslänge und dem richtigen tetraedrischen Winkel hinzufügen, Wir können die drei Diederwinkel für die Sequenzen (2,3,4), (3,4,5) und (4,5,6) variieren . Die nächste Bindung von Atom 6 ergibt ebenfalls einen Diederwinkel, sodass wir vier Freiheitsgrade haben . Diese letzte Bindung muss jedoch an der Position von Atom 1 enden, das drei Bedingungen im dreidimensionalen Raum auferlegt. Dies bedeutet, dass es einen Grad an Konformationsfreiheit gibt, vorausgesetzt, alle Bindungslängen sind gleich und alle Winkel zwischen den Bindungen sind gleich. Es stellt sich heraus, dass es zwei Arten von Lösungen für dieses geometrische Problem gibt. Ein Satz besteht aus zwei Stuhlkonfigurationen (eine, bei der die Kette der Atome 1, 2, 3 und 4 einen positiven Diederwinkel aufweist, und eine, bei der sie negativ ist). Der andere Satz ist ein Kontinuum, ein topologischer Kreis, in dem die Winkelbelastung Null ist, einschließlich des Drehboots und der Bootskonformationen . Alle Konformationen auf diesem Kontinuum haben eine zweifache Symmetrieachse, die durch den Ring verläuft, während die Stuhlkonformationen dies nicht tun (sie haben eine D 3d- Symmetrie, wobei eine dreifache Achse durch den Ring verläuft). Auf diesem Kreis variiert die Energie aufgrund der Pitzer-Dehnung in Bezug auf die Diederwinkel. Das Twist-Boot hat eine geringere Energie als das Boot. Um von der Sesselkonformation zu einer Twist-Boot - Konformation oder die anderen Sesselkonformation zu gehen, haben Bindungswinkel verändert werden, was zu einer hochenergetischen Halbsesselkonformation Konformation. Die relativen Stabilitäten sind also: Stuhl> Drehboot> Boot> Halbstuhl. Alle relativen Konformationsenergien sind unten gezeigt. Bei Raumtemperatur kann sich das Molekül leicht zwischen diesen Konformationen bewegen, aber nur Stuhl und Drehboot können in reiner Form isoliert werden, da sich die anderen nicht in lokalen Energieminima befinden.
Die Konformationen des Bootes und des Drehboots liegen, wie gesagt, entlang eines Kontinuums der Nullwinkelbelastung. Wenn es Substituenten gibt, mit denen die verschiedenen Kohlenstoffatome unterschieden werden können, ist dieses Kontinuum wie ein Kreis mit sechs Bootskonformationen und sechs Twist-Boat-Konformationen zwischen ihnen, drei "Rechtshänder" und drei "Linkshänder". (Was als rechtshändig bezeichnet werden sollte, ist unwichtig.) Wenn die Kohlenstoffatome jedoch nicht unterscheidbar sind, wie bei Cyclohexan selbst, führt die Bewegung entlang des Kontinuums das Molekül von der Bootsform zu einem "rechtshändigen" Twist-Boot und dann zurück zur gleichen Bootsform (mit einer Permutation der Kohlenstoffatome), dann zu einem "linkshändigen" Twist-Boot und dann wieder zurück zum achiralen Boot.
Hauptkonformere
Die verschiedenen Konformationen werden "Konformere" genannt, eine Mischung aus den Wörtern "Konformation" und "Isomer".
Stuhlkonformation
Die Stuhlkonformation ist der stabilste Konformer. Bei 25 ° C nehmen 99,99% aller Moleküle in einer Cyclohexanlösung diese Konformation an.
Die Symmetrie ist D 3d . Alle Kohlenstoffzentren sind gleichwertig. Sechs Wasserstoffzentren befinden sich in axialen Positionen, ungefähr parallel zur C 3 -Achse, und sechs Wasserstoffatome befinden sich in der Nähe des Äquators. Diese H-Atome werden jeweils als axial und äquatorial bezeichnet.
Jeder Kohlenstoff trägt einen "auf" und einen "ab" Wasserstoff. Die CH-Bindungen in aufeinanderfolgenden Kohlenstoffen sind daher versetzt, so dass nur eine geringe Torsionsspannung vorliegt . Die Stuhlgeometrie bleibt häufig erhalten, wenn die Wasserstoffatome durch Halogene oder andere einfache Gruppen ersetzt werden .
Wenn wir uns ein Kohlenstoffatom als einen Punkt vorstellen , an dem vier Halbbindungen in Richtung der Eckpunkte eines Tetraeders herausragen , können wir uns vorstellen, dass sie auf einer Oberfläche stehen, wobei eine Halbbindung gerade nach oben zeigt. Wenn Sie von rechts oben schauen, scheinen die anderen drei nach außen in Richtung der Eckpunkte eines gleichseitigen Dreiecks zu gehen , sodass die Bindungen einen Winkel von 120 ° zwischen ihnen zu haben scheinen. Betrachten Sie nun sechs solcher Atome, die auf der Oberfläche stehen, so dass sich ihre nicht vertikalen Halbbindungen treffen und ein perfektes Sechseck bilden. Wenn wir dann drei der Atome so reflektieren, dass sie sich unter der Oberfläche befinden, haben wir etwas sehr Ähnliches wie Cyclohexan mit Stuhlkonformation. In diesem Modell sind die sechs vertikalen Halbbindungen genau vertikal, und die Enden der sechs nicht vertikalen Halbbindungen, die aus dem Ring herausragen, befinden sich genau am Äquator (dh an der Oberfläche). Da CH-Bindungen tatsächlich länger als eine halbe CC-Bindung sind, befinden sich die "äquatorialen" Wasserstoffatome von Stuhlcyclohexan tatsächlich unterhalb des Äquators, wenn sie an einen Kohlenstoff gebunden sind, der sich oberhalb des Äquators befindet, und umgekehrt. Dies gilt auch für andere Substituenten. Der Diederwinkel für eine Reihe von vier Kohlenstoffatomen, die in diesem Modell um den Ring verlaufen, wechselt zwischen genau + 60 ° und –60 ° ( Gauche genannt ).
Die Stuhlkonformation kann sich nicht verformen, ohne die Bindungswinkel oder -längen zu ändern. Wir können es uns als zwei Ketten vorstellen, die spiegelbildlich zueinander stehen und die Atome 1-2-3-4 und 1-6-5-4 mit entgegengesetzten Diederwinkeln enthalten. Der Abstand von Atom 1 zu Atom 4 hängt vom Absolutwert des Diederwinkels ab. Wenn sich diese beiden Diederwinkel ändern (immer noch gegenüberliegend), ist es nicht möglich, den korrekten Bindungswinkel sowohl bei Kohlenstoff 1 als auch bei Kohlenstoff 4 beizubehalten.
Boots- und Twist-Boat-Konformationen
Die Bootskonformationen haben eine höhere Energie als die Stuhlkonformationen. Insbesondere die Wechselwirkung zwischen den beiden Fahnenmole- Wasserstoffatomen erzeugt eine sterische Belastung . Eine Torsionsspannung besteht auch zwischen den C2-C3- und C5-C6-Bindungen (Kohlenstoff Nummer 1 ist eine der beiden auf einer Spiegelebene), die verdeckt sind - das heißt, diese beiden Bindungen sind über eine Spiegelebene parallel zueinander. Aufgrund dieser Belastung ist die Bootskonfiguration instabil (dh es handelt sich nicht um ein lokales Energieminimum).
Die molekulare Symmetrie beträgt C 2v .
Die Bootskonformationen verzerren sich spontan zu Twist-Boat-Konformationen. Hier wird die Symmetrie ist D 2 , eine reine Drehpunktgruppe mit drei zweifach - Achsen. Diese Konformation kann aus der Bootskonformation abgeleitet werden, indem eine leichte Verdrehung auf das Molekül angewendet wird, um die Verfinsterung von zwei Paaren von Methylengruppen zu entfernen. Die Twist-Boat-Konformation ist chiral und existiert in rechtshändigen und linkshändigen Versionen.
Die Konzentration der Twist-Boat-Konformation bei Raumtemperatur beträgt weniger als 0,1%, bei 1073 Kelvin kann sie jedoch 30% erreichen. Das schnelle Abkühlen einer Cyclohexanprobe von 1073 K auf 40 K gefriert in einer großen Konzentration der Twist-Boat-Konformation, die sich dann beim Erhitzen langsam in die Stuhlkonformation umwandelt.
Dynamik
Stuhl-Stuhl
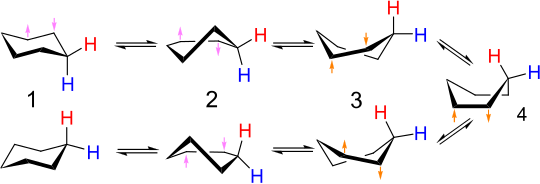
Die gegenseitige Umwandlung von Stuhlkonformern wird als Ringflippen oder Stuhlflippen bezeichnet . Kohlenstoff-Wasserstoff-Bindungen, die in einer Konfiguration axial sind, werden in der anderen äquatorial und umgekehrt. Bei Raumtemperatur der beiden Sesselkonformationen schnell ins Gleichgewicht . Das Protonen-NMR-Spektrum von Cyclohexan ist bei Raumtemperatur ein Singulett.
In einer Stuhlform ist der Diederwinkel der Kette der Kohlenstoffatome 1-2-3-4 positiv, während der der Kette 1-6-5-4 negativ ist, in der anderen Stuhlform ist die Situation umgekehrt . Beide Ketten müssen also eine Umkehrung des Diederwinkels erfahren. Wenn einer dieser beiden Vieratomketten an einen Diederwinkel von Null abflacht, haben wir die Halb-Sessel - Konformation, in einer maximalen Energie entlang des Umwandlungsweg. Wenn der Diederwinkel dieser Kette dann gleich (sowohl im Vorzeichen als auch in der Größe) dem der anderen Vieratomkette entspricht, hat das Molekül das Kontinuum der Konformationen erreicht, einschließlich des Drehboots und des Bootes, wo die Bindungswinkel und Längen können alle auf ihren normalen Werten liegen und die Energie ist daher relativ gering. Danach muss die andere Kette mit vier Kohlenstoffatomen das Vorzeichen ihres Diederwinkels umschalten, um die Zielstuhlform zu erreichen, sodass das Molekül erneut den Halbstuhl passieren muss, wenn der Diederwinkel dieser Kette durch Null geht. Das sequentielle Umschalten der Vorzeichen der beiden Ketten auf diese Weise minimiert den Zustand der maximalen Energie auf dem Weg (im Halbstuhlzustand) - wenn die Diederwinkel der beiden Vieratomketten gleichzeitig das Vorzeichen wechseln, würde dies eine Konformation von gerade durchlaufen höhere Energie aufgrund der Winkelbelastung an den Kohlenstoffen 1 und 4.
Der detaillierte Mechanismus der Umwandlung von Stuhl zu Stuhl war Gegenstand zahlreicher Studien und Debatten. Der Halb-Sessel - Zustand ( D , in Figur unten) ist die Schlüsselübergangszustand in der gegenseitigen Umwandlung zwischen den Stuhl und Twist-Boot - Konformationen. Der Halbstuhl hat C 2 -Symmetrie. Die gegenseitige Umwandlung zwischen den beiden Stuhlkonformationen erfolgt in der folgenden Reihenfolge: Stuhl → halber Stuhl → Drehboot → halber Stuhl '→ Stuhl'.
Twist-Boot - Twist-Boot
Die Bootskonformation ( C , unten) ist ein Übergangszustand, der die gegenseitige Umwandlung zwischen zwei verschiedenen Twist-Boat-Konformationen ermöglicht. Während die Bootskonformation für die gegenseitige Umwandlung zwischen den beiden Stuhlkonformationen von Cyclohexan nicht erforderlich ist , wird sie häufig in das Reaktionskoordinatendiagramm aufgenommen, das zur Beschreibung dieser Umwandlung verwendet wird, da seine Energie erheblich niedriger ist als die des halben Stuhls, also jedes Molekül mit genügend Die Energie, um vom Drehboot zum Stuhl zu gelangen, hat auch genug Energie, um vom Drehboot zum Boot zu gelangen. Somit gibt es mehrere Wege, über die ein Cyclohexanmolekül in der Twist-Boat-Konformation die Stuhlkonformation wieder erreichen kann.
Substituierte Derivate
In Cyclohexan haben die beiden Stuhlkonformationen die gleiche Energie. Bei substituierten Derivaten wird die Situation komplexer. In Methylcyclohexan sind die beiden Stuhlkonformere nicht isoenergetisch. Die Methylgruppe bevorzugt die äquatoriale Orientierung. Die Präferenz eines Substituenten gegenüber der äquatorialen Konformation wird anhand seines A-Werts gemessen , der die Gibbs- Differenz der freien Energie zwischen den beiden Stuhlkonformationen darstellt. Ein positiver A-Wert zeigt die Präferenz gegenüber der Äquatorposition an. Die Größe der A-Werte reicht von nahezu Null für sehr kleine Substituenten wie Deuterium bis zu etwa 5 kcal / mol (21 kJ / mol) für sehr sperrige Substituenten wie die tert- Butylgruppe .
Disubstituierte Cyclohexane
Für 1,2- und 1,4-disubstituierte Cyclohexane führt eine cis- Konfiguration zu einer axialen und einer äquatorialen Gruppe. Solche Arten erfahren ein schnelles, entartetes Umdrehen des Stuhls. Für 1,2- und 1,4-disubstituiertes Cyclohexan, eine trans- Konfiguration, wird die diaxiale Konformation durch seine hohe sterische Belastung wirksam verhindert. Für 1,3-disubstituierte Cyclohexane ist die cis- Form diequatorial und die gespiegelte Konformation leidet unter einer zusätzlichen sterischen Wechselwirkung zwischen den beiden axialen Gruppen. trans -1,3-disubstituierte Cyclohexane sind wie cis -1,2- und cis -1,4- und können zwischen den beiden äquivalenten axialen / äquatorialen Formen wechseln.
Cis- 1,4-Di- tert- butylcyclohexan hat eine axiale tert- Butylgruppe in der Stuhlkonformation, und die Umwandlung in die Twist-Boat-Konformation bringt beide Gruppen in günstigere äquatoriale Positionen. Infolgedessen ist die Twist-Boat-Konformation um 0,47 kJ / mol (0,11 kcal / mol) bei 125 K stabiler, gemessen durch NMR-Spektroskopie .
Heterocyclische Analoga
Heterocyclische Analoga von Cyclohexan sind in Zuckern, Piperidinen, Dioxanen usw. allgegenwärtig. Sie folgen im Allgemeinen den für Cyclohexan beobachteten Trends, dh der Stuhlkonformer ist am stabilsten. Die axial-äquatorialen Gleichgewichte (A-Werte) werden jedoch stark durch den Ersatz eines Methylen durch O oder NH beeinflusst. Veranschaulichend sind die Konformationen der Glucoside . 1,2,4,5-Tetrathian ((SCH 2 ) 3 ) fehlen die ungünstigen 1,3-diaxialen Wechselwirkungen von Cyclohexan. Folglich ist seine Twist-Boat-Konformation besiedelt; In der entsprechenden Tetramethylstruktur, 3,3,6,6-Tetramethyl-1,2,4,5-tetrathian, dominiert die Twist-Boat-Konformation.
Historischer Hintergrund
1890 veröffentlichte Hermann Sachse , ein 28-jähriger Assistent in Berlin, Anweisungen zum Falten eines Blattes Papier, um zwei Formen von Cyclohexan darzustellen, die er als symmetrisch und unsymmetrisch bezeichnete (was wir jetzt Stuhl und Boot nennen würden ). Er verstand klar, dass diese Formen zwei Positionen für die Wasserstoffatome hatten (wiederum um die moderne Terminologie zu verwenden, axial und äquatorial ), dass sich zwei Stühle wahrscheinlich gegenseitig umwandeln würden und sogar, wie bestimmte Substituenten eine der Stuhlformen bevorzugen könnten ( Sachse-Mohr-Theorie) ). Weil er dies alles in mathematischer Sprache ausdrückte, verstanden nur wenige Chemiker seiner Zeit seine Argumente. Er hatte mehrere Versuche, diese Ideen zu veröffentlichen, aber keiner gelang es, die Vorstellungskraft der Chemiker zu wecken. Sein Tod im Jahr 1893 im Alter von 31 Jahren bedeutete, dass seine Ideen in Vergessenheit gerieten. Erst 1918 konnte Ernst Mohr , basierend auf der Molekülstruktur von Diamant, die kürzlich mit der damals sehr neuen Technik der Röntgenkristallographie gelöst worden war, erfolgreich argumentieren, dass Sachses Stuhl das zentrale Motiv war. Derek Barton und Odd Hassel teilten sich 1969 den Nobelpreis für Arbeiten zur Konformation von Cyclohexan und verschiedenen anderen Molekülen.
Verweise
Weiterführende Literatur
- Colin A. Russell, 1975, "Die Ursprünge der Konformationsanalyse", in Van 't Hoff-Le Bel Centennial, OB Ramsay, Ed. (ACS Symposium Series 12), Washington, DC: American Chemical Society, S. 159–178.
- William Reusch, 2010, "Ring Conformations" und "Substituted Cyclohexane Compounds", im virtuellen Lehrbuch für Organische Chemie, East Lansing, MI, USA: Michigan State University, siehe [2] und [3] , abgerufen am 20. Juni 2015.



