Enthalogenierung - Dehalogenation
In der organischen Chemie ist die Dehalogenierung eine Reihe von chemischen Reaktionen, die die Spaltung von C-Halogen-Bindungen beinhalten. Dehalogenierungen gibt es in vielen Varianten, einschließlich Defluorierung, Dechlorierung, Debromierung und Deiodierung. Anreize zur Untersuchung von Dehalogenierungen umfassen sowohl konstruktive als auch destruktive Ziele. Komplizierte organische Verbindungen wie Arzneimittel werden gelegentlich durch Dehalogenierung erzeugt. Viele Organohalogenide sind gefährlich, daher ist ihre Dehalogenierung ein Weg zu ihrer Entgiftung.
Wege
Die Entfernung eines Halogenatoms aus einem Organohalogenid erzeugt hochreaktive Radikale. Diese Tatsache hat mehrere Konsequenzen:
- Die Monodehalogenierung wird normalerweise von der Kupplung des resultierenden Radikals begleitet:
- 2 RX + 2 Li → RR + 2LiX
- wenn ein Paar von Halogeniden gegenseitig benachbart (vicinal) ist, wird ihre Entfernung begünstigt. Vicinale Alkyldihalogenide wandeln sich in Alkene um. Magnesium kann verwendet werden:
- R 2 C(X)C(X)R 2 + Mg → R 2 C=CR 2 + MgX 2
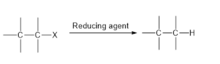
- Dehalogenierungen können durch Hydrogenolyse erfolgen , den Ersatz einer CX-Bindung durch eine CH-Bindung. Solche Reaktionen sind der Katalyse zugänglich:
- RX + H 2 → RH + HX
Fluorid vs. Chlorid vs. Bromid vs. Jodid
Die Geschwindigkeit der Enthalogenierung hängt von der Bindungsstärke zwischen Kohlenstoff und Halogenatom ab. Die Bindungsdissoziationsenergien von Kohlenstoff-Halogen-Bindungen werden wie folgt beschrieben: H 3 C-I (234 kJmol-1), H 3 C-Br (293 kJmol-1), H 3 C-Cl (351 kJmol-1) und H 3 CF (452 kJmol-1). Somit ist für die gleichen Strukturen die Bindungsdissoziationsgeschwindigkeit für die Dehalogenierung: F < Cl < Br < I. Außerdem variiert die Dehalogenierungsgeschwindigkeit für Alkylhalogenide auch mit der sterischen Umgebung und folgt diesem Trend: primäre > sekundäre > tertiäre Halogenide.
Anwendungen
Da Organochlorverbindungen die am häufigsten vorkommenden Organohalogenide sind, beinhalten die meisten Dehalogenierungen die Manipulation von C-Cl-Bindungen.
Alkali- und Erdalkalimetalle
Stark elektropositive Metalle reagieren mit vielen organischen Halogeniden in einem Metall-Halogen-Austausch :
- RX + 2 M → RM + MX
Die resultierende metallorganische Verbindung ist anfällig für Hydrolyse:
- RM + H 2 O → RH + M-OH
Intensiv untersuchte Beispiele finden sich in der Organolithium- und Organomagnesium-Chemie . Es folgen einige anschauliche Fälle.
Der Lithium-Halogen-Austausch bietet einen trivialen Weg zur Dehalogenierung. Natriummetall wurde für den Enthalogenierungsprozess verwendet. Die Entfernung von Halogenatomen aus Arenhalogeniden in Gegenwart von Grignard-Agens und Wasser zur Bildung einer neuen Verbindung ist als Grignard-Abbau bekannt. Die Dehalogenierung mit Grignard-Reagenzien ist ein zweistufiges Hydrodehalogenierungsverfahren. Die Reaktion beginnt mit der Bildung einer Alkyl/Aren-Magnesium-Halogen-Verbindung, gefolgt von der Zugabe einer Protonenquelle, um ein dehalogeniertes Produkt zu bilden. Egorov und seine Mitarbeiter haben über die Dehalogenierung von Benzylhalogeniden mit atomarem Magnesium im 3P-Zustand bei 600°C berichtet. Als Reaktionsprodukt wurden Toluol und Bi-Benzyle hergestellt. Morrison und seine Mitarbeiter berichteten auch über die Dehalogenierung organischer Halogenide durch Flash-Vakuumpyrolyse unter Verwendung von Magnesium.
Mit Übergangsmetallkomplexen
Viele niedervalente und elektronenreiche Übergangsmetalle bewirken eine stöchiometrische Dehalogenierung. Die Reaktion erlangt praktisches Interesse im Kontext der organischen Synthese, zB Cu-vermittelte Ullmann-Kupplung .
Beispiele finden sich bei Vanadium, Chrom, Mangan und Eisen und Kobalt. Vitamin B12 und Coenzym F430 waren in der Lage, Tetrachlorethen nacheinander zu Ethen zu dechlorieren, während Hämatin nachweislich Tetrachlorethen zu Vinylchlorid dechlorierte.
Jayant und seine Mitarbeiter entwickelten Zweiphasensysteme zur Dehalogenierung von Trichlorethenen. Das kinetische Modell sieht vor, dass der Reaktionsprozess in einer Phase stattfindet, während der Stoffaustausch zwischen zwei Phasen stattfindet.
Weiterlesen
- Gotpagar, J.; Grulke, E.; Bhattacharyya, D.; Reduktive Dehalogenierung von Trichlorethylen: kinetische Modelle und *Hetflejš, J.; Czakkoova, M.; Rericha, R.; Vcelak, J. Catalyzed dehalogenation of delor 103 by Natriumhydridoaluminat. Chemosphäre 2001, 44, 1521.
- Kagoshima, H.; Hashimoto, Y.; Oguro, D.; Kutsuna, T.; Saigo, K. Trophenylphosphin/Germanium(IV)chlorid-Kombination: Ein neues Mittel zur Reduktion von α-Bromcarbonsäurederivaten. Tetraeder, 1998, 39, 1203-1206