Entdeckung des Neutrons - Discovery of the neutron

Die Entdeckung des Neutrons und seiner Eigenschaften stand im Mittelpunkt der außergewöhnlichen Entwicklungen der Atomphysik in der ersten Hälfte des 20. Jahrhunderts. Anfang des Jahrhunderts entwickelte Ernest Rutherford ein grobes Modell des Atoms, basierend auf dem Goldfolien-Experiment von Hans Geiger und Ernest Marsden . In diesem Modell waren die Masse und die positive elektrische Ladung der Atome in einem sehr kleinen Kern konzentriert . Bis 1920 wurden chemische Isotope entdeckt, die Atommassen als (ungefähr) ganzzahlige Vielfache der Masse des Wasserstoffatoms bestimmt und die Ordnungszahl als Ladung des Atomkerns identifiziert. Während der 1920er Jahre wurde der Kern als zusammengesetzt aus Kombinationen von Protonen und Elektronen angesehen , den beiden damals bekannten Elementarteilchen, aber dieses Modell wies mehrere experimentelle und theoretische Widersprüche auf.
Die wesentliche Natur des Atomkerns wurde mit der Entdeckung des Neutrons durch James Chadwick im Jahr 1932 und der Feststellung, dass es sich um ein neues, vom Proton unterschiedenes Elementarteilchen handelt, festgestellt.
Das ungeladene Neutron wurde sofort als neues Mittel zur Untersuchung der Kernstruktur genutzt, was zu Entdeckungen wie der Bildung neuer radioaktiver Elemente durch Neutronenbestrahlung (1934) und der Spaltung von Uranatomen durch Neutronen (1938) führte. Die Entdeckung der Kernspaltung führte bis zum Ende des Zweiten Weltkriegs zur Entwicklung von Atomkraft und Atomwaffen . Sowohl das Proton als auch das Neutron galten bis in die 1960er Jahre als Elementarteilchen, als man feststellte, dass es sich um zusammengesetzte Teilchen aus Quarks handelte .
Entdeckung der Radioaktivität
Zu Beginn des 20. Jahrhunderts war die heftige Debatte um die Existenz von Atomen noch nicht beigelegt. Philosophen wie Ernst Mach und Wilhelm Ostwald leugneten die Existenz von Atomen und betrachteten sie als bequemes mathematisches Konstrukt, während Wissenschaftler wie Arnold Sommerfeld und Ludwig Boltzmann sahen, dass physikalische Theorien die Existenz von Atomen voraussetzen.
Radioaktivität wurde 1896 von dem französischen Wissenschaftler Henri Becquerel entdeckt , als er mit phosphoreszierenden Materialien arbeitete. Im Jahr 1898 Ernest Rutherford bei Cavendish Laboratory unterschied zwei Arten von Radioaktivität, Alphastrahlen und Beta - Strahlen , die sie in ihrer Fähigkeit unterscheiden zu durchdringen, oder auf Reisen in, gewöhnlichen Gegenständen oder Gas. Zwei Jahre später Paul Villard entdeckt Gamma - Strahlen, die besaßen noch mehr Kraft zu durchdringen. Diese Strahlungen wurden bald mit bekannten Teilchen identifiziert: 1902 wurde von Walter Kaufmann gezeigt, dass Betastrahlen Elektronen sind ; 1907 wurde von Rutherford und Thomas Royds gezeigt, dass Alphastrahlen Heliumionen sind ; und Gammastrahlen wurden gezeigt elektromagnetische Strahlung zu sein, das eine Form der ist Licht , durch Rutherford und Edward Andrade 1914 hatte diese Strahlungen als auch ausgehend von Atomen identifiziert worden ist , damit , sofern sie Hinweise auf Prozesse innerhalb Atome vorkommen. Umgekehrt wurden die Strahlungen auch als Werkzeuge erkannt, die in Streuexperimenten genutzt werden könnten, um das Innere von Atomen zu untersuchen.
Das Goldfolien-Experiment und die Entdeckung des Atomkerns
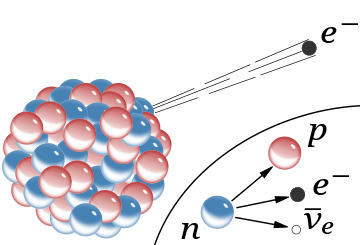
β−
Strahlung, die Emission eines schnellen Elektrons aus dem Kern (das begleitende Antineutrino entfällt). Im Rutherford-Modell für den Kern waren rote Kugeln Protonen mit positiver Ladung und blaue Kugeln waren Protonen, die fest an ein Elektron ohne Nettoladung gebunden waren.
Der Einschub zeigt den Betazerfall eines freien Neutrons, wie er heute verstanden wird; Dabei entstehen ein Elektron und ein Antineutrino.
An der University of Manchester zwischen 1908 und 1913 leitete Rutherford Hans Geiger und Ernest Marsden in einer Reihe von Experimenten, um zu bestimmen, was passiert, wenn Alphateilchen von Metallfolien gestreut werden . Diese Messungen, die jetzt Rutherford-Goldfolien-Experiment oder Geiger-Marsden-Experiment genannt werden, machten die außergewöhnliche Entdeckung, dass Alphateilchen gelegentlich in einem hohen Winkel streuen , wenn sie eine dünne Goldfolie passieren. Die Streuung zeigte, dass die Alphateilchen von einer kleinen, aber dichten Atomkomponente abgelenkt wurden. Aufgrund dieser Messungen war Rutherford bis 1911 klar, dass das Atom aus einem kleinen massiven Kern mit positiver Ladung bestand, der von einer viel größeren Wolke negativ geladener Elektronen umgeben war . Die konzentrierte Atommasse war erforderlich, um die beobachtete Ablenkung der Alphateilchen bereitzustellen, und Rutherford entwickelte ein mathematisches Modell, das die Streuung berücksichtigte.
Das Rutherford-Modell war sehr einflussreich, motivierte 1913 das Bohr-Modell für Elektronen, die den Kern umkreisen, und führte schließlich Mitte der 1920er Jahre zur Quantenmechanik .
Entdeckung von Isotopen
Parallel zu den Arbeiten von Rutherford, Geiger und Marsden untersuchte der Radiochemiker Frederick Soddy an der University of Glasgow chemiebezogene Probleme radioaktiver Materialien. Soddy hatte mit Rutherford an der McGill University über Radioaktivität zusammengearbeitet . Bis 1910 wurden zwischen Uran und Blei etwa 40 verschiedene radioaktive Elemente identifiziert , die als Radioelemente bezeichnet werden , obwohl das Periodensystem nur 11 Elemente zuließ. Soddy und Kazimierz Fajans fanden 1913 unabhängig voneinander heraus, dass ein Element, das einen Alpha-Zerfall durchmacht, ein Element zwei Stellen links im Periodensystem erzeugt und ein Element, das einen Beta-Zerfall durchmacht, ein Element eine Stelle rechts im Periodensystem erzeugt. Außerdem sind die Radioelemente, die sich an denselben Stellen im Periodensystem befinden, chemisch identisch. Soddy nannte diese chemisch identischen Elemente Isotope . Für sein Studium der Radioaktivität und die Entdeckung von Isotopen erhielt Soddy 1921 den Nobelpreis für Chemie.
Aufbauend auf Arbeiten von JJ Thomson über die Ablenkung positiv geladener Atome durch elektrische und magnetische Felder baute Francis Aston 1919 am Cavendish Laboratory den ersten Massenspektrographen . Sein Ziel, das er leicht erreichte, war die Trennung der beiden Isotope von Neon .20
Ne
und 22
Ne
. Aston entdeckte, dass die Massen aller Teilchen ganze Zahlen sind ( Ganzzahlregel ): Das heißt, die Massen aller Isotope sind ganzzahlige Vielfache der Masse des Wasserstoffatoms . Bei diesen Messungen berechnete Aston willkürlich seine Massen relativ zu Sauerstoff-16 , von denen er eine Masse von genau 16 annahm. (Heute ist die atomare Masseneinheit (amu) relativ zu Kohlenstoff-12 .) Ironischerweise die einzige Ausnahme davon Regel war Wasserstoff selbst, der einen Massenwert von 1,008 hatte. Die überschüssige Masse war klein, aber weit außerhalb der Grenzen der experimentellen Unsicherheit. Aston und andere erkannten schnell, dass die Diskrepanz auf die Bindungsenergie der Atome zurückzuführen ist, dh die Masse einer Anzahl von Wasserstoffatomen, die zu einem einzigen Atom gebunden sind, muss kleiner sein als die Summe der Massen der einzelnen Wasserstoffatome. Astons Arbeiten über Isotope brachten ihm 1922 den Nobelpreis für Chemie für die Entdeckung von Isotopen in einer großen Zahl nicht radioaktiver Elemente und für seine Erklärung der Ganzzahlregel ein. Unter Hinweis auf Astons jüngste Entdeckung der nuklearen Bindungsenergie schlug Arthur Eddington 1920 vor, dass Sterne ihre Energie durch Fusion von Wasserstoff (Protonen) zu Helium gewinnen könnten und dass sich die schwereren Elemente in Sternen bilden könnten.
Ordnungszahl und Gesetz von Moseley
Rutherford und andere hatten die Diskrepanz zwischen der Masse eines Atoms, berechnet in atomaren Masseneinheiten, und der ungefähren Ladung festgestellt, die der Kern benötigt, damit das Rutherford-Modell funktioniert. Die erforderliche Ladung des Atomkerns betrug normalerweise etwa die Hälfte seiner Atommasse. Antonius van den Broek stellte kühn die Hypothese auf, dass die erforderliche Ladung, die mit Z bezeichnet wird , nicht die Hälfte des Atomgewichts für Elemente beträgt, sondern genau der Ordnungsposition des Elements im Periodensystem entspricht . Zu dieser Zeit war den Positionen der Elemente im Periodensystem keine physikalische Bedeutung bekannt. Wenn die Elemente jedoch nach zunehmender Atommasse geordnet wurden, zeigte sich eine Periodizität der chemischen Eigenschaften. Es gab jedoch Ausnahmen von dieser Periodizität, wie etwa Kobalt und Nickel.
An der Universität von Manchester diskutierte Henry Moseley 1913 mit den besuchenden Bohr das neue Bohrsche Atommodell. Das Modell berücksichtigte das elektromagnetische Emissionsspektrum des Wasserstoffatoms, und Moseley und Bohr fragten sich, ob die elektromagnetischen Emissionsspektren schwererer Elemente wie Kobalt und Nickel ihrer Gewichtsordnung oder ihrer Position im Periodensystem folgen würden. In den Jahren 1913-1914 testete Moseley die Frage experimentell unter Verwendung von Röntgenbeugungstechniken . Er fand heraus, dass die intensivste kurzwellige Linie im Röntgenspektrum eines bestimmten Elements, die als K-Alpha- Linie bekannt ist, mit der Position des Elements im Periodensystem, dh seiner Ordnungszahl Z, zusammenhängt . Tatsächlich hat Moseley diese Nomenklatur eingeführt. Moseley fand heraus, dass die Frequenzen der Strahlung für eine Vielzahl von Elementen auf einfache Weise mit der Ordnungszahl der Elemente in Beziehung stehen.
Innerhalb eines Jahres wurde festgestellt, dass die Gleichung für die Beziehung, die jetzt als Moseley-Gesetz bezeichnet wird , mit dem Bohrmodell von 1913 erklärt werden konnte, mit vernünftigen zusätzlichen Annahmen über die Atomstruktur in anderen Elementen. Moseleys Ergebnis begründete nach Bohrs späterer Darstellung nicht nur die Ordnungszahl als messbare experimentelle Größe, sondern gab ihr auch eine physikalische Bedeutung als positive Ladung des Atomkerns. Die Elemente könnten im Periodensystem nach der Ordnungszahl statt nach dem Atomgewicht geordnet werden . Das Ergebnis verband die Organisation des Periodensystems, das Bohr-Modell für das Atom und das Rutherford-Modell für die Alpha-Streuung von Kernen. Es wurde von Rutherford, Bohr und anderen als entscheidender Fortschritt beim Verständnis der Natur des Atomkerns zitiert.
Die weitere Forschung in der Atomphysik wurde durch den Ausbruch des Ersten Weltkriegs unterbrochen . Moseley wurde 1915 in der Schlacht von Gallipoli getötet , während Rutherfords Schüler James Chadwick für die Dauer des Krieges 1914-1918 in Deutschland interniert war. In Berlin wurden die Forschungsarbeiten von Lise Meitner und Otto Hahn zur Bestimmung der radioaktiven Zerfallsketten von Radium und Uran durch präzise chemische Trennung unterbrochen. Meitner verbrachte einen Großteil des Krieges als Radiologe und medizinischer Röntgentechniker in der Nähe der österreichischen Front, während Hahn, ein Chemiker , an der Forschung zum Giftgaskrieg arbeitete .
Rutherford-Atom
1920 hielt Rutherford einen Bakerian-Vortrag an der Royal Society mit dem Titel "Nuclear Constitution of Atoms", eine Zusammenfassung der jüngsten Experimente an Atomkernen und Schlussfolgerungen über die Struktur von Atomkernen. Um 1920 wurde die Existenz von Elektronen im Atomkern weithin angenommen. Es wurde angenommen, dass der Kern aus Wasserstoffkernen besteht, deren Anzahl der Atommasse entspricht. Da jedoch jeder Wasserstoffkern eine Ladung von +1 hatte, benötigte der Kern eine geringere Anzahl von "inneren Elektronen" mit einer Ladung von jeweils -1, um dem Kern seine korrekte Gesamtladung zu verleihen. Die Masse der Protonen ist etwa 1800-mal größer als die der Elektronen, daher ist die Masse der Elektronen bei dieser Berechnung zufällig. Ein solches Modell stimmte mit der Streuung von Alphateilchen an schweren Kernen sowie der Ladung und Masse der vielen identifizierten Isotope überein. Es gab andere Motivationen für das Proton-Elektronen-Modell. Wie Rutherford damals feststellte, "haben wir starken Grund zu der Annahme, dass die Kerne von Atomen sowohl Elektronen als auch positiv geladene Körper enthalten ...", nämlich war bekannt, dass Betastrahlung vom Kern emittierte Elektronen war.
In diesem Vortrag vermutete Rutherford die Existenz neuer Teilchen. Es war bekannt, dass das Alpha-Teilchen sehr stabil ist, und es wurde angenommen, dass es seine Identität innerhalb des Kerns beibehält. Es wurde angenommen, dass das Alpha-Teilchen aus vier Protonen und zwei eng gebundenen Elektronen besteht, um ihm eine Ladung von +2 und eine Masse von 4 zu verleihen. interpretiert als aus drei Protonen und einem eng gebundenen Elektron bestehen. Dieses Ergebnis legte Rutherford die wahrscheinliche Existenz zweier neuer Teilchen nahe: eines von zwei Protonen mit einem eng gebundenen Elektron und ein anderes von einem Proton und einem eng gebundenen Elektron. Später wurde festgestellt, dass das X++-Teilchen die Masse 4 hat und nur ein niederenergetisches Alpha-Teilchen ist. Dennoch vermutete Rutherford die Existenz des Deuterons, eines Teilchens mit +1-Ladung der Masse 2, und des Neutrons, eines neutralen Teilchens der Masse 1. Ersteres ist der Deuteriumkern , der 1931 von Harold Urey entdeckt wurde . Die Masse des hypothetischen neutralen Teilchens würde sich kaum von der des Protons unterscheiden. Rutherford stellte fest, dass ein solches ladungsfreies Teilchen mit den verfügbaren Techniken schwer zu erkennen wäre.
Bis 1921 hatten Rutherford und William Harkins unabhängig voneinander das ungeladene Teilchen Neutron genannt , während ungefähr zur gleichen Zeit das Wort Proton für den Wasserstoffkern verwendet wurde. Neutron wurde offenbar aus der lateinischen Wurzel für neutral und der griechischen Endung -on (durch Nachahmung von Elektron und Proton ) konstruiert . Hinweise auf das Wort Neutron im Zusammenhang mit dem Atom finden sich jedoch bereits 1899 in der Literatur.
Rutherford und Chadwick begannen sofort ein experimentelles Programm am Cavendish Laboratory in Cambridge , um nach dem Neutron zu suchen. Die Experimente wurden in den 1920er Jahren ohne Erfolg fortgesetzt.
Rutherfords Vermutung wurde nicht allgemein akzeptiert. In seiner 1931 Monographie über die Verfassung von Atomkernen und Radioaktivität , George Gamow , dann am Institut für Theoretische Physik in Kopenhagen, nicht erwähnt , das Neutron. Zum Zeitpunkt ihrer Messungen im Jahr 1932 in Paris, die zur Entdeckung des Neutrons führten, wussten Irène Joliot-Curie und Frédéric Joliot nichts von der Vermutung.
Probleme der Kernelektronenhypothese
In den 1920er Jahren gingen Physiker davon aus, dass der Atomkern aus Protonen und "Kernelektronen" besteht. Unter dieser Hypothese würde der Stickstoff-14 ( 14 N)-Kern aus 14 Protonen und 7 Elektronen bestehen, so dass er eine Nettoladung von +7 Elementarladungseinheiten und eine Masse von 14 atomaren Masseneinheiten hätte. Dieser Kern würde auch von weiteren 7 Elektronen, von Rutherford als "externe Elektronen" bezeichnet, umkreist, um das 14 N-Atom zu vervollständigen . Allerdings traten bald Probleme mit der Hypothese auf.
Ralph Kronig wies 1926 darauf hin, dass die beobachtete Hyperfeinstruktur von Atomspektren nicht mit der Proton-Elektron-Hypothese übereinstimmt. Diese Struktur wird durch den Einfluss des Kerns auf die Dynamik der umlaufenden Elektronen verursacht. Die magnetischen Momente vermeintlicher "Kernelektronen" sollten hyperfeine Spektrallinienaufspaltungen ähnlich dem Zeeman-Effekt erzeugen , aber solche Effekte wurden nicht beobachtet. Es schien, dass das magnetische Moment des Elektrons verschwand, wenn es sich im Kern befand.
Bei einem Besuch der Universität Utrecht im Jahr 1928 erfuhr Kronig von einem überraschenden Aspekt des Rotationsspektrums von N 2 + . Die Präzisionsmessung von Leonard Ornstein , dem Direktor des physikalischen Labors in Utrecht, ergab, dass der Spin des Stickstoffkerns gleich eins sein muss. Wenn jedoch der Stickstoff-14 ( 14 N)-Kern aus 14 Protonen und 7 Elektronen besteht, einer ungeraden Anzahl von Spin-1/2-Teilchen, dann sollte der resultierende Kernspin eine halbe ganze Zahl sein. Kronig schlug daher vor, dass vielleicht "Protonen und Elektronen ihre Identität nicht in dem Maße behalten, wie sie es außerhalb des Kerns tun".
Beobachtungen der Rotationsenergieniveaus von zweiatomigen Molekülen mit Raman-Spektroskopie von Franco Rasetti im Jahr 1929 stimmten nicht mit den von der Proton-Elektron-Hypothese erwarteten Statistiken überein. Rasetti erhielt Bandenspektren für H 2 - und N 2 -Moleküle. Während die Linien für beide zweiatomigen Moleküle einen Intensitätswechsel zwischen hell und dunkel zeigten, ist das Wechselmuster für H 2 dem von N 2 entgegengesetzt . Nach sorgfältiger Analyse dieser experimentellen Ergebnisse zeigten die deutschen Physiker Walter Heitler und Gerhard Herzberg , dass die Wasserstoffkerne der Fermi-Statistik und die Stickstoffkerne der Bose-Statistik gehorchen. Ein damals unveröffentlichtes Ergebnis von Eugene Wigner zeigte jedoch, dass ein zusammengesetztes System mit einer ungeraden Anzahl von Spin-1/2-Teilchen der Fermi-Statistik gehorchen muss; ein System mit einer geraden Anzahl von Spin-1/2-Teilchen gehorcht der Bose-Statistik. Wenn der Stickstoffkern 21 Teilchen hätte, sollte er entgegen der Tatsache der Fermi-Statistik gehorchen. So schlussfolgerten Heitler und Herzberg: "Das Elektron im Kern ... verliert seine Fähigkeit, die Statistik des Kerns zu bestimmen."
Das 1928 von Oskar Klein entdeckte Klein-Paradoxon brachte weitere quantenmechanische Einwände gegen die Vorstellung eines in einem Kern eingeschlossenen Elektrons. Abgeleitet von der Dirac-Gleichung legt dieses klare und präzise Paradoxon nahe, dass ein Elektron, das sich einer hohen Potentialbarriere nähert, eine hohe Wahrscheinlichkeit hat, die Barriere durch einen Paarbildungsprozess zu passieren . Anscheinend konnte ein Elektron nicht durch einen Potentialtopf innerhalb eines Kerns eingeschlossen werden. Die Bedeutung dieses Paradoxons wurde damals intensiv diskutiert.
Um 1930 wurde allgemein anerkannt, dass es schwierig war, das Proton-Elektronen-Modell für Kerne mit der Heisenbergschen Unschärferelation der Quantenmechanik in Einklang zu bringen . Diese Beziehung, Δ x ⋅Δ p ≥ 1 / 2 ħ impliziert, dass ein Elektron von der Größe eines Atomkerns auf einen Bereich beschränkt typischerweise eine kinetische Energie von nicht weniger als 40 MeV, die größer ist als die beobachtete Energie der Beta - Teilchen emittiert aus dem Kern. Diese Energie ist auch viel größer als die Bindungsenergie von Nukleonen, die Aston und andere mit weniger als 9 MeV pro Nukleon gezeigt hatten.
1927 maßen Charles Ellis und W. Wooster vom Cavendish Laboratory die Energien von β-Zerfallselektronen. Sie fanden heraus, dass die Energieverteilung jedes einzelnen radioaktiven Kerns breit und kontinuierlich war, ein Ergebnis, das in besonderem Kontrast zu den unterschiedlichen Energiewerten stand, die beim Alpha- und Gammazerfall beobachtet wurden. Außerdem schien die kontinuierliche Energieverteilung darauf hinzudeuten, dass die Energie durch diesen "Kernelektronen"-Prozess nicht erhalten wurde. Tatsächlich schlug Bohr 1929 vor, das Energieerhaltungsgesetz zu modifizieren, um die kontinuierliche Energieverteilung zu berücksichtigen. Der Vorschlag fand die Unterstützung von Werner Heisenberg. Solche Überlegungen waren offenbar insofern vernünftig, als die Gesetze der Quantenmechanik erst vor kurzem die Gesetze der klassischen Mechanik gekippt hatten.
Obwohl all diese Überlegungen nicht "bewiesen", dass ein Elektron im Kern nicht existieren kann, waren sie für Physiker verwirrend und schwierig zu interpretieren. Viele Theorien wurden erfunden, um zu erklären, wie die obigen Argumente falsch sein könnten. In seiner Monographie von 1931 fasste Gamow all diese Widersprüche zusammen und markierte die Aussagen zu den Elektronen im Kern mit Warnsymbolen.
Entdeckung des Neutrons
1930 fanden Walther Bothe und Herbert Becker in Gießen heraus , dass, wenn die von Polonium emittierten energiereichen Alphateilchen auf bestimmte leichte Elemente, insbesondere Beryllium (9
4Sei
), Bor (11
5B
) oder Lithium (7
3Li
) wurde eine ungewöhnlich durchdringende Strahlung erzeugt. Beryllium erzeugte die stärkste Strahlung. Polonium ist hochradioaktiv, erzeugt energiereiche Alphastrahlung und wurde damals häufig für Streuexperimente verwendet. Alphastrahlung kann durch ein elektrisches Feld beeinflusst werden, da sie aus geladenen Teilchen besteht. Die beobachtete durchdringende Strahlung wurde jedoch nicht durch ein elektrisches Feld beeinflusst, so dass es sich um Gammastrahlung handelte . Die Strahlung war durchdringender als alle bekannten Gammastrahlen, und die Details der experimentellen Ergebnisse waren schwer zu interpretieren.

Zwei Jahre später zeigten Irène Joliot-Curie und Frédéric Joliot in Paris, dass, wenn diese unbekannte Strahlung auf Paraffinwachs oder eine andere wasserstoffhaltige Verbindung fiel, Protonen mit sehr hoher Energie (5 MeV) ausgestoßen wurden. Diese Beobachtung war an sich nicht unvereinbar mit der angenommenen Gammastrahlen-Natur der neuen Strahlung, aber diese Interpretation ( Compton-Streuung ) hatte ein logisches Problem. Aus Energie- und Impulsüberlegungen müsste ein Gammastrahl eine unglaublich hohe Energie (50 MeV) haben, um ein massives Proton zu streuen. In Rom erklärte der junge Physiker Ettore Majorana , dass die Art und Weise, wie die neue Strahlung mit Protonen wechselwirkt, ein neues neutrales Teilchen erfordert.
Als sie von den Pariser Ergebnissen hörten, glaubten weder Rutherford noch James Chadwick vom Cavendish Laboratory an die Gammastrahlen-Hypothese. Mit Unterstützung von Norman Feather führte Chadwick schnell eine Reihe von Experimenten durch, die zeigten, dass die Gammastrahlen-Hypothese unhaltbar war. Im Vorjahr hatten Chadwick, JER Constable und EC Pollard bereits Experimente zum Zerfall leichter Elemente mit Alphastrahlung aus Polonium durchgeführt. Sie hatten auch genauere und effizientere Methoden zum Nachweis, Zählen und Aufzeichnen der ausgestoßenen Protonen entwickelt. Chadwick wiederholte die Erzeugung der Strahlung mit Beryllium, um die Alphateilchen zu absorbieren: 9 Be + 4 He (α) → 12 C + 1 n. Nach dem Pariser Experiment richtete er die Strahlung auf Paraffinwachs, einen Kohlenwasserstoff mit hohem Wasserstoffgehalt, und bot damit ein protonendichtes Ziel. Wie beim Pariser Experiment streute die Strahlung einige der Protonen energetisch. Chadwick maß die Reichweite dieser Protonen und maß auch, wie die neue Strahlung auf die Atome verschiedener Gase einwirkte. Er fand heraus, dass die neue Strahlung nicht aus Gammastrahlen besteht, sondern aus ungeladenen Teilchen mit etwa der gleichen Masse wie das Proton . Diese Teilchen waren Neutronen. Für diese Entdeckung erhielt Chadwick 1935 den Nobelpreis für Physik .
Das Jahr 1932 wurde später im Cavendish Laboratory als „ annus mirabilis “ für die Kernphysik bezeichnet, mit Entdeckungen des Neutrons, des künstlichen Kernzerfalls durch den Cockcroft-Walton-Teilchenbeschleuniger und des Positrons .
Proton-Neutronen-Modell des Kerns
Angesichts der Probleme des Proton-Elektronen-Modells wurde schnell akzeptiert, dass der Atomkern aus Protonen und Neutronen besteht, obwohl die genaue Natur des Neutrons zunächst unklar war. Innerhalb weniger Monate nach der Entdeckung des Neutrons hatten Werner Heisenberg und Dmitri Ivanenko Proton-Neutronen-Modelle für den Kern vorgeschlagen. Heisenbergs wegweisende Arbeiten näherten sich der Beschreibung von Protonen und Neutronen im Kern durch die Quantenmechanik. Während Heisenbergs Theorie für Protonen und Neutronen im Kern ein "großer Schritt zum Verständnis des Kerns als quantenmechanisches System" war, ging er dennoch von der Anwesenheit von Kernelektronen aus. Insbesondere ging Heisenberg davon aus, dass das Neutron ein Proton-Elektron-Verbund sei, für den es keine quantenmechanische Erklärung gibt. Heisenberg hatte keine Erklärung dafür, wie leichtgewichtige Elektronen im Kern gebunden werden könnten. Heisenberg führte die erste Theorie der Kernaustauschkräfte ein, die die Nukleonen binden. Er betrachtete Protonen und Neutronen als verschiedene Quantenzustände desselben Teilchens, dh Nukleonen, die sich durch den Wert ihrer nuklearen Isospin- Quantenzahlen unterscheiden.
Das Proton-Neutron-Modell erklärte das Rätsel um Distickstoff. Als vorgeschlagen wurde, 14 N aus jeweils 3 Paaren von Protonen und Neutronen zu bestehen, wobei ein zusätzliches ungepaartes Neutron und Proton jeweils einen Spin von 1 ⁄ 2 ħ in die gleiche Richtung bei einem Gesamtspin von 1 beisteuerten, wurde das Modell tragfähig. Bald wurden Neutronen verwendet, um auf natürliche Weise Spinunterschiede in vielen verschiedenen Nukliden auf die gleiche Weise zu erklären.
Wenn das Proton-Neutronen-Modell für den Kern viele Probleme löste, zeigte es das Problem der Erklärung der Ursprünge der Betastrahlung. Keine existierende Theorie konnte erklären, wie Elektronen oder Positronen aus dem Kern austreten könnten. 1934 veröffentlichte Enrico Fermi seine klassische Arbeit, die den Prozess des Beta-Zerfalls beschreibt , bei dem das Neutron in ein Proton zerfällt, indem ein Elektron und ein (noch unentdecktes) Neutrino erzeugt werden . Das Papier verwendete die Analogie, dass Photonen oder elektromagnetische Strahlung in ähnlicher Weise in atomaren Prozessen erzeugt und zerstört werden. Ivanenko hatte 1932 eine ähnliche Analogie vorgeschlagen. Fermis Theorie verlangt, dass das Neutron ein Spin- 1 ⁄ 2- Teilchen ist. Die Theorie bewahrte den Energieerhaltungssatz, der durch die kontinuierliche Energieverteilung von Betateilchen in Frage gestellt worden war. Die von Fermi vorgeschlagene grundlegende Theorie zum Betazerfall war die erste, die zeigte, wie Teilchen erzeugt und zerstört werden können. Es stellte eine allgemeine, grundlegende Theorie für die Wechselwirkung von Teilchen durch schwache oder starke Kräfte auf. Obwohl sich dieses einflussreiche Papier bewährt hat, waren die darin enthaltenen Ideen so neu, dass es bei seiner ersten Einreichung bei der Zeitschrift Nature im Jahr 1933 als zu spekulativ abgelehnt wurde.
Die Natur des Neutrons
Die Frage, ob das Neutron ein zusammengesetztes Teilchen aus einem Proton und einem Elektron sei, blieb nach seiner Entdeckung noch einige Jahre bestehen. 1932 erforschte Harrie Massey ein Modell für ein zusammengesetztes Neutron, um beispielsweise seine große Durchdringungskraft durch Materie und seine elektrische Neutralität zu erklären. Das Problem war ein Erbe der vorherrschenden Ansicht aus den 1920er Jahren, dass die einzigen Elementarteilchen das Proton und das Elektron seien.
Die Natur des Neutrons war ein Hauptthema der Diskussion auf der 7. Solvay-Konferenz im Oktober 1933, an der Heisenberg, Niels Bohr , Lise Meitner , Ernest Lawrence , Fermi, Chadwick und andere teilnahmen. Wie Chadwick 1933 in seiner Bakerian Lecture stellte , war die Hauptfrage die Masse des Neutrons im Verhältnis zum Proton. Wenn die Masse des Neutrons kleiner ist als die kombinierten Massen eines Protons und eines Elektrons (1,0078 u ), dann könnte das Neutron ein Proton-Elektronen zusammengesetzt sein , weil der Massendefekt aus der Kernbindungsenergie . Wenn größer als die kombinierten Massen, dann war das Neutron wie das Proton elementar. Die Frage war schwierig zu beantworten, da die Masse des Elektrons nur 0,05% der des Protons beträgt und daher außergewöhnlich genaue Messungen erforderlich waren.
Wie schwierig die Messung ist, verdeutlichen die weiten Werte für die Masse des Neutrons von 1932 bis 1934. Der heute akzeptierte Wert ist 1.008 66 u . In Chadwicks Aufsatz aus dem Jahr 1932, in dem er über die Entdeckung berichtete, schätzte er die Masse des Neutrons auf zwischen1,005 u und1.008 u . Frédéric und Irène Joliot-Curie erzielten durch Beschuss von Bor mit Alphateilchen einen hohen Wert von1,012 u , während Ernest Lawrences Team von der University of California den kleinen Wert gemessen hat1.0006 u mit ihrem neuen Zyklotron .
1935 lösten Chadwick und sein Doktorand Maurice Goldhaber das Problem, indem sie über die erste genaue Messung der Neutronenmasse berichteten. Sie verwendeten das 2,6 MeV Gammastrahlen von Thallium -208 ( 208 Tl) (anschließend als bekannt Thorium C“ ) photodisintegrate Deuteron
Bei dieser Reaktion haben Proton und Neutron ungefähr die gleiche kinetische Energie, da ihre Massen ungefähr gleich sind. Die kinetische Energie des resultierenden Protons konnte gemessen werden (0,24 MeV), und damit konnte die Bindungsenergie des Deuterons bestimmt werden (2,6 MeV − 2(0,24 MeV) = 2,1 MeV, oder0,0023 u ). Die Masse des Neutrons könnte dann durch die einfache Massenbilanz bestimmt werden
m d + Sein = m p + m n
wobei m d,p,n sich auf die Deuteron-, Proton- oder Neutronenmasse bezieht und "be" die Bindungsenergie ist. Die Massen von Deuteron und Proton waren bekannt; Chadwick und Goldhaber verwendeten Werte von 2.0142 u bzw. 1.0081 u. Sie fanden heraus, dass die Masse des Neutrons etwas größer war als die des Protons1.0084 u oder1,0090 u , abhängig vom genauen Wert der Deuteronmasse. Die Masse des Neutrons war zu groß, um ein Proton-Elektron-Komposit zu sein, und das Neutron wurde daher als Elementarteilchen identifiziert. Chadwick und Goldhaber sagten voraus, dass ein freies Neutron in ein Proton, Elektron und Neutrino zerfallen kann ( Beta-Zerfall ).
Neutronenphysik in den 1930er Jahren
Kurz nach der Entdeckung des Neutrons deuteten indirekte Beweise darauf hin, dass das Neutron einen unerwarteten Wert ungleich Null für sein magnetisches Moment hatte. Versuche, das magnetische Moment des Neutrons zu messen, gehen auf die Entdeckung von Otto Stern 1933 in Hamburg zurück, dass das Proton ein ungewöhnlich großes magnetisches Moment besitzt. Bis 1934 hatten Gruppen unter der Leitung von Stern, jetzt in Pittsburgh , und II Rabi in New York, unabhängig davon abgeleitet, dass das magnetische Moment des Neutrons negativ und unerwartet groß war, indem sie die magnetischen Momente des Protons und Deuterons maßen . Werte für das magnetische Moment des Neutrons wurden auch von Robert Bacher (1933) in Ann Arbor und IY Tamm und SA Altshuler (1934) in der Sowjetunion aus Untersuchungen der Hyperfeinstruktur von Atomspektren bestimmt. Bis Ende der 1930er Jahre hatte die Rabi-Gruppe genaue Werte für das magnetische Moment des Neutrons durch Messungen mit neu entwickelten Kernspinresonanztechniken abgeleitet . Der große Wert für das magnetische Moment des Protons und der abgeleitete negative Wert für das magnetische Moment des Neutrons waren unerwartet und wirft viele Fragen auf.

Die Entdeckung des Neutrons gab den Wissenschaftlern sofort ein neues Werkzeug, um die Eigenschaften von Atomkernen zu untersuchen. Alpha-Teilchen wurden in den vergangenen Jahrzehnten in Streuexperimenten verwendet, aber solche Teilchen, die Heliumkerne sind, haben eine Ladung von +2. Diese Ladung erschwert es Alpha-Teilchen, die Coulomb-Abstoßungskraft zu überwinden und direkt mit den Atomkernen zu interagieren. Da Neutronen keine elektrische Ladung haben, müssen sie diese Kraft nicht überwinden, um mit Kernen zu interagieren. Fast zeitgleich mit seiner Entdeckung wurden Neutronen von Norman Feather , Chadwicks Kollege und Schützling, in Streuexperimenten mit Stickstoff verwendet. Feather konnte zeigen, dass Neutronen, die mit Stickstoffkernen wechselwirken, an Protonen gestreut werden oder Stickstoff dazu bringen, sich unter Bildung von Bor unter Emission eines Alphateilchens aufzulösen. Feather war daher der erste, der zeigte, dass Neutronen Kernzerfälle erzeugen.
In Rom beschossen Enrico Fermi und sein Team schwerere Elemente mit Neutronen und stellten fest, dass die Produkte radioaktiv waren. Bis 1934 hatten sie Neutronen verwendet, um in 22 verschiedenen Elementen Radioaktivität zu induzieren, viele dieser Elemente mit hoher Ordnungszahl. Als Fermi bemerkte, dass andere Experimente mit Neutronen in seinem Labor auf einem Holztisch besser zu funktionieren schienen als auf einem Marmortisch, vermutete Fermi, dass die Protonen des Holzes die Neutronen verlangsamten und so die Chance für die Neutronen, mit Kernen zu interagieren, erhöhten. Fermi leitete daher Neutronen durch Paraffinwachs, um sie zu verlangsamen, und stellte fest, dass die Radioaktivität einiger beschossener Elemente um das Zehn- bis Hundertfache anstieg. Der Wirkungsquerschnitt für die Wechselwirkung mit Kernen ist bei langsamen Neutronen viel größer als bei schnellen Neutronen. 1938 erhielt Fermi den Nobelpreis für Physik "für seine Demonstrationen der Existenz neuer radioaktiver Elemente, die durch Neutronenbestrahlung erzeugt werden, und für seine damit verbundene Entdeckung von Kernreaktionen, die durch langsame Neutronen hervorgerufen werden" .
In Berlin förderte die Zusammenarbeit von Lise Meitner und Otto Hahn zusammen mit ihrem Assistenten Fritz Strassmann die von Fermi und seinem Team begonnene Forschung, als sie Uran mit Neutronen beschossen. Zwischen 1934 und 1938 fanden Hahn, Meitner und Strassmann bei diesen Experimenten eine große Anzahl radioaktiver Transmutationsprodukte, die sie alle als transuran ansahen . Transurane Nuklide sind solche mit einer Ordnungszahl größer als Uran (92), die durch Neutronenabsorption gebildet werden; solche Nuklide kommen in der Natur nicht vor. Im Juli 1938 musste Meitner nach dem Anschluss im nationalsozialistischen Deutschland der antisemitischen Verfolgung entkommen und konnte sich eine neue Stelle in Schweden sichern. Das entscheidende Experiment am 16.-17. Dezember 1938 (mit einem chemischen Verfahren namens "Radium-Barium-Mesothorium- Fraktionierung ") brachte rätselhafte Ergebnisse: Was sie als drei Isotope des Radiums verstanden hatten, verhielten sich stattdessen konsequent als Barium . Radium (Ordnungszahl 88) und Barium (Ordnungszahl 56) gehören zur gleichen chemischen Gruppe . Im Januar 1939 kam Hahn zu dem Schluss, dass es sich bei dem, was sie für transuranische Nuklide hielten, um viel leichtere Nuklide handelte, wie Barium, Lanthan , Cer und leichte Platinoide . Meitner und ihr Neffe Otto Frisch interpretierten diese Beobachtungen sofort und richtig als Folge der Kernspaltung , einem von Frisch geprägten Begriff.
Hahn und seine Mitarbeiter hatten die Aufspaltung von Urankernen, die durch Neutronenabsorption instabil gemacht wurden, in leichtere Elemente entdeckt. Meitner und Frisch zeigten auch, dass bei der Spaltung jedes Uranatoms etwa 200 MeV Energie freigesetzt werden. Die Entdeckung der Kernspaltung elektrisierte die weltweite Gemeinschaft der Atomphysiker und die Öffentlichkeit. In ihrer zweiten Veröffentlichung zur Kernspaltung sagten Hahn und Strassmann die Existenz und Freisetzung zusätzlicher Neutronen während des Spaltprozesses voraus. Frédéric Joliot und sein Team wiesen dieses Phänomen im März 1939 als Kettenreaktion nach. 1945 erhielt Hahn 1944 den Nobelpreis für Chemie "für seine Entdeckung der Spaltung schwerer Atomkerne".
Nach 1939
Die Entdeckung der Kernspaltung Ende 1938 markierte eine Verlagerung der Zentren der Kernforschung von Europa in die USA. Eine große Zahl von Wissenschaftlern wanderte in die Vereinigten Staaten aus, um den Unruhen und dem Antisemitismus in Europa und dem drohenden Krieg zu entkommen (Siehe Jüdische Wissenschaftler und das Manhattan-Projekt ). Die neuen Zentren der Kernforschung waren die Universitäten in den Vereinigten Staaten, insbesondere die Columbia University in New York und die University of Chicago, wohin Enrico Fermi umgezogen war, und eine 1942 gegründete geheime Forschungseinrichtung in Los Alamos , New Mexico , die neue Heimat des Manhattan-Projekts . Dieses Kriegsprojekt konzentrierte sich auf den Bau von Atomwaffen und nutzte die enorme Energie, die bei der Spaltung von Uran oder Plutonium durch neutronenbasierte Kettenreaktionen freigesetzt wird.
Die Entdeckungen des Neutrons und Positrons im Jahr 1932 waren der Beginn der Entdeckung vieler neuer Teilchen. Myonen wurden 1936 entdeckt. Pionen und Kaonen wurden 1947 entdeckt, während Lambda-Teilchen 1950 entdeckt wurden. In den 1950er und 1960er Jahren wurde eine große Anzahl von Teilchen entdeckt, die Hadronen genannt werden . Ein Klassifikationsschema zur Organisation all dieser Teilchen, das 1964 unabhängig von Murray Gell-Mann und George Zweig vorgeschlagen wurde, wurde als Quark-Modell bekannt . Nach diesem Modell waren Teilchen wie das Proton und das Neutron keine Elementarteilchen, sondern bestanden aus verschiedenen Konfigurationen einer kleinen Anzahl anderer echter Elementarteilchen, die Partonen oder Quarks genannt wurden . Das Quarkmodell wurde ab Ende der 1960er Jahre experimentell bestätigt und lieferte schließlich eine Erklärung für das anomale magnetische Moment des Neutrons.
Videos
- Ernest Rutherford fasst den Stand der Kernphysik 1935 zusammen. (7 Min., Nobelprize.org)
- Hans Bethe diskutiert die Arbeiten von Chadwick und Goldhaber zur Deuteronenzersetzung. (2 Min., Web of Stories)
Anmerkungen
Verweise
Weiterlesen
- Annotierte Bibliographie für Neutronen aus der Alsos Digital Library for Nuclear Issues
- Abraham Pais , Inward Bound , Oxford: Oxford University Press, 1986. ISBN 0198519974 .
- Herwig Schopper , Schwache Wechselwirkungen und nuklearer Betazerfall , Herausgeber, North-Holland Pub. Co., 1966. OCLC 644015779
- Ruth Lewin Sime , Lise Meitner: A Life in Physics , Berkeley, University of California Press, 1996. ISBN 0520208609 .
- Roger H. Stuewer , "Die Kernelektronen-Hypothese". In Otto Hahn and the Rise of Nuclear Physics , William R. Shea, hrsg. Dordrecht, Holland: D. Riedel Verlag. S. 19–67, 1983. ISBN 90-277-1584-X .
- Sin-Itiro Tomonaga , The Story of Spin , The University of Chicago Press, 1997. ISBN 9780226807942