Enol - Enol
Enole oder formeller Alkenole sind eine Art reaktive Struktur oder Zwischenstufe in der organischen Chemie , die als Alken ( Olefin ) mit einer an ein Ende der Alken- Doppelbindung gebundenen Hydroxylgruppe dargestellt wird . Die Begriffe Enol und Alkenol sind Portmanteaus , die sich von "-en" / "Alken" und dem Suffix "-ol" ableiten, das die Hydroxylgruppe der Alkohole angibt und das terminale "-e" des ersten Terms fallen lässt. Die Erzeugung von Enolen beinhaltet häufig die Entfernung eines an die Carbonylgruppe angrenzenden Wasserstoffs ( α -), dh Deprotonierung , dessen Entfernung als Proton H + . Wenn dieses Proton am Ende des schrittweisen Prozesses nicht zurückgegeben wird, ist das Ergebnis ein Anion, das als Enolat bezeichnet wird (siehe Bilder rechts). Die gezeigten Enolatstrukturen sind schematisch; Eine modernere Darstellung berücksichtigt die Molekülorbitale , die im Enolat von Elektronen gebildet und besetzt werden. In ähnlicher Weise geht die Erzeugung des Enols häufig mit einem "Einfangen" oder Maskieren der Hydroxygruppe als Ether wie einem Silylenolether einher .
In der organischen Chemie , Keto-Enol - Tautomerie bezieht sich auf ein chemisches Gleichgewicht zwischen einer Keto - Form (ein Keton oder einem Aldehyd ) und einer enol (ein Alkohol ). Die Keto- und Enolformen sollen Tautomere voneinander sein. Die gegenseitige Umwandlung der beiden Formen beinhaltet die Bewegung eines alpha Wasserstoffatom und die Reorganisation der Bindungselektronen ; Daher wird die Isomerie als Tautomerie bezeichnet.
Enolization
Organische Ester , Ketone und Aldehyde mit einem α-Wasserstoff (CH-Bindung neben der Carbonylgruppe ) bilden häufig Enole. Die Reaktion beinhaltet die Migration eines Protons von Kohlenstoff zu Sauerstoff:
- RC (O) CHR ' 2 RC (OH) = CR' 2
Im Fall von Ketonen wird die Umwandlung als Keto-Enol-Tautomerie bezeichnet, obwohl dieser Name häufig allgemeiner auf alle derartigen Tautomerisierungen angewendet wird. Normalerweise ist die Gleichgewichtskonstante so klein, dass das Enol spektroskopisch nicht nachweisbar ist.
In einigen Verbindungen mit zwei (oder mehr) Carbonylen wird die Enolform dominant. Das Verhalten von 2,4-Pentandion veranschaulicht diesen Effekt:
| Carbonyl | Enol | K Enolisierung |
|---|---|---|
| CH 3 CHO | CH 2 = CHOH | 5,8 x 10 –7 |
| CH 3 C (O) CH 3 | CH 3 C (OH) = CH 2 | 5,12 x 10 –7 |
| CH 3 CO 2 CH 3 | CH 2 = CH (OH) OCH 3 | 4x10 - 20 |
| C 6 H 5 C (O) CH 3 | C 6 H 5 C (OH) = CH 2 | 1 x 10 –8 |
| CH 3 C (O) CH 2 C (O) CH 3 | CH 3 C (O) CH = C (OH) CH 3 | 0,27 |
Enole sind Derivate von Vinylalkohol mit einer C = C-OH-Konnektivität. Die Deprotonierung von organischen Carbonylen ergibt das Enolatanion , das ein starkes Nucleophil ist . Ein klassisches Beispiel für die Bevorzugung der Ketoform ist das Gleichgewicht zwischen Vinylalkohol und Acetaldehyd (K = [Enol] / [Keto] ≈ 3 × 10 –7 ). Bei 1,3-Diketonen wie Acetylaceton (2,4-Pentandion) wird die Enolform bevorzugt.
Die säurekatalysierte Umwandlung eines Enols in die Ketoform erfolgt durch Protonentransfer von O zu Kohlenstoff. Der Prozess findet nicht intramolekular statt, sondern erfordert die Teilnahme von Lösungsmittel oder anderen Mediatoren.
Stereochemie der Ketonisierung
Wenn R 1 und R 2 (Anmerkung oben auf der Seite beachten) unterschiedliche Substituenten sind, entsteht an der Alpha-Position ein neues Stereozentrum, wenn ein Enol in seine Keto-Form umgewandelt wird. Abhängig von der Art der drei R-Gruppen wären die resultierenden Produkte in dieser Situation Diastereomere oder Enantiomere .
Enediole
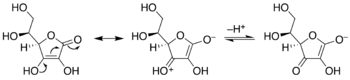
Enediole sind Alkene mit einer Hydroxylgruppe an jedem Kohlenstoff der C = C-Doppelbindung. Normalerweise sind solche Verbindungen im Gleichgewicht mit Acyloinen ungünstige Bestandteile . Ein Sonderfall ist Catechol , bei dem die C = C-Untereinheit Teil eines aromatischen Rings ist. In einigen anderen Fällen werden Enediole jedoch durch flankierende Carbonylgruppen stabilisiert. Diese stabilisierten Enediole werden Reduktone genannt . Solche Arten sind in der Glykochemie wichtig, z. B. die Lobry de Bruyn-van Ekenstein-Transformation .
 Keto-Enediol-Tautomerisierungen. Enediol in der Mitte; Acyloinisomere links und rechts. Ex. ist Hydroxyaceton , rechts gezeigt.
Keto-Enediol-Tautomerisierungen. Enediol in der Mitte; Acyloinisomere links und rechts. Ex. ist Hydroxyaceton , rechts gezeigt.
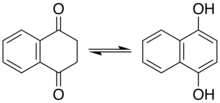
Phenole
Phenole stellen eine Art Enol dar. Für einige Phenole und verwandte Verbindungen spielt das Ketotautomer eine wichtige Rolle. Viele der Reaktionen von Resorcin betreffen beispielsweise das Ketotautomer. Naphthalin-1,4-diol liegt im beobachtbaren Gleichgewicht mit dem Diketon-Tetrahydronaphthalin-1,4-dion vor.
Biochemie
Die Keto-Enol-Tautomerie ist in mehreren Bereichen der Biochemie wichtig .
Das hohe Phosphattransferpotential von Phosphoenolpyruvat resultiert aus der Tatsache, dass die phosphorylierte Verbindung in der weniger thermodynamisch günstigen Enolform "gefangen" ist, während sie nach der Dephosphorylierung die Ketoform annehmen kann.
Das Enzym Enolase katalysiert die Dehydratisierung von 2-Phosphoglycerinsäure zum Enolphosphatester. Der Metabolismus von PEP zu Brenztraubensäure durch Pyruvatkinase (PK) erzeugt Adenosintriphosphat (ATP) über Phosphorylierung auf Substratebene .

|

|

|
||||
| H 2 O. | ADP | ATP | ||||

|

|
|||||
| H 2 O. | ||||||
Reaktivität
Der Terminus der Doppelbindung in Enolen ist nukleophil . Ihre Reaktionen mit elektrophilen organischen Verbindungen zugrunde liegen , die enorme Bedeutung der Enol-basierten Zwischenprodukte bei einer Vielzahl von wichtigen Lebensprozessen (dh in der Biochemie , die als Zwischenprodukte in Enzyme -katalysierte Reaktionen), sowie von zentraler Bedeutung für moderne wobei die synthetische organische Chemie (zB bei Anwendungen von Aldol und verwandten Reaktionen).
Enolates
Die Deprotonierung von enolisierbaren Ketonen, Aldehyden und Estern ergibt Enolate . Enolate können durch Zugabe von Elektrophilen an Sauerstoff eingefangen werden. Die Silylierung ergibt Silylenolether . Die Acylierung ergibt Ester wie Vinylacetat .
Stabile Enole
Im Allgemeinen sind Enole aufgrund der Bevorzugung der C = O-Doppelbindung gegenüber der C = C-Doppelbindung weniger stabil als ihre Ketoäquivalente. Enole können jedoch kinetisch oder thermodynamisch stabilisiert werden.
Kinetisch stabile Enole
Kinetisch stabile Enole kehren sehr langsam zur Ketoform zurück. Die Ketoform ist thermodynamisch bevorzugt, aber das Enol überlebt lange genug, um kinetisch stabil zu sein. Wie die Enolbildung wird die Ketonbildung aus Enol durch Säure oder Base katalysiert. Ohne beides hat die Enolform eine etwas lange Lebensdauer. Zum Beispiel ergibt das Erhitzen von Ethylenglykol auf 900 ° C bei niedrigem Druck Vinylalkohol, das Enol von Acetaldehyd. Acetaldehyd ist gegenüber der Enolform immer noch bevorzugt, aber ohne Katalysator bewegt sich die Bildung sehr langsam.
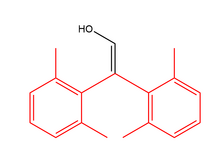
Enole können auch stabil sein, wenn es sehr schwierig ist, das Kohlenstoffatom zu protonieren. Eine sterische Hinderung kann ein Protonierungsmittel blockieren und ohne Protonierung kann das Keton nicht gebildet werden. Im Beispiel rechts schützen die beiden Benzolringe das Enol vor Protonenangriffen, sodass das Enol kinetisch stabil ist.
Thermodynamisch stabile Enole
Thermodynamisch stabile Enole werden durch Delokalisierung des Enols und Resonanz stabilisiert. Wir können sie erstellen, indem wir Funktionsgruppen hinzufügen, die diese Effekte berücksichtigen. Einige 1,3-Dicarbonylverbindungen sind in Enolform relativ stabil. Bei der (1,3) -Anordnung sind die Enole mit den beiden Carbonylgruppen konjugiert. Durch Tautomerisierung befinden sich die beiden Enole im schnellen Gleichgewicht. Ein weiterer stabilisierender Faktor in 1,3-Dicarbonylen ist die intramolekulare Wasserstoffbindung. Wir können diese beiden Faktoren in Acetylaceton sehen. Die intramolekulare Wasserstoffbrücke erzeugt einen günstigen Sechsring.
Wenn die Bildung eines Enols ein konjugiertes Resonanzsystem erzeugt, ist außerdem die erhöhte Resonanz günstiger und kann das Enol stabilisieren. Im folgenden Beispiel können die beiden Ringe in Ketonform nicht ein Resonanzsystem bilden, aber die Enolform macht das gesamte Molekül zu einem vollständig konjugierten System, wodurch mehr Resonanz und Stabilität hinzugefügt werden.
Die stabilsten Enole sind Phenole . Die Enolform wird durch Aromatizität stabilisiert, was die Günstigkeit einer C = O-Bindung gegenüber einer C = C-Bindung wesentlich überwiegt. Infolgedessen existieren diese Moleküle nur in Phenolform, und das "Keton" von Phenol wird nicht beobachtet.
Siehe auch
- Alkenal
- Enolase
- Keton
- Ynol
- Geminal Diol , eine andere Form von Ketonen und Aldehyden in Wasserlösungen
- Regioselektivität