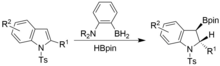Frustriertes Lewis-Paar - Frustrated Lewis pair
In der Chemie ist ein frustriertes Lewis-Paar ( FLP ) eine Verbindung oder Mischung, die eine Lewis-Säure und eine Lewis-Base enthält , die sich aufgrund sterischer Hinderung nicht zu einem klassischen Addukt verbinden können . Es wurden viele Arten von FLPs entwickelt, und viele einfache Substrate zeigen eine Aktivierung.
Die Entdeckung, dass einige FLPs H 2 spalten, löste ein schnelles Wachstum der Forschung zu FLPs aus. Aufgrund ihrer "nicht gequenchten" Reaktivität reagieren solche Systeme gegenüber Substraten, die eine Heterolyse eingehen können . Beispielsweise spalten viele FLPs Wasserstoffmoleküle . So reagiert ein Gemisch aus Tricyclohexylphosphin (PCy 3 ) und Tris (pentafluorphenyl ) boran mit Wasserstoff unter Bildung der jeweiligen Phosphonium- und Borationen :
Diese Reaktivität wurde genutzt, um FLPs herzustellen, die Hydrierungsreaktionen katalysieren.
Aktivierung kleiner Moleküle
Es wurde gezeigt, dass frustrierte Lewis-Paare viele kleine Moleküle aktivieren, entweder durch Induktion von Heterolyse oder durch Koordination.
Wasserstoff
Die Entdeckung, dass einige FLPs in der Lage sind, H 2 zu spalten und daher zu aktivieren, löste ein schnelles Wachstum der Forschung in diesem Bereich aus. Die Aktivierung und damit Verwendung von H 2 ist für viele chemische und biologische Umwandlungen wichtig. Die Verwendung von FLPs zur Freisetzung von H 2 ist metallfrei. Dies ist aufgrund der Kosten und des begrenzten Angebots einiger Übergangsmetalle, die üblicherweise zur Aktivierung von H 2 (Ni, Pd, Pt) verwendet werden, vorteilhaft . FLP-Systeme reagieren gegenüber Substraten, die aufgrund der "nicht gelöschten" Reaktivität solcher Systeme einer Heterolyse unterliegen können (z. B. Wasserstoff). Zum Beispiel hat es sich zuvor gezeigt , dass eine Mischung von Tricyclohexylphosphin (PCy 3 ) und Tris (pentafluorphenyl) boran reagiert mit H 2 die jeweiligen geben Phosphonium- und Borationen:
Bei dieser Reaktion können PCy 3 (die Lewis-Base) und B (C 6 F 5 ) 3 (die Lewis-Säure) aufgrund der sterischen Hinderung durch die sperrigen Cyclohexyl- und Pentafluorphenylgruppen kein Addukt bilden. Das Proton auf dem Phosphor und das Hydrid aus dem Borat werden nun "aktiviert" und können anschließend an ein organisches Substrat "abgegeben" werden, was zu einer Hydrierung führt .
Mechanismus der Diwasserstoffaktivierung durch FLP
Der Mechanismus für die Aktivierung von H 2 durch FLPs wurde sowohl für den intermolekularen als auch den intramolekularen Fall diskutiert. In intermolekularen FLPs ist die Lewis-Base ein von der Lewis-Säure getrenntes Molekül. Es wird angenommen, dass diese einzelnen Moleküle durch sekundäre Londoner Dispersionswechselwirkungen interagieren, um die Lewis-Base und die Säure zusammenzubringen (ein vororganisatorischer Effekt), bei dem dann kleine Moleküle interagieren können mit den FLPs. Die experimentellen Beweise für diese Art der Wechselwirkung auf molekularer Ebene sind unklar. Es gibt jedoch Belege für diese Art von Interaktion, die auf rechnergestützten DFT-Studien (Density Functional Theory) basieren. In intramolekularen FLPs werden die Lewis-Säure und die Lewis-Base durch einen kovalenten Linker in einem Molekül kombiniert. Trotz der verbesserten "vororganisatorischen Effekte" wird angenommen, dass starre intramolekulare FLP-Gerüste aufgrund einer verringerten Flexibilität eine verringerte Reaktivität gegenüber kleinen Molekülen aufweisen.
Andere niedermolekulare Substrate
FLPs reagieren auch gegenüber vielen ungesättigten Substraten jenseits von H 2 . Einige FLPs reagieren mit CO 2 , insbesondere bei der desoxygenativen Reduktion von CO 2 zu Methan.
Ethylen reagiert auch mit FLPs:
Damit sich Säure-Base-Paare gleichzeitig nukleophil und elektrophil verhalten, bietet sich ein Verfahren zur Ringöffnung von cyclischen Ethern wie THF, 2,5-Dihydrofuran, Cumaran und Dioxan an.
Verwendung in der Katalyse
Hydrierung von Imin, Nitril und Aziridin
Die Reduktion von Iminen , Nitrilen und Aziridinen zu primären und sekundären Aminen erfolgt traditionell durch Metallhydridreagenzien, z. B. Lithiumaluminiumhydrid und Natriumcyanoborhydrid . Hydrierungen dieser ungesättigten Substrate können durch metallkatalysierte Reaktionen erfolgen. Die metallfreie katalytische Hydrierung wurde unter Verwendung des Phosphoniumboratkatalysators (R 2 PH) (C 6 F 4 ) BH (C 6 F 5 ) 2 (R = 2,4,6-Me 3 C 6 H 2 ) 1 durchgeführt . Diese Art der metallfreien Hydrierung kann den teuren Metallkatalysator ersetzen.
Es wird vorgeschlagen, dass der Mechanismus der Iminreduktion die Protonierung an Stickstoff beinhaltet, wodurch das Iminiumsalz erhalten wird. Die Basizität des Stickstoffzentrums bestimmt die Reaktionsgeschwindigkeit. Mehr elektronenreiche Imine reduzieren sich schneller als elektronenarme Imine. Das resultierende Iminiumzentrum wird durch das Borhydridanion nukleophil angegriffen , um das Amin zu bilden. Kleine Amine binden an das Boran und löschen weitere Reaktionen. Dieses Problem kann mit verschiedenen Methoden überwunden werden: 1) Anwendung erhöhter Temperaturen 2) Verwendung sterisch sperriger Iminsubstituenten 3) Schutz des Imins mit der B (C 6 F 5 ) 3 -Gruppe, die auch als Lewis-Säure-Promotor dient.
Enantioselektive Iminhydrierung
Von (1 R ) - ( + ) -Kampfer abgeleitete chirale Boronat- Lewis-Säure bildet mit t Bu 3 P ein frustriertes Lewis-Paar , das als Salz isolierbar ist. Dieses FLP katalysiert die enantioselektive Hydrierung einiger Arylimine in hoher Ausbeute, aber bescheidenem ee (bis zu 83%).
Obwohl konzeptionell interessant, leidet das Protokoll an mangelnder Allgemeinheit. Es wurde gefunden, dass eine zunehmende sterische Masse der Iminsubstituenten zu einer verringerten Ausbeute und ee des Aminprodukts führt . Methoxysubstituierte Imine weisen eine überlegene Ausbeute und ee auf .
Asymmetrische Hydrosilylierungen
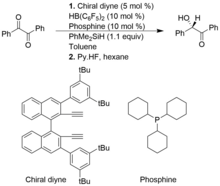
Eine Gruppe von Katalysatoren, frustrierte Lewis-Paare von chiralen Alkenylboranen und Phosphinen, sind vorteilhaft für asymmetrische Hydrosilylierungen vom Piers-Typ von 1,2-Dicarbonylverbindungen und Alpha-Ketoestern, was zu Produkten mit hoher Enantioselektivität führt. Im Vergleich zur herkömmlichen Hydrosilylierung vom Piers-Typ sind asymmetrische Hydrosilylierungen vom Piers-Typ jedoch nicht so gut entwickelt
Im folgenden Beispiel wird das chirale Alkenylboran in situ aus chiralem Diin und dem HB (C 6 F 5 ) 2 gebildet . Die heterolytische Abspaltung der Si-H-Bindung von PhMe 2 SiH durch den FLP-Katalysator bildet einen ionischen Komplex aus Silylium und Hydridoborat.
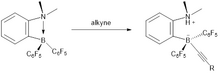
Alkinhydrierung
Die metallfreie Hydrierung von nicht aktivierten internen Alkinen zu cis- Alkenen wird leicht unter Verwendung von Katalysatoren auf FLP-Basis erreicht. Die Bedingungen für diese Reaktion waren unter Verwendung von 2 bar H 2 relativ mild . In Bezug auf den Mechanismus wird das Alkinmaterial zuerst hydroboriert und dann kann das resultierende FLP auf Vinylboranbasis Dihydrogen aktivieren. Ein Protodeborylierungsschritt setzt das cis- Alkenprodukt frei , das aufgrund des syn- Hydroborylierungsprozesses erhalten wird, und regeneriert den Katalysator. Die für die Alkinhydrierung aktiven Katalysatoren auf FLP-Basis erleichtern jedoch nicht die Hydrierung von Alkenen zu Alkanen.
Die Reaktion ist eine syn-Hydroborierung, und als Ergebnis wird eine hohe cis-Selektivität beobachtet. Im Endstadium des Katalysezyklus wird die C 6 F 5 -Gruppe leichter gespalten als eine Alkylgruppe, was eher einen Katalysatorabbau als eine Alkanfreisetzung verursacht. Der Katalysezyklus besteht aus drei Schritten:
- Substratbindung (Hydroborierung von Alkin)
- H 2 -Spaltung mit Vinylboran, gefolgt von intramolekularer Protodeborylierung des Vinylsubstituenten, wobei N, N-Dimethyl-2 - [(pentafluorphenyl) boryl] anilin gewonnen wird
- Freisetzung des cis-Alkens
Bei internen Alkinen tritt eine kompetitive Reaktion auf, bei der das an den Stickstoff gebundene Proton zu den Fluorbenzolen hinzugefügt werden kann. Daher geht diese Zugabe nicht so weit, die Bildung des Alkens scheint begünstigt.
Endständige Alkine binden jedoch nicht durch Hydroborierung, sondern durch CH-Aktivierung an das Bor. Somit führt die Zugabe des Protons zum Alkin zum anfänglichen terminalen Alkin. Daher ist dieser Hydrierungsprozess nicht für terminale Alkine geeignet und ergibt nur Pentafluorbenzol.
Die metallfreie Hydrierung von terminalen Alkinen zu den jeweiligen Alkenen wurde kürzlich unter Verwendung eines Systems auf Pyridonboranbasis erreicht. Dieses System aktiviert Wasserstoff leicht bei Raumtemperatur und ergibt einen Pyridonborankomplex. Die Dissoziation dieses Komplexes ermöglicht die Hydroborierung eines Alkins durch das freie Boran. Bei der Protodeborylierung durch das freie Pyridon wird das cis- Alken erzeugt. Die Hydrierung von terminalen Alkinen ist mit diesem System möglich, da die CH-Aktivierung reversibel ist und mit der Wasserstoffaktivierung konkurriert.
Borylierung
Amin-Boran-FLPs katalysieren die Borylierung elektronenreicher aromatischer Heterocyclen (Schema 1). Die Reaktion wird durch Freisetzung von Wasserstoff über CH-Aktivierung durch das FLP angetrieben. Aromatische Borylierungen werden häufig in der pharmazeutischen Entwicklung verwendet, insbesondere aufgrund der Häufigkeit, der geringen Kosten und der geringen Toxizität von Borverbindungen im Vergleich zu Edelmetallen.
Das Substrat für die Reaktion hat zwei Hauptanforderungen, die stark mit dem Mechanismus der Borylierung verbunden sind. Erstens muss das Substrat elektronenreich sein, was durch das Fehlen einer Reaktion mit Thiophen veranschaulicht wird, während seine elektronenreicheren Derivate - Methoxythiophen und 3,4-Ethylendioxythiophen - eine Reaktion mit dem Aminoboran eingehen können. Darüber hinaus hemmt die Substitution von 1-Methylpyrrol (das reagieren kann) durch die stark elektronenziehende tert-Butyloxycarbonyl (Boc) -Gruppe an der 2-Position die Reaktion vollständig. Die zweite Anforderung betrifft das Fehlen basischer Amingruppen im Substrat, die sonst ein unerwünschtes Addukt bilden würden. Dies kann durch das Fehlen einer Reaktion mit Pyrrol veranschaulicht werden, während sowohl 1-Methyl- als auch N-Benzylpyrrol-Derivate reagieren können.
Weitere Arbeiten derselben Autoren zeigten, dass einfach Piperidin als Amin-R-Gruppe (im Gegensatz zu Tetramethylpiperidin, wie oben abgebildet) die Reaktionsgeschwindigkeit beschleunigte. Durch kinetische und DFT-Studien schlugen die Autoren vor, dass der CH-Aktivierungsschritt einfacher war als bei größeren Substituenten.
Die Dearomatisierung kann auch unter ähnlichen Bedingungen erreicht werden, jedoch unter Verwendung von N-Tosylindolen. Man erhält syn- Hyrdoborylierte Indoline.
Es wurde auch eine Borylierung von SH-Bindungen in Thiolen durch einen dehydrierenden Prozess beobachtet. Alkohole und Amine wie tert-Butanol und tert-Butylamin bilden stabile Produkte, die die Katalyse aufgrund einer starken π-Bindung zwischen dem Einzelpaar des N / O-Atoms und Bor verhindern, während dies für Thiole nicht gilt und somit eine erfolgreiche Katalyse ermöglicht . Darüber hinaus wurde eine erfolgreiche Borylierung von Se-H-Bindungen erreicht. In allen Fällen ist die Bildung von H 2 -Gas eine starke treibende Kraft für die Reaktionen.
Kohlenstoffabscheidung
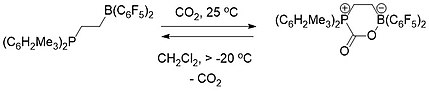
Die FLP-Chemie ist konzeptionell relevant für die Kohlenstoffabscheidung . Sowohl ein intermolekulares (Schema 1) als auch ein intramolekulares (Schema 2) FLP, bestehend aus einem Phosphin und einem Boran, wurden verwendet, um Kohlendioxid selektiv einzufangen und freizusetzen. Wenn eine Lösung des FLP bei Raumtemperatur mit einer CO 2 -Atmosphäre bedeckt war , fiel die FLP-CO 2 -Verbindung sofort als weißer Feststoff aus.
Das Erhitzen der intermolekularen FLP-CO 2 -Verbindung in Brombenzol auf 80 ° C unter Vakuum für 5 Stunden verursachte die Freisetzung von etwa der Hälfte des CO 2 und die Regeneration der beiden Bestandteile des FLP. Nach mehreren weiteren Stunden des Sitzens bei Raumtemperatur unter Vakuum war eine vollständige Freisetzung von CO 2 und eine FLP-Regeneration aufgetreten.
Die intramolekulare FLP-CO 2 -Verbindung war dagegen bei Raumtemperatur als Feststoff stabil, zersetzte sich jedoch bei Temperaturen über -20 ° C vollständig als Lösung in Dichlormethan, wobei CO 2 freigesetzt und das FLP-Molekül regeneriert wurde.
Diese Methode der FLP-Kohlenstoffabscheidung kann für die Arbeit in strömungschemischen Systemen angepasst werden.

![{\ displaystyle {\ ce {PCy3 + B (C6F5) 3 + H2 -> [HPCy3] + [HB (C6F5) 3] -}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3c7ea46199d1f74478288c7affc7bdd1fc964071)