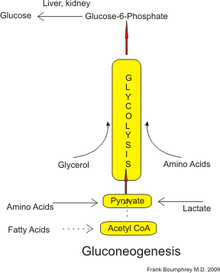
Glukoneogenese - Gluconeogenesis
Die Glukoneogenese ( GNG ) ist ein Stoffwechselweg , der zur Bildung von Glukose aus bestimmten Nicht- Kohlenhydrat- Kohlenstoffsubstraten führt. Es ist ein allgegenwärtiger Prozess, der in Pflanzen, Tieren, Pilzen, Bakterien und anderen Mikroorganismen vorkommt. Bei Wirbeltieren tritt gluconeogenesis hauptsächlich in der Leber und in geringerem Maße auch in der Rinde der Nieren . Es ist einer von zwei Hauptmechanismen – der andere ist der Abbau von Glykogen ( Glykogenolyse ) – der von Menschen und vielen anderen Tieren verwendet wird, um den Blutzuckerspiegel aufrechtzuerhalten und niedrige Werte ( Hypoglykämie ) zu vermeiden . Bei Wiederkäuern , weil Kohlenhydrate aus der Nahrung durch zu metabolisiert neigen Pansen Organismen, Gluconeogenese tritt unabhängig von Fasten, Low-Carb - Diäten, Bewegung, usw. In vielen anderen Tieren, tritt der Prozess in Zeiten des Fastens , Hunger , kohlenhydratarme Diäten , oder intensives Training .
Beim Menschen können Substrate für die Gluconeogenese aus allen Nicht-Kohlenhydratquellen stammen, die in Pyruvat oder Zwischenprodukte der Glykolyse umgewandelt werden können (siehe Abbildung). Für den Abbau von Proteinen umfassen diese Substrate glucogene Aminosäuren (wenn auch keine ketogenen Aminosäuren ); durch den Abbau von Lipiden (wie Triglyceride ) umfassen sie Glycerin , ungeradkettige Fettsäuren (jedoch keine geradkettigen Fettsäuren, siehe unten); und aus anderen Teilen des Stoffwechsels enthalten sie Laktat aus dem Cori-Zyklus . Unter Bedingungen des verlängerten Fastens kann Aceton, das aus Ketonkörpern gewonnen wird, auch als Substrat dienen und einen Weg von Fettsäuren zu Glukose bereitstellen. Obwohl der größte Teil der Gluconeogenese in der Leber stattfindet, ist der relative Beitrag der Gluconeogenese durch die Niere bei Diabetes und verlängertem Fasten erhöht.
Der Gluconeogenese-Weg ist stark endergonisch, bis er an die Hydrolyse von ATP oder GTP gekoppelt wird , wodurch der Prozess effektiv exergonisch wird . Zum Beispiel erfordert der Weg, der von Pyruvat zu Glucose-6-Phosphat führt , 4 Moleküle ATP und 2 Moleküle GTP, um spontan zu verlaufen. Diese ATPs werden aus dem Fettsäurekatabolismus über die Beta-Oxidation zugeführt .
Vorläufer

- Glucogene Aminosäuren haben diese Fähigkeit
- Ketogene Aminosäuren nicht. Diese Produkte können weiterhin zur Ketogenese oder Lipidsynthese verwendet werden .
- Einige Aminosäuren werden sowohl zu glucogenen als auch zu ketogenen Produkten abgebaut.
Beim Menschen sind die wichtigsten glukoneogenen Vorläufer Laktat , Glycerin (das ein Teil des Triglyceridmoleküls ist), Alanin und Glutamin . Zusammen machen sie über 90 % der gesamten Gluconeogenese aus. Andere glucogene Aminosäuren und alle Zwischenprodukte des Zitronensäurezyklus (durch Umwandlung in Oxalacetat ) können auch als Substrate für die Gluconeogenese fungieren. Im Allgemeinen führt die menschliche Aufnahme von glukoneogenen Substraten in Lebensmitteln nicht zu einer erhöhten Glukoneogenese.
Bei Wiederkäuern ist Propionat das wichtigste glukoneogene Substrat. Bei Nichtwiederkäuern, einschließlich des Menschen, entsteht Propionat aus der β-Oxidation von ungeradkettigen und verzweigtkettigen Fettsäuren und ist ein (relativ untergeordnetes) Substrat für die Gluconeogenese.
Laktat wird zurück in die Leber transportiert, wo es durch den Cori-Zyklus mit Hilfe des Enzyms Laktat-Dehydrogenase in Pyruvat umgewandelt wird . Pyruvat, das erste designierte Substrat des glukoneogenen Stoffwechselwegs, kann dann zur Erzeugung von Glukose verwendet werden. Die Transaminierung oder Desaminierung von Aminosäuren erleichtert den Eintritt ihres Kohlenstoffgerüsts in den Zyklus direkt (als Pyruvat oder Oxalacetat) oder indirekt über den Zitronensäurezyklus. Der Beitrag von Laktat aus dem Cori-Zyklus zur gesamten Glukoseproduktion nimmt mit der Fastendauer zu . Insbesondere nach 12, 20 und 40 Stunden Fasten durch menschliche Freiwillige betrug der Beitrag von Cori-Zyklus-Laktat zur Gluconeogenese 41%, 71% bzw. 92%.
Ob geradkettige Fettsäuren bei Tieren in Glukose umgewandelt werden können, ist seit langem eine Frage der Biochemie. Ungeradkettige Fettsäuren können zu Acetyl-CoA und Propionyl-CoA oxidiert werden , wobei letzteres als Vorläufer von Succinyl-CoA dient , das in Pyruvat umgewandelt werden und in die Gluconeogenese eintreten kann. Im Gegensatz dazu werden geradkettige Fettsäuren oxidiert, um nur Acetyl-CoA zu ergeben, dessen Eintritt in die Gluconeogenese die Anwesenheit eines Glyoxylat-Zyklus (auch bekannt als Glyoxylat-Shunt) erfordert , um Vier-Kohlenstoff-Dicarbonsäure-Vorläufer zu erzeugen. Der Glyoxylat-Shunt umfasst zwei Enzyme, Malatsynthase und Isocitratlyase, und kommt in Pilzen, Pflanzen und Bakterien vor. Trotz einiger Berichte über enzymatische Glyoxylat-Shunt-Aktivitäten, die in tierischen Geweben nachgewiesen wurden, wurden Gene, die beide enzymatische Funktionen kodieren, nur in Nematoden gefunden , in denen sie als ein einzelnes bifunktionelles Enzym existieren. Gene, die nur für Malat-Synthase (aber nicht für Isocitrat-Lyase) kodieren, wurden in anderen Tieren einschließlich Arthropoden , Stachelhäutern und sogar einigen Wirbeltieren identifiziert . Säugetiere , die das Malat - Synthase - Gen besitzen , umfassen Monotremen ( Schnabeltier ) und Beuteltiere ( Opossum ) , nicht jedoch plazentare Säugetiere .
Die Existenz des Glyoxylatzyklus beim Menschen wurde nicht nachgewiesen, und es wird allgemein angenommen, dass Fettsäuren beim Menschen nicht direkt in Glukose umgewandelt werden können. Es wurde gezeigt, dass Kohlenstoff-14 in Glukose endet, wenn es in Fettsäuren zugeführt wird, aber dies ist aufgrund des Einbaus von markierten Atomen, die von Acetyl-CoA abgeleitet sind, in Zwischenprodukte des Zitronensäurezyklus zu erwarten, die mit denen aus anderen physiologischen Quellen austauschbar sind , wie glucogene Aminosäuren. In Abwesenheit anderer glucogener Quellen kann das aus der Oxidation von Fettsäuren stammende 2-Kohlenstoff- Acetyl-CoA keine Nettoausbeute an Glucose über den Zitronensäurezyklus produzieren , da während des Zyklus zwei äquivalente Kohlenstoffatome als Kohlendioxid freigesetzt werden. Während der Ketose jedoch liefert Acetyl-CoA aus Fettsäuren Ketonkörper , einschließlich Aceton , und bis zu ~60% des Acetons können in der Leber zu den Pyruvatvorläufern Acetol und Methylglyoxal oxidiert werden . So könnten Ketonkörper aus Fettsäuren bis zu 11% der Gluconeogenese während des Hungers ausmachen. Der Abbau von Fettsäuren produziert auch Energie in Form von ATP, das für den Gluconeogenese-Weg notwendig ist.
Standort
Bei Säugetieren wurde angenommen, dass die Gluconeogenese auf die Leber, die Niere, den Darm und den Muskel beschränkt ist, aber neuere Erkenntnisse deuten darauf hin, dass die Gluconeogenese in Astrozyten des Gehirns auftritt . Diese Organe verwenden etwas andere glukoneogene Vorläufer. Die Leber verwendet vorzugsweise Laktat, Glycerin und glucogene Aminosäuren (insbesondere Alanin ), während die Niere vorzugsweise Laktat, Glutamin und Glycerin verwendet. Laktat aus dem Cori-Zyklus ist quantitativ die größte Substratquelle für die Gluconeogenese, insbesondere für die Niere. Die Leber verwendet sowohl Glykogenolyse als auch Gluconeogenese, um Glukose zu produzieren, während die Niere nur Gluconeogenese verwendet. Nach einer Mahlzeit schaltet die Leber auf die Glykogensynthese um , während die Niere die Glukoneogenese erhöht. Der Darm verwendet hauptsächlich Glutamin und Glycerin.
Propionat ist das Hauptsubstrat für die Glukoneogenese in der Leber von Wiederkäuern, und die Leber von Wiederkäuern kann bei erhöhtem Glukosebedarf vermehrt glukoneogene Aminosäuren (z. B. Alanin) verwerten. Die Fähigkeit der Leberzellen, Laktat für die Gluconeogenese zu verwenden, nimmt bei Kälbern und Lämmern vom Vorwiederkäuerstadium zum Wiederkäuerstadium ab. Im Nierengewebe von Schafen wurden sehr hohe Raten der Gluconeogenese aus Propionat beobachtet.
Bei allen Spezies ist die Bildung von Oxalacetat aus Pyruvat- und TCA-Zyklus-Zwischenprodukten auf das Mitochondrium beschränkt, und die Enzyme, die Phosphoenolbrenztraubensäure (PEP) in Glucose-6-Phosphat umwandeln , befinden sich im Zytosol. Die Position des Enzyms, das diese beiden Teile der Gluconeogenese durch die Umwandlung von Oxalacetat in PEP – PEP-Carboxykinase (PEPCK) – verbindet, ist je nach Spezies unterschiedlich: Es kann vollständig in den Mitochondrien , vollständig im Zytosol oder gleichmäßig zwischen den beiden gefunden werden. wie es beim Menschen ist. Der Transport von PEP durch die Mitochondrienmembran wird durch spezielle Transportproteine erreicht; für Oxalacetat existieren jedoch keine derartigen Proteine . Daher muss Oxalacetat bei Spezies, denen intramitochondriales PEPCK fehlt, in Malat oder Aspartat umgewandelt , aus dem Mitochondrium exportiert und wieder in Oxalacetat umgewandelt werden, damit die Gluconeogenese fortgesetzt werden kann.
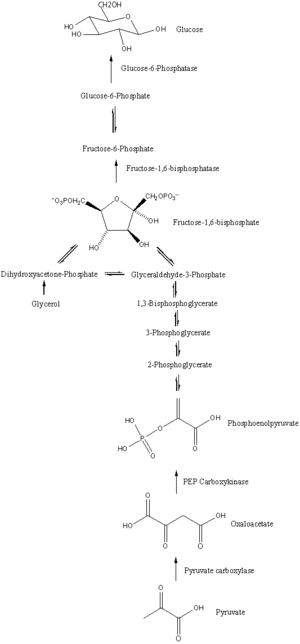
Weg
Die Glukoneogenese ist ein Stoffwechselweg, der aus einer Reihe von elf enzymkatalysierten Reaktionen besteht. Der Weg beginnt entweder in der Leber oder Niere, in den Mitochondrien oder im Zytoplasma dieser Zellen, je nachdem, welches Substrat verwendet wird. Viele der Reaktionen sind die umgekehrten Schritte der Glykolyse .
- Die Gluconeogenese beginnt in den Mitochondrien mit der Bildung von Oxalacetat durch die Carboxylierung von Pyruvat. Diese Reaktion erfordert ebenfalls ein Molekül ATP und wird durch Pyruvat-Carboxylase katalysiert . Dieses Enzym wird durch hohe Acetyl-CoA- Spiegel (produziert bei der β-Oxidation in der Leber) stimuliert und durch hohe ADP- und Glukosespiegel gehemmt.
- Oxalacetat wird mit NADH zu Malat reduziert , ein Schritt, der für seinen Transport aus den Mitochondrien erforderlich ist.
- Malat wird mit NAD + im Zytosol zu Oxalacetat oxidiert , wo die restlichen Schritte der Gluconeogenese stattfinden.
- Oxalacetat wird decarboxyliert und anschließend mit dem Enzym PEPCK zu Phosphoenolpyruvat phosphoryliert . Während dieser Reaktion wird ein GTP- Molekül zu GDP hydrolysiert .
- Die nächsten Schritte in der Reaktion sind die gleichen wie bei der umgekehrten Glykolyse . Jedoch Fructose - 1,6-bisphosphatase wandelt 1,6-bisphosphat - Fruktose zu Fruktose - 6-phosphat , ein Wassermolekül und unter Verwendung eines Phosphat - freisetzende (in der Glykolyse, Phosphofructokinase 1 wandelt F6P und ATP zu F1,6BP und ADP ). Dies ist auch der geschwindigkeitsbestimmende Schritt der Gluconeogenese.
- Glucose-6-Phosphat wird aus Fructose-6-Phosphat durch Phosphoglucoisomerase gebildet (die Umkehrung von Schritt 2 bei der Glykolyse). Glucose-6-phosphat kann in anderen Stoffwechselwegen verwendet oder zu freier Glucose dephosphoryliert werden. Während freie Glukose leicht in und aus der Zelle diffundieren kann, wird die phosphorylierte Form (Glukose-6-Phosphat) in der Zelle eingeschlossen, ein Mechanismus, durch den der intrazelluläre Glukosespiegel von den Zellen kontrolliert wird.
- Die letzte Gluconeogenese, die Bildung von Glucose, findet im Lumen des endoplasmatischen Retikulums statt , wo Glucose-6-Phosphat durch Glucose-6-Phosphatase hydrolysiert wird , um Glucose zu produzieren und ein anorganisches Phosphat freizusetzen . Wie zwei Schritte zuvor ist dieser Schritt keine einfache Umkehrung der Glykolyse, bei der Hexokinase die Umwandlung von Glucose und ATP in G6P und ADP katalysiert. Glukose wird durch Glukosetransporter, die sich in der Membran des endoplasmatischen Retikulums befinden, in das Zytoplasma transportiert .
| Metabolismus üblicher Monosaccharide , einschließlich Glykolyse , Glukoneogenese, Glykogenese und Glykogenolyse |
|---|
Verordnung
Während die meisten Schritte bei der Glukoneogenese umgekehrt sind wie bei der Glykolyse , werden drei regulierte und stark endergonische Reaktionen durch kinetisch günstigere Reaktionen ersetzt. Hexokinase / Glucokinase- , Phosphofructokinase- und Pyruvatkinase- Enzyme der Glykolyse werden durch Glucose-6-Phosphatase , Fructose-1,6-Bisphosphatase und PEP-Carboxykinase /Pyruvat-Carboxylase ersetzt. Diese Enzyme werden typischerweise durch ähnliche Moleküle reguliert, jedoch mit gegenteiligen Ergebnissen. Beispielsweise aktivieren Acetyl-CoA und Citrat Gluconeogenese-Enzyme (Pyruvat-Carboxylase bzw. Fructose-1,6-Bisphosphatase), während gleichzeitig das glykolytische Enzym Pyruvat-Kinase gehemmt wird . Dieses System der gegenseitigen Kontrolle ermöglicht es Glykolyse und Gluconeogenese, sich gegenseitig zu hemmen und verhindert einen sinnlosen Zyklus der Synthese von Glukose, um sie nur abzubauen. Pyruvatkinase kann auch auf 86 nicht mit der Gluconeogenese zusammenhängenden Wegen umgangen werden, um Pyruvat und anschließend Laktat zu bilden; einige dieser Wege verwenden Kohlenstoffatome, die aus Glukose stammen.
Die meisten der für die Glukoneogenese verantwortlichen Enzyme befinden sich im Zytosol ; Ausnahmen sind die mitochondriale Pyruvat-Carboxylase und bei Tieren die Phosphoenolpyruvat-Carboxykinase . Letzteres liegt als Isozym sowohl im Mitochondrium als auch im Zytosol vor . Die Geschwindigkeit der Gluconeogenese wird letztendlich durch die Wirkung eines Schlüsselenzyms, der Fructose-1,6-bisphosphatase , gesteuert , die auch durch die Signalübertragung durch cAMP und dessen Phosphorylierung reguliert wird .
Die globale Kontrolle der Gluconeogenese wird durch Glucagon vermittelt ( freigesetzt, wenn der Blutzucker niedrig ist ); es löst die Phosphorylierung von Enzymen und regulatorischen Proteinen durch Proteinkinase A (eine durch zyklisches AMP regulierte Kinase) aus, was zur Hemmung der Glykolyse und zur Stimulation der Gluconeogenese führt. Insulin wirkt Glucagon entgegen, indem es die Gluconeogenese hemmt. Typ-2-Diabetes ist durch eine übermäßige Glucagon- und Insulinresistenz des Körpers gekennzeichnet. Insulin kann die Genexpression von Enzymen wie PEPCK nicht mehr hemmen, was zu einer erhöhten Hyperglykämie im Körper führt. Das Antidiabetikum Metformin senkt den Blutzucker hauptsächlich durch Hemmung der Gluconeogenese und überwindet das Versagen von Insulin, die Gluconeogenese aufgrund von Insulinresistenz zu hemmen.
Studien haben gezeigt, dass das Fehlen einer hepatischen Glukoseproduktion keinen wesentlichen Einfluss auf die Kontrolle der Nüchtern-Glukosekonzentration im Plasma hat. Eine kompensatorische Induktion der Gluconeogenese erfolgt in den Nieren und im Darm, angetrieben durch Glucagon , Glukokortikoide und Azidose.
Insulinresistenz
In der Leber fördert das FOX-Protein FOXO6 normalerweise die Gluconeogenese im nüchternen Zustand, aber Insulin blockiert FOXO6 beim Füttern. Bei einer Insulinresistenz blockiert Insulin FOXO6 nicht, was zu einer fortgesetzten Glukoneogenese auch nach der Nahrungsaufnahme führt, was zu einem hohen Blutzuckerspiegel ( Hyperglykämie ) führt.
Insulinresistenz ist ein häufiges Merkmal des metabolischen Syndroms und des Typ-2-Diabetes . Aus diesem Grund ist die Glukoneogenese ein Therapieziel bei Typ-2-Diabetes, wie dem Antidiabetikum Metformin , das die glukoneogene Glukosebildung hemmt und die Glukoseaufnahme durch die Zellen stimuliert.