Humanes Polyomavirus 2 -Human polyomavirus 2
| Humanes Polyomavirus 2 | |
|---|---|
|
|
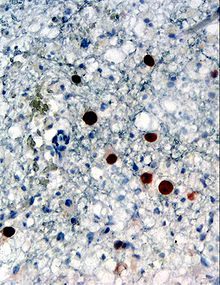
| Immunhistochemischer Nachweis des humanen Polyomavirus-2- Proteins (braun gefärbt) in einer Hirnbiopsie ( Glia, die eine progressive multifokale Leukenzephalopathie (PML) zeigt) | |
|
Virusklassifizierung |
|
| (ohne Rang): | Virus |
| Bereich : | Monodnaviria |
| Königreich: | Shotokuvirae |
| Stamm: | Cossaviricota |
| Klasse: | Papovaviricetes |
| Befehl: | Sepolyvirales |
| Familie: | Polyomaviridae |
| Gattung: | Betapolyomavirus |
| Spezies: |
Humanes Polyomavirus 2
|
| Synonyme | |
|
|
Humanes Polyomavirus 2 , allgemein als JC-Virus oder John Cunningham-Virus bezeichnet , ist eine Art von humanem Polyomavirus (früher bekannt als Papovavirus ). Es wurde 1965 von ZuRhein und Chou sowie von Silverman und Rubinstein elektronenmikroskopisch identifiziert und später in Kultur isoliert und mit den beiden Initialen eines Patienten, John Cunningham, mit progressiver multifokaler Leukoenzephalopathie (PML) benannt. Das Virus verursacht PML und andere Erkrankungen nur bei Immunschwäche , wie bei AIDS oder während der Behandlung mit Immunsuppressiva (zB bei Organtransplantationspatienten ).
Infektion und Pathogenese
Die erste Infektionsstelle können die Mandeln oder möglicherweise der Magen-Darm-Trakt sein . Das Virus latent bleibt dann im Magen - Darm - Trakt und kann auch die Rohr infiziert epitheliale Zellen in den Nieren , wo es, zu reproduzieren weiterhin vergießen Virus - Partikels im Urin. Darüber hinaus deuten neuere Studien darauf hin, dass dieses Virus sowohl den menschlichen Samen als auch das Chorionzottengewebe latent infizieren kann. Serum-Antikörper gegen Humanes Polyomavirus 2 wurden auch bei Frauen mit Spontanaborten sowie bei Frauen mit freiwilligem Schwangerschaftsabbruch gefunden.
Menschlicher Polyomavirus 2 kann überquert die Blut-Hirn - Schranke in das zentrale Nervensystem , wo es infiziert Oligodendrozyten und Astrozyten , die möglicherweise durch den 5-HT 2A Serotonin - Rezeptor . Humane Polyomavirus-2- DNA kann sowohl in nicht-PML-befallenem als auch in PML-befallenem (siehe unten) Hirngewebe nachgewiesen werden.
Humanes Polyomavirus 2, das im Zentralnervensystem von PML-Patienten gefunden wird, weist fast ausnahmslos Unterschiede in der Promotorsequenz zum Humanen Polyomavirus 2 auf, das bei gesunden Individuen gefunden wird. Es wird vermutet, dass diese Unterschiede in der Promotorsequenz zur Fitness des Virus im ZNS und damit zur Entwicklung von PML beitragen. Bestimmte Transkriptionsfaktoren, die in den frühen Promotorsequenzen des humanen Polyomavirus 2 vorhanden sind, können Tropismus und virale Proliferation induzieren, die zu PML führt. Es wurde gezeigt, dass der Spi-B-Faktor für die Initiierung der viralen Replikation in bestimmten Stämmen transgener Mäuse entscheidend ist. Das von diesen frühen Sequenzen kodierte Protein, T-Antigen, spielt auch eine Schlüsselrolle bei der viralen Proliferation, indem es die Initiation der DNA-Replikation für das Virus steuert und einen Transkriptionswechsel durchführt, um die Bildung der verschiedenen benötigten Kapsid- und regulatorischen Proteine zu ermöglichen für virale Fitness. Weitere Forschung ist erforderlich, um die genaue ätiologische Rolle des T-Antigens zu bestimmen, aber es scheint einen Zusammenhang mit der frühen Initiierung des aktiven Virus aus seinem archetypischen Ruhezustand zu geben.
Immunschwäche oder Immunsuppression ermöglicht die Reaktivierung des Humanen Polyomavirus 2 . Im Gehirn verursacht es die oft tödliche progressive multifokale Leukenzephalopathie oder PML, indem es Oligodendrozyten zerstört. Ob dies die Reaktivierung des Humanen Polyomavirus 2 im ZNS oder die Aussaat von neu reaktiviertem Humanem Polyomavirus 2 über Blut oder Lymphgefäße darstellt, ist unbekannt. Mehrere Studien seit dem Jahr 2000 haben darauf hingewiesen, dass das Virus auch mit Darmkrebs in Verbindung gebracht wird , da das humane Polyomavirus 2 in bösartigen Dickdarmtumoren gefunden wurde , aber diese Ergebnisse sind immer noch umstritten.
Andere Stämme und neuartige pathologische Syndrome
Obwohl die Infektion mit dem humanen Polyomavirus 2 klassischerweise mit der Demyelinisierung der weißen Substanz und der PML-Pathogenese verbunden ist, hat die neuere Literatur virale Varianten als ätiologische Agenzien anderer neuer Syndrome identifiziert. Zum Beispiel wurde festgestellt , dass Humanes Polyomavirus 2 die Körnerzellschicht des Kleinhirns infiziert , während Purkinje-Fasern geschont werden , was letztendlich eine schwere Kleinhirnatrophie verursacht. Dieses Syndrom, das als JCV-Granula-Cell-Layer-Neuropathie (JCV GCN) bezeichnet wird, ist durch eine produktive und lytische Infektion durch eine JC-Variante mit einer Mutation in der VP1-kodierenden Region gekennzeichnet.
Humanes Polyomavirus 2 scheint aufgrund einer Infektion von kortikalen Pyramidenneuronen (CPN) und Astrozyten auch Enzephalopathie zu vermitteln . Die Analyse der JCV-CPN-Variante zeigte Unterschiede zu JCV-GCN: Es wurden keine Mutationen in der VP1-kodierenden Region gefunden; im Agnogen wurde jedoch eine Deletion von 143 Basenpaaren identifiziert , die für ein verkürztes Peptid mit 10 Aminosäuren kodiert , von dem angenommen wird, dass es den CPN- Tropismus vermittelt . Darüber hinaus legt die Analyse der subzellulären Lokalisation von JC CPN- Virionen in Kernen, Zytoplasma und Axonen nahe, dass das Virus durch Axone wandern kann, um die Infektiosität zu erhöhen.
Das humane Polyomavirus 2 kann auch ein Erreger der aseptischen Meningitis (JCVM) sein, da das humane Polyomavirus 2 der einzige Erreger war, der im Liquor bestimmter Patienten mit Meningitis identifiziert wurde . Die Analyse der JCVM-Variante zeigte archetypähnliche regulatorische Regionen ohne Mutationen in kodierenden Sequenzen. Die genauen molekularen Mechanismen, die den meningealen Tropismus des humanen Polyomavirus 2 vermitteln , müssen noch gefunden werden.
Epidemiologie

Das Virus ist in der Allgemeinbevölkerung sehr verbreitet und infiziert 70 bis 90 % der Menschen; Die meisten Menschen erwerben das Humane Polyomavirus 2 im Kindes- oder Jugendalter. Es kommt weltweit in hohen Konzentrationen in städtischen Abwässern vor, was einige Forscher vermuten lässt, dass verunreinigtes Wasser ein typischer Infektionsweg ist.
Geringfügige genetische Variationen werden durchweg in verschiedenen geografischen Gebieten gefunden; daher war die genetische Analyse von Human-Polyomavirus-2- Proben nützlich, um die Geschichte der menschlichen Migration zu verfolgen. Es werden 14 Subtypen oder Genotypen erkannt, von denen jeder einer bestimmten geografischen Region zugeordnet ist. Drei sind in Europa zu finden (a, b und c). Ein kleinerer afrikanischer Typ – Af1 – kommt in Zentral- und Westafrika vor. Der afrikanische Haupttyp – Af2 – kommt in ganz Afrika und auch in West- und Südasien vor. Mehrere asiatische Typen werden anerkannt B1-a, B1-b, B1-d, B2, CY, MY und SC.
Ein alternatives Nummerierungsschema nummeriert die Genotypen 1–8 mit zusätzlicher Beschriftung. Die Typen 1 und 4 kommen in Europa und in indigenen Populationen in Nordjapan, Nordostsibirien und Nordkanada vor. Diese beiden Typen sind eng verwandt. Die Typen 3 und 6 kommen in Afrika südlich der Sahara vor: Typ 3 wurde in Äthiopien, Tansania und Südafrika isoliert. Typ 6 kommt in Ghana vor. Beide Arten kommen auch bei den Biaka Pygmäen und Bantus aus Zentralafrika vor. Typ 2 hat mehrere Varianten: Subtyp 2A kommt hauptsächlich in der japanischen Bevölkerung und bei den amerikanischen Ureinwohnern (außer Inuit ) vor; 2B findet sich im Eurasier; 2D kommt bei Indianern vor und 2E kommt bei Australiern und westlichen Pazifik-Populationen vor. Subtyp 7A kommt in Südchina und Südostasien vor. Subtyp 7B kommt in Nordchina, Mongolei und Japan vor Subtyp 7C kommt in Nord- und Südchina vor. Subtyp 8 kommt in Papua-Neuguinea und auf den pazifischen Inseln vor. Die geografische Verteilung der JC-Polyomavirus-Typen kann helfen, Menschen aus verschiedenen Kontinenten durch JC-Genotypisierung aufzuspüren.
Medikamente im Zusammenhang mit Reaktivierung
Da eine Immunschwäche dazu führt, dass dieses Virus zu PML fortschreitet, sind Immunsuppressiva bei Infizierten kontraindiziert .
Die eingerahmte Warnung für das Medikament Rituximab (Rituxan) enthält eine Aussage, dass bei Patienten, die mit dem Medikament behandelt wurden, eine Infektion mit dem humanen Polyomavirus 2 , die zu einer progressiven multifokalen Leukenzephalopathie und zum Tod führte, gemeldet wurde.
Der Warnhinweis für das Medikament Natalizumab (Tysabri) enthält eine Aussage, dass das Humane Polyomavirus 2 bei drei Patienten, die Natalizumab in klinischen Studien erhielten, zu einer progressiven multifokalen Leukenzephalopathie führte. Dies ist heute eine der häufigsten Ursachen für PML.
Die eingerahmte Warnung war für die Medikamente Tecfidera und Gilenya enthalten , bei denen beide Fälle von PML mit Todesfolge auftraten.
Die umrahmte Warnung wurde am 19. Februar 2009 für das Medikament Efalizumab (Raptiva) hinzugefügt und enthält eine Aussage, dass sich das Humane Polyomavirus 2 , das zu einer progressiven multifokalen Leukenzephalopathie führt, bei drei Patienten entwickelt hat, die Efalizumab in klinischen Studien erhielten. Das Medikament wurde am 10. April 2009 wegen der Assoziation mit PML vom US-Markt genommen.
Die FDA hat am 13. Januar 2011 eine Warnmeldung für Brentuximab Vedotin (Adcetris) herausgegeben, nachdem zwei Fälle von PML gemeldet wurden, wodurch sich die Gesamtzahl der damit verbundenen Fälle auf drei erhöht.
Verweise
- Zu Rhein, GM; Chou, SM (1965). „Partikel, die Papova-Viren in der menschlichen zerebralen Demyelinisierung ähneln“. Wissenschaft . 148 (3676): 1477–9. Bibcode : 1965Sci...148.1477R . doi : 10.1126/science.148.3676.1477 . PMID 14301897 . S2CID 35870720 .
- Silverman, L.; Rubinstein, LJ (1965). „Elektronenmikroskopische Beobachtungen an einem Fall von progressiver multifokaler Leukenzephalopathie“. Acta Neuropathologica . 5 (2): 215–224. doi : 10.1007/bf00686519 . PMID 5886201 . S2CID 2729823 .
Externe Links
- JC Hirninfektion MRT-Diagnose von PML
