Hydroborierungs-Oxidations-Reaktion - Hydroboration–oxidation reaction
Die Hydroborierungs-Oxidations-Reaktion ist eine zweistufige Hydratationsreaktion , bei der ein Alken in einen Alkohol umgewandelt wird . Das Verfahren führt zur syn-Addition eines Wasserstoffs und einer Hydroxylgruppe , wo die Doppelbindung gewesen war. Hydroborierung-Oxidation ist eine Anti-Markownikow- Reaktion, bei der die Hydroxylgruppe an den weniger substituierten Kohlenstoff anlagert. Die Reaktion bietet somit eine stereospezifischere und komplementärere regiochemische Alternative zu anderen Hydratationsreaktionen wie der säurekatalysierten Addition und dem Oxymercurierung-Reduktionsprozess . Die Reaktion wurde erstmals Ende der 1950er Jahre von Herbert C. Brown beschrieben und 1979 mit dem Nobelpreis für Chemie ausgezeichnet.
Die allgemeine Reaktionsform ist wie folgt:
Tetrahydrofuran (THF) ist das archetypische Lösungsmittel für die Hydroborierung.
Mechanismus und Umfang
Hydroborierungsschritt
Im ersten Schritt addiert Boran (BH 3 ) an die Doppelbindung und überträgt eines der Wasserstoffatome auf den Kohlenstoff neben dem, der an das Bor gebunden wird . Diese Hydroborierung wird zwei weitere Male wiederholt, wobei nacheinander jede BH-Bindung so reagiert, dass sich drei Alkene an jedes BH 3 addieren . Das resultierende Trialkylboran wird im zweiten Schritt mit Wasserstoffperoxid behandelt. Dieser Prozess ersetzt die BC-Bindungen durch HO-C-Bindungen. Das Borreagenz wird in Borsäure umgewandelt . Die Reaktion wurde ursprünglich 1957 von HC Brown für die Umwandlung von 1-Hexen in 1-Hexanol beschrieben .
Da die borhaltige Gruppe durch eine Hydroxylgruppe ersetzt wird, ist ersichtlich, dass der anfängliche Hydroborierungsschritt die Regioselektivität bestimmt. Die Hydroborierung verläuft in einer Anti-Markownikow- Weise. Die Reaktionssequenz ist auch stereospezifisch und führt zu einer syn-Addition (auf der gleichen Seite des Alkens): Die Hydroborierung ist syn-selektiv und die Oxidation ersetzt das Bor durch Hydroxyl mit der gleichen geometrischen Position. So reagiert 1-Methylcyclopenten mit Diboran überwiegend zu trans- 1-Hydroxy-2-methylcyclopentan – das neu hinzugefügte H und OH sind cis zueinander.
Bis alle an Bor gebundenen Wasserstoffe abtransportiert sind, wird die Borgruppe BH 2 weiter an weitere Alkene addieren. Dies bedeutet, dass ein Mol Hydroboran die Reaktion mit drei Mol Alken eingehen wird. Darüber hinaus ist es nicht erforderlich, dass das Hydroboran mehr als einen Wasserstoff aufweist. Beispielsweise werden üblicherweise Reagenzien des Typs R 2 BH verwendet, wobei R den Rest des Moleküls darstellen kann. Solche modifizierten Hydroborierungsreagenzien umfassen 9-BBN , Catecholboran und Disiamylboran .
Oxidationsschritt
Im zweiten Schritt der Reaktionssequenz greift das nukleophile Hydroperoxid- Anion das Boratom an. Alkylwanderung zu Sauerstoff gibt den Alkylboran mit Retention der Stereochemie (In Wirklichkeit erfolgt die Reaktion über das Trialkyl Borat B (OR) 3 , anstatt die Monoalkyl Borinsäure Ester BH 2 OR).
Das 'H'-Atom in der Reaktion stammt von B 2 H 6 , das 'O'-Atom stammt von Wasserstoffperoxid (H 2 O 2 ), während das O-gebundene 'H'-Atom vom Lösungsmittel stammt (siehe Mechanismus).
Alkinhydroborierung
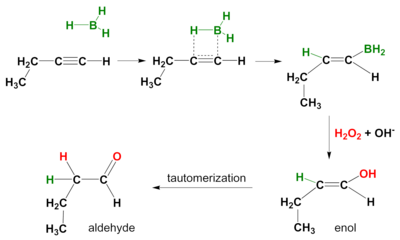
Auch an Alkinen findet eine Hydroborierungsreaktion statt . Auch hier ist die Wirkungsweise syn und sekundäre Reaktionsprodukte sind Aldehyde aus terminalen Alkinen und Ketone aus internen Alkinen. Um eine Hydroborierung über beide pi-Bindungen zu verhindern, wird ein sperriges Boran wie Disiamyl (di-sec-iso-amyl) Boran verwendet.
Alternative Oxidationen
Die Verwendung anderer Oxidationsmittel anstelle von Wasserstoffperoxid kann zu Carbonylprodukten anstelle von Alkoholen aus Alkenen führen. N- Methylmorpholin- N- oxid mit katalytischem Tetrapropylammoniumperruthenat wandelt das Alkylboran in ein Carbonyl um, also ein Keton- oder Aldehydprodukt , abhängig davon, welche anderen Gruppen an diesen Kohlenstoff im ursprünglichen Alken gebunden waren. Verschiedene Dichromate oder verwandte Chrom (VI)-Reagenzien ergeben auch Ketone, aber Carbonsäuren anstelle von Aldehyden für terminale Alkene.
Verweise
Externe Links
- Portal für Organische Chemie. Hydroborierung (einschließlich neuerer Literatur). https://www.organic-chemistry.org/namedreactions/brown-hydroboration.shtm