Hydroformylierung - Hydroformylation
| Hydroformylierung | |
|---|---|
| Reaktionstyp | Additionsreaktion |
| Bezeichner | |
| RSC- Ontologie-ID | RXNO:0000272 |
Die Hydroformylierung , auch Oxosynthese oder Oxoprozess genannt , ist ein technisches Verfahren zur Herstellung von Aldehyden aus Alkenen . Diese chemische Reaktion beinhaltet die Nettoaddition einer Formylgruppe (CHO) und eines Wasserstoffatoms an eine Kohlenstoff-Kohlenstoff-Doppelbindung. Dieses Verfahren hat seit seiner Erfindung ein kontinuierliches Wachstum erfahren: Die Produktionskapazität erreichte 1995 6,6 × 10 6 Tonnen. Dies ist wichtig, weil Aldehyde leicht in viele Nebenprodukte umgewandelt werden. Die entstehenden Aldehyde werden beispielsweise zu Alkoholen hydriert , die in Waschmittel umgewandelt werden . Hydroformylierung wird auch in Spezialchemikalien verwendet , die für die organische Synthese von Duftstoffen und Arzneimitteln relevant sind . Die Entwicklung der Hydroformylierung ist eine der wichtigsten Errungenschaften der industriellen Chemie des 20. Jahrhunderts .
Das Verfahren beinhaltet die Behandlung eines Alkens typischerweise mit hohen Drücken (zwischen 10 und 100 Atmosphären ) von Kohlenmonoxid und Wasserstoff bei Temperaturen zwischen 40 und 200 °C. In einer Variante wird Formaldehyd anstelle von Synthesegas verwendet. Übergangsmetall - Katalysatoren erforderlich sind. Der Katalysator löst sich ausnahmslos im Reaktionsmedium, dh die Hydroformylierung ist ein Beispiel für homogene Katalyse .
Geschichte
Das Verfahren wurde 1938 von dem deutschen Chemiker Otto Roelen bei Untersuchungen des Fischer-Tropsch-Verfahrens entdeckt . Aldehyde und Diethylketon wurden erhalten, wenn Ethylen in einen FT-Reaktor gegeben wurde. Durch diese Studien entdeckte Roelen die Nützlichkeit von Kobaltkatalysatoren. HCo(CO) 4 , das nur wenige Jahre vor Roelens Arbeiten isoliert wurde, erwies sich als ausgezeichneter Katalysator. Der Begriff Oxosynthese wurde von der Patentabteilung der Ruhrchemie geprägt, die davon ausging, dass das Verfahren sowohl für die Herstellung von Aldehyden als auch von Ketonen anwendbar ist. Nachfolgende Arbeiten zeigten, dass der Ligand Tributylphosphin (PBu 3 ) die Selektivität des kobaltkatalysierten Prozesses verbessert. Der Mechanismus der Co-katalysierten Hydroformylierung wurde in den 1960er Jahren von Richard F. Heck und David Breslow aufgeklärt .
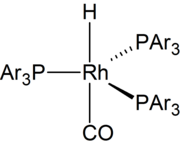
1968 wurde über hochaktive Katalysatoren auf Rhodiumbasis berichtet. Seit den 1970er Jahren beruht die meisten Hydroformylierung auf Katalysatoren auf Basis von Rhodium . Wasserlösliche Katalysatoren wurden entwickelt. Sie erleichtern die Abtrennung der Produkte vom Katalysator.
Mechanismus

Selektivität
Eine Schlüsselüberlegung bei der Hydroformylierung ist die "normale" vs. "iso"-Selektivität. Beispielsweise kann die Hydroformylierung von Propylen zwei isomere Produkte liefern , Butyraldehyd oder Isobutyraldehyd :
- H 2 + CO + CH 3 CH=CH 2 → CH 3 CH 2 CH 2 CHO ("normal")
- vs.
- H 2 + CO + CH 3 CH=CH 2 → (CH 3 ) 2 CHCHO ("iso")
Diese Isomere spiegeln die Regiochemie der Insertion des Alkens in die MH-Bindung wider. Da beide Produkte nicht gleichermaßen wünschenswert sind (normal ist stabiler als iso), wurde viel Forschung auf der Suche nach Katalysatoren verwendet, die das normale Isomer begünstigten.
Sterische Effekte
Markownikows Regeladdition des Cobalthydrids an primäre Alkene wird durch die sterische Hinderung zwischen dem Cobaltzentrum und dem sekundären Alkylliganden benachteiligt. Sperrige Liganden verstärken diese sterische Hinderung. Daher bieten die gemischten Carbonyl/Phosphin-Komplexe eine größere Selektivität für die Anti-Markownikow-Addition, wodurch geradkettige Produkte ( n -)-Aldehyde begünstigt werden . Moderne Katalysatoren beruhen zunehmend auf Chelatliganden, insbesondere Diphosphiten.
Elektronische Effekte
Außerdem sind elektronenreiche Hydridkomplexe weniger protonenähnlich. Folglich sind die elektronischen Effekte , die normalerweise die Markovnikov-Addition an ein Alken begünstigen, weniger anwendbar. Somit sind elektronenreiche Hydride selektiver.
Acylbildung
Um eine konkurrierende Isomerisierung des Alkens zu unterdrücken, muss die Geschwindigkeit der migratorischen Insertion des Carbonyls in die Kohlenstoff- Metall-Bindung des Alkyls relativ hoch sein. Die Insertionsrate des Carbonylkohlenstoffs in die CM-Bindung ist wahrscheinlich höher als die der Beta-Hydrid-Eliminierung.
Asymmetrische Hydroformylierung
Durch Hydroformylierung prochiraler Alkene entstehen neue Stereozentren . Verwendung von chiralen Phosphan - Liganden kann die Hydroformylierung zugeschnitten werden , um einen begünstigen Enantiomer . So kann beispielsweise Dexibuprofen , das (+)-(s)-Enantiomer von Ibuprofen , durch enantioselektive Hydroformylierung und anschließende Oxidation hergestellt werden.
Prozesse
Die technischen Verfahren variieren in Abhängigkeit von der Kettenlänge des zu hydroformylierenden Olefins, dem Katalysatormetall und den Liganden sowie der Rückgewinnung des Katalysators. Das ursprüngliche Ruhrchemie-Verfahren stellte Propanal aus Ethen und Syngas unter Verwendung von Kobalttetracarbonylhydrid her . Industrielle Verfahren auf Basis von Kobalt-Katalysatoren werden heute vor allem zur Herstellung mittel- bis langkettiger Olefine eingesetzt, während für die Hydroformylierung von Propen meist die Rhodium-basierten Katalysatoren eingesetzt werden . Die Rhodiumkatalysatoren sind deutlich teurer als Kobaltkatalysatoren. Bei der Hydroformylierung höhermolekularer Olefine ist die Abtrennung des Katalysators von den erzeugten Aldehyden schwierig.
BASF-Oxo-Prozess
Der BASF-Oxo-Prozess beginnt hauptsächlich mit höheren Olefinen und basiert auf einem Katalysator auf Kobaltcarbonyl-Basis. Wenn man die Reaktion bei niedrigen Temperaturen durchführt, beobachtet man eine erhöhte Selektivität zugunsten des linearen Produkts. Das Verfahren wird bei einem Druck von etwa 30 MPa und in einem Temperaturbereich von 150 bis 170 °C durchgeführt. Das Kobalt wird aus dem flüssigen Produkt durch Oxidation zu wasserlöslichem Co 2+ gewonnen , gefolgt von der Zugabe von wässriger Ameisen- oder Essigsäure . Bei diesem Verfahren entsteht eine wässrige Kobaltphase, die dann recycelt werden kann. Verluste werden durch die Zugabe von Kobaltsalzen ausgeglichen.
Exxon-Prozess
Das Exxon-Verfahren, auch Kuhlmann- oder PCUK-Oxo-Verfahren, wird zur Hydroformylierung von C6-C12-Olefinen eingesetzt. Das Verfahren beruht auf Kobaltkatalysatoren. Zur Rückgewinnung des Katalysators wird der organischen Phase eine wässrige Natronlauge oder Natriumcarbonat zugesetzt. Durch Extraktion mit Olefin und Neutralisation durch Zugabe von Schwefelsäurelösung unter Kohlenmonoxiddruck kann das Metallcarbonylhydrid zurückgewonnen werden. Dieses wird mit Syngas gestrippt, vom Olefin absorbiert und in den Reaktor zurückgeführt. Ähnlich dem BASF-Verfahren wird das Exxon-Verfahren bei einem Druck von etwa 30 MPa und einer Temperatur von etwa 160 bis 180 °C durchgeführt.
Shell-Prozess
Der Shell-Prozess verwendet mit Phosphanliganden modifizierte Kobaltkomplexe zur Hydroformylierung von C7-C14-Olefinen. Die entstehenden Aldehyde werden direkt zu den Fettalkoholen hydriert, die destillativ abgetrennt werden , was eine Rückführung des Katalysators ermöglicht. Das Verfahren weist eine gute Selektivität für lineare Produkte auf, die als Einsatzmaterial für Waschmittel Verwendung finden . Der Prozess wird bei einem Druck von ca. 4 bis 8 MPa und in einem Temperaturbereich von ca. 150–190 °C durchgeführt.
Union Carbide-Verfahren
Das Union Carbide (UCC)-Verfahren, auch bekannt als Niederdruck-Oxo-Verfahren (LPO), beruht auf einem Rhodium-Katalysator, der in hochsiedenden dicken Ölen, einem höhermolekularen Kondensationsprodukt der primären Aldehyde, für die Hydroformylierung von Propen gelöst ist. Das Reaktionsgemisch wird in einem Fallfilmverdampfer von flüchtigen Bestandteilen getrennt. Die flüssige Phase wird destilliert und Butyraldehyd als Kopfprodukt abgetrennt, während das katalysatorhaltige Sumpfprodukt in den Prozess zurückgeführt wird. Der Prozess wird bei ca. 1,8 MPa und 95–100 °C durchgeführt.

Ruhrchemie/Rhone-Poulenc-Verfahren
Das Ruhrchemie/Rhone-Poulenc-Verfahren (RCRPP) setzt zur Hydroformylierung von Propen auf einen Rhodiumkatalysator mit wasserlöslichem TPPTS als Ligand (Kuntz Cornils-Katalysator). Die tri- Sulfonierung von Triphenylphosphan - Liganden enthält hydrophile Eigenschaften an den organometallischen Komplex. Der Katalysatorkomplex trägt neun Sulfonatgruppen und ist gut wasserlöslich (ca. 1 kg L −1 ), jedoch nicht in der entstehenden Produktphase. Das wasserlösliche TPPTS wird im ca. 50-fachen Überschuss eingesetzt, wodurch das Auswaschen des Katalysators wirksam unterdrückt wird. Edukte sind Propen und Syngas bestehend aus Wasserstoff und Kohlenmonoxid im Verhältnis 1,1:1. Es entsteht ein Gemisch aus Butyraldehyd und Isobutyraldehyd im Verhältnis 96:4 mit wenigen Nebenprodukten wie Alkoholen, Estern und höhersiedenden Anteilen. Das Ruhrchemie/Rhone-Poulenc-Verfahren ist das erste kommerziell erhältliche Zweiphasensystem, bei dem der Katalysator in wässriger Phase vorliegt. Im Verlauf der Reaktion bildet sich eine organische Produktphase, die mittels Phasentrennung kontinuierlich abgetrennt wird, wobei die wässrige Katalysatorphase im Reaktor verbleibt.
Das Verfahren wird in einem Rührkesselreaktor durchgeführt, in dem das Olefin und das Synthesegas vom Boden des Reaktors durch die Katalysatorphase unter intensivem Rühren mitgerissen werden. Die resultierende Aldehyd-Rohphase wird über Kopf von der wässrigen Phase getrennt. Die wässrige katalysatorhaltige Lösung wird über einen Wärmetauscher wieder erwärmt und in den Reaktor zurückgepumpt. Das überschüssige Olefin und Syngas wird in einem Stripper von der Aldehydphase abgetrennt und dem Reaktor wieder zugeführt. Die entstehende Wärme wird zur Erzeugung von Prozessdampf genutzt, der zur anschließenden Destillation der organischen Phase zur Trennung in Butyraldehyd und Isobutyraldehyd verwendet wird. Potentielle Katalysatorgifte aus dem Synthesegas wandern in die organische Phase und werden aus der Reaktion mit dem Aldehyd entfernt. Somit kommt es zu keiner Anreicherung von Katalysatorgiften und die aufwendige Feinreinigung des Synthesegases kann entfallen.
1984 wurde in Oberhausen eine Anlage gebaut , die 1988 und 1998 bis auf eine Produktionskapazität von 500.000 t/a Butanal entstaut wurde. Der Propenumsatz beträgt 98 % und die Selektivität zu n-Butanal ist hoch. Während der Lebensdauer einer Katalysatorcharge gehen im Prozess weniger als 1 ppb Rhodium verloren.
Laborprozess
Für die Hydroformylierung im Labormaßstab wurden Rezepturen entwickelt, zB von Cyclohexen .
Andere Substrate als Alkene
Kobaltcarbonyl- und Rhodiumkomplexe katalysieren die Hydroformylierung von Formaldehyd und Ethylenoxid zu Hydroxyacetaldehyd und 3-Hydroxypropanal , die dann zu Ethylenglycol bzw. Propan-1,3-diol hydriert werden können. Die Reaktionen funktionieren am besten, wenn das Lösungsmittel basisch ist (wie Pyridin ).
Bei Dicobaltoctacarbonyl oder Co 2 (CO) 8 als Katalysator kann Pentan-3-on in Abwesenheit von Wasserstoff aus Ethen und CO entstehen. Ein vorgeschlagenes Zwischenprodukt ist die Ethylen-Propionyl-Spezies [CH 3 C(O)Co(CO) 3 (Ethen)], die eine migratorische Insertion eingeht , um [CH 3 COCH 2 CH 2 Co(CO) 3 ] zu bilden. Der benötigte Wasserstoff entsteht durch die Wasser-Shift-Reaktion . Einzelheiten finden Sie unter
Wenn die Wasserumwandlungsreaktion nicht funktioniert, liefert die Reaktion ein Polymer, das alternierende Kohlenmonoxid- und Ethyleneinheiten enthält. Solche aliphatischen Polyketone werden herkömmlicher unter Verwendung von Palladiumkatalysatoren hergestellt.
Funktionalisierte Olefine wie Allylalkohol können hydroformyliert werden. Das Zielprodukt 1,4-Butandiol und sein Isomer wird mit isomerisierungsfreien Katalysatoren wie Rhodium-Triphenylphosphin-Komplexen erhalten. Die Verwendung des Kobaltkomplexes führt durch Isomerisierung der Doppelbindung zu n- Propanal . Die Hydroformylierung von Alkenylethern und Alkenylestern erfolgt üblicherweise in α-Stellung zur Ether- oder Esterfunktion.
Die Hydroformylierung von Acrylsäure und Methacrylsäure im Rhodium-katalysierten Verfahren führt im ersten Schritt zum Markovnikov-Produkt . Durch Variation der Reaktionsbedingungen kann die Reaktion auf unterschiedliche Produkte ausgerichtet werden. Eine hohe Reaktionstemperatur und ein niedriger Kohlenmonoxiddruck begünstigen die Isomerisierung des Markownikow-Produkts zum thermodynamisch stabileren β-Isomer, das zum n-Aldehyd führt. Niedrige Temperaturen und hoher Kohlenmonoxiddruck sowie ein Überschuss an Phosphin, das freie Koordinationsstellen blockiert, können zu einer schnelleren Hydroformylierung in α-Stellung zur Estergruppe führen und die Isomerisierung unterdrücken.
Neben- und Folgereaktionen
Alkene
Nebenreaktionen der Alkene sind die Isomerisierung und Hydrierung der Doppelbindung. Während die aus der Hydrierung der Doppelbindung resultierenden Alkane nicht weiter an der Reaktion teilnehmen, ist die Isomerisierung der Doppelbindung mit anschließender Bildung der n-Alkylkomplexe eine erwünschte Reaktion. Die Hydrierung ist meist von untergeordneter Bedeutung; Kobalt-Phosphin-modifizierte Katalysatoren können jedoch eine erhöhte Hydrierungsaktivität aufweisen, wobei bis zu 15 % des Alkens hydriert werden.
Aldehyde
Eine meist erwünschte Folgereaktion ist die Hydrierung der Aldehyde zu Alkoholen. Höhere Temperaturen und Wasserstoffpartialdrücke begünstigen die Hydrierung des resultierenden Aldehyds zum Alkohol. Für den Reaktionsmechanismus wird angenommen, dass der Aldehyd zunächst mit dem Katalysator einen CO-π-Komplex bildet. Dieser wird zum Alkoxidkomplex umgelagert und durch anschließende oxidative Wasserstoffaddition wird der Alkohol abgespalten und der Ausgangskomplex gebildet.
Die aldehydische Kohlenstoff-Sauerstoff-Doppelbindung kann auch einer Hydroformylierung unterzogen werden, die zu Ameisensäure und deren Estern führt. Die Reaktion erfordert die Insertion von Kohlenmonoxid in die Sauerstoff-Metall-Bindung des Alkoxidkomplexes. Der resultierende Formylkomplex kann durch oxidative Wasserstoffaddition in die Ameisensäureester und den Ausgangskomplex überführt werden. Die zunächst erzeugten Aldehyde können durch Aldolkondensation entweder zu Zielproduktvorläufern wie 2-Ethylhexenal oder höhermolekularen Kondensationsprodukten, sogenanntem Dicköl, weiterreagieren.
Katalysator und Liganden
Bedingungen für die Hydroformylierungskatalyse können den Abbau von tragenden Organophosphorliganden induzieren. Triphenylphosphin unterliegt einer Hydrogenolyse , wobei Benzol und Diphenylphosphin freigesetzt werden. Die Insertion von Kohlenmonoxid in eine intermediäre Metall-Phenyl-Bindung kann zur Bildung von Benzaldehyd oder durch nachfolgende Hydrierung zu Benzylalkohol führen . Eine der Liganden-Phenylgruppen kann durch Propen ersetzt werden, und der resultierende Diphenylpropylphosphin-Ligand kann die Hydroformylierungsreaktion aufgrund seiner erhöhten Basizität hemmen.
Verweise
Weiterlesen
- „Angewandte homogene Katalyse mit metallorganischen Verbindungen: Ein umfassendes Handbuch in zwei Bänden (Paperback) von Boy Cornils (Herausgeber), WA Herrmann (Herausgeber). ISBN 3-527-29594-1
- "Rhodium Catalyzed Hydroformylation" PWNM van Leeuwen, C. Claver Eds.; Springer; (2002). ISBN 1-4020-0421-4
- „Homogene Katalyse: Die Kunst verstehen“ von Piet WNM van Leeuwen Springer; 2005. ISBN 1-4020-3176-9
- Imyanitov NS/ Hydroformylierung von Olefinen mit Rhodiumkomplexen // Rhodium Express. 1995. Nr. 10–11 (Mai). S. 3–62 (dt.).ISSN [https://www.worldcat.org/search?fq=x0:jrnl&q=n2:0869-7876 0869-7876]




