Tonus - Tonicity
Tonizität ist ein Maß für den effektiven osmotischen Druckgradienten; das Wasserpotential zweier Lösungen, die durch eine semipermeable Zellmembran getrennt sind. Die Tonizität hängt von der relativen Konzentration von selektiv membrandurchlässigen gelösten Stoffen über eine Zellmembran ab, die die Richtung und das Ausmaß des osmotischen Flusses bestimmen. Es wird häufig verwendet, wenn die Schwellungs- und Schrumpfungsreaktion von Zellen beschrieben wird, die in eine externe Lösung eingetaucht sind.
Im Gegensatz zum osmotischen Druck wird die Tonizität nur durch gelöste Stoffe beeinflusst, die die Membran nicht passieren können, da nur diese einen wirksamen osmotischen Druck ausüben. Gelöste Stoffe, die die Membran frei passieren können, haben keinen Einfluss auf die Tonizität, da sie immer mit gleichen Konzentrationen auf beiden Seiten der Membran ohne Netto-Lösemittelbewegung äquilibrieren. Es ist auch ein Faktor, der die Imbibition beeinflusst .
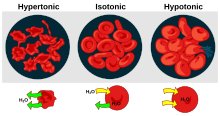
Es gibt drei Klassifikationen der Tonizität, die eine Lösung im Verhältnis zu einer anderen haben kann: hypertonisch , hypotonisch und isotonisch. Ein Beispiel für eine hypotonische Lösung ist Salzwasser.
Hypertonische Lösung

Eine hypertone Lösung hat eine höhere Konzentration an gelösten Stoffen als eine andere Lösung. In der Biologie bezieht sich die Tonizität einer Lösung normalerweise auf ihre Konzentration des gelösten Stoffes im Verhältnis zu der einer anderen Lösung auf der gegenüberliegenden Seite einer Zellmembran ; eine Lösung außerhalb einer Zelle wird als hypertonisch bezeichnet, wenn sie eine höhere Konzentration an gelösten Stoffen aufweist als das Zytosol innerhalb der Zelle. Wenn eine Zelle in eine hypertonische Lösung eingetaucht wird, neigt der osmotische Druck dazu, das Wasser dazu zu zwingen, aus der Zelle zu fließen, um die Konzentrationen der gelösten Stoffe auf beiden Seiten der Zellmembran auszugleichen. Das Zytosol wird umgekehrt als hypotonisch kategorisiert, im Gegensatz zur äußeren Lösung.
Wenn sich Pflanzenzellen in einer hypertonischen Lösung befinden, zieht sich die flexible Zellmembran von der starren Zellwand weg , bleibt jedoch an Punkten, die als Plasmodesmen bezeichnet werden, mit der Zellwand verbunden . Die Zellen nehmen oft das Aussehen eines Nadelkissens an , und die Plasmodesmen hören fast auf zu funktionieren, weil sie sich verengen, ein Zustand, der als Plasmolyse bekannt ist . In Pflanzenzellen können die Begriffe isotonisch, hypotonisch und hypertonisch nicht genau verwendet werden, da der von der Zellwand ausgeübte Druck den osmotischen Gleichgewichtspunkt erheblich beeinflusst.
Einige Organismen haben komplizierte Methoden entwickelt, um Hypertonie zu umgehen. Salzwasser ist zum Beispiel hypertonisch für die darin lebenden Fische . Da die Fische für den Gasaustausch eine große Oberfläche in ihren Kiemen in Kontakt mit Meerwasser benötigen , geben sie osmotisch Wasser aus Kiemenzellen an das Meer ab. Sie reagieren auf den Verlust, indem sie große Mengen Salzwasser trinken und das überschüssige Salz aktiv ausscheiden . Dieser Vorgang wird Osmoregulation genannt .
Hypotonische Lösung
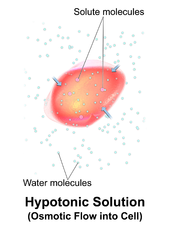
Eine hypotone Lösung hat eine geringere Konzentration an gelösten Stoffen als eine andere Lösung. In der Biologie wird eine Lösung außerhalb einer Zelle als hypotonisch bezeichnet, wenn sie eine niedrigere Konzentration an gelösten Stoffen als das Zytosol aufweist . Aufgrund des osmotischen Drucks diffundiert Wasser in die Zelle, und die Zelle erscheint oft geschwollen oder aufgebläht. Bei Zellen ohne Zellwand, wie z. B. tierischen Zellen, kann, wenn der Gradient groß genug ist, die Aufnahme von überschüssigem Wasser genügend Druck erzeugen, um eine Zytolyse oder ein Aufbrechen der Zelle zu induzieren . Wenn sich Pflanzenzellen in einer hypotonischen Lösung befinden, nimmt die zentrale Vakuole zusätzliches Wasser auf und drückt die Zellmembran gegen die Zellwand. Durch die Starrheit der Zellwand drückt sie zurück und verhindert so das Platzen der Zelle. Dies wird Turgordruck genannt .
Isotonie
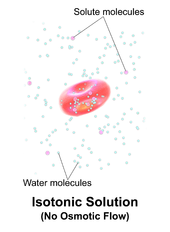
Eine Lösung ist isotonisch, wenn ihre effektive Osmolkonzentration der einer anderen Lösung entspricht. In der Biologie sind die Lösungen auf beiden Seiten einer Zellmembran isotonisch, wenn die Konzentration der gelösten Stoffe außerhalb der Zelle gleich der Konzentration der gelösten Stoffe innerhalb der Zelle ist. In diesem Fall schwillt die Zelle weder an noch schrumpft sie, da kein Konzentrationsgradient vorhanden ist, der die Diffusion großer Wassermengen durch die Zellmembran induziert. Wassermoleküle diffundieren frei durch die Plasmamembran in beide Richtungen, und da die Wasserdiffusionsrate in jede Richtung gleich ist, wird die Zelle weder Wasser aufnehmen noch verlieren.
Eine isoosmolare Lösung kann hypoton sein, wenn der gelöste Stoff die Zellmembran durchdringen kann. Zum Beispiel ist eine isoosmolare Harnstofflösung hypotonisch für rote Blutkörperchen und verursacht deren Lyse . Dies ist darauf zurückzuführen, dass Harnstoff entlang seines Konzentrationsgradienten in die Zelle eindringt, gefolgt von Wasser. Die Osmolarität von normaler Kochsalzlösung , 9 Gramm NaCl gelöst in Wasser auf ein Gesamtvolumen von einem Liter, ist eine enge Annäherung an die Osmolarität von NaCl im Blut (ca. 290 mOsm / l ). Somit ist normale Kochsalzlösung fast isotonisch zu Blutplasma. Im Gegensatz zu Harnstoff können weder Natrium- noch Chloridionen die Plasmamembran ungehindert passieren .