Insulin - Insulin
Insulin ( / ɪ n . Sj ʊ . L ɪ n / , aus lateinischen insula , 'Insel') ist ein Peptidhormon , produziert von Beta - Zellen der Pankreasinseln ; es gilt als das wichtigste anabole Hormon des Körpers. Es reguliert den Stoffwechsel von Kohlenhydraten , Fetten und Proteinen, indem es die Aufnahme von Glukose aus dem Blut in Leber- , Fett- und Skelettmuskelzellen fördert . In diesen Geweben wird die absorbierte Glucose umgewandelt entweder in Glykogen über Glykogenese oder Fette ( Triglyceride ) über die Lipogenese , oder, im Fall der Leber, in beide. Die Glukoseproduktion und -sekretion der Leber wird durch hohe Insulinkonzentrationen im Blut stark gehemmt. Das zirkulierende Insulin beeinflusst auch die Synthese von Proteinen in einer Vielzahl von Geweben. Es ist daher ein anaboles Hormon, das die Umwandlung kleiner Moleküle im Blut in große Moleküle innerhalb der Zellen fördert. Niedrige Insulinspiegel im Blut haben den gegenteiligen Effekt, indem sie einen weit verbreiteten Katabolismus , insbesondere von Reservekörperfett, fördern .
Beta-Zellen reagieren empfindlich auf den Blutzuckerspiegel, so dass sie als Reaktion auf einen hohen Glukosespiegel Insulin in das Blut absondern; und hemmen die Sekretion von Insulin, wenn der Glukosespiegel niedrig ist. Insulin verbessert die Glukoseaufnahme und den Stoffwechsel in den Zellen und senkt dadurch den Blutzuckerspiegel. Ihre benachbarten Alpha-Zellen scheiden Glucagon in umgekehrter Weise ins Blut aus, indem sie ihre Signale von den Beta-Zellen ableiten : erhöhte Sekretion, wenn der Blutzucker niedrig ist, und verminderte Sekretion, wenn der Glukosespiegel hoch ist. Glucagon erhöht den Blutzuckerspiegel, indem es die Glykogenolyse und Gluconeogenese in der Leber stimuliert . Die Ausschüttung von Insulin und Glucagon in das Blut als Reaktion auf die Blutglukosekonzentration ist der Hauptmechanismus der Glukosehomöostase .
Eine verminderte oder fehlende Insulinaktivität führt zu Diabetes mellitus , einem Zustand mit hohem Blutzuckerspiegel (Hyperglykämie). Es gibt zwei Arten der Krankheit. Bei Diabetes mellitus Typ 1 werden die Betazellen durch eine Autoimmunreaktion zerstört, sodass kein Insulin mehr synthetisiert oder ins Blut ausgeschieden werden kann. Bei Diabetes mellitus Typ 2 ist die Zerstörung der Betazellen weniger ausgeprägt als bei Typ 1 und ist nicht auf einen Autoimmunprozess zurückzuführen. Stattdessen kommt es zu einer Ansammlung von Amyloid in den Pankreasinseln, was wahrscheinlich deren Anatomie und Physiologie stört. Die Pathogenese von Typ-2-Diabetes ist nicht gut verstanden, aber es ist bekannt, dass eine reduzierte Population von Beta-Inselzellen, eine reduzierte sekretorische Funktion von überlebenden Beta-Inselzellen und eine Insulinresistenz des peripheren Gewebes beteiligt sind. Typ-2-Diabetes ist durch eine erhöhte Glucagon-Sekretion gekennzeichnet, die von der Blutglucosekonzentration nicht beeinflusst wird und nicht darauf anspricht. Aber Insulin wird immer noch als Reaktion auf den Blutzucker ins Blut ausgeschüttet. Dadurch reichert sich Glukose im Blut an.
Das Humaninsulinprotein besteht aus 51 Aminosäuren und hat eine Molekülmasse von 5808 Da . Es ist ein hetero - Dimer einer A-Kette und eine B-Kette, die durch miteinander verbunden sind Disulfidbindungen . Insulin Struktur variiert leicht zwischen Arten von Tieren. Insulin aus tierischen Quellen unterscheidet sich aufgrund dieser Variationen etwas in der Wirksamkeit (in Bezug auf die Wirkungen des Kohlenhydratstoffwechsels ) von Humaninsulin. Schweineinsulin ist der menschlichen Version besonders nahe und wurde häufig zur Behandlung von Typ-1-Diabetikern verwendet, bevor Humaninsulin in großen Mengen durch rekombinante DNA- Technologien hergestellt werden konnte.
Insulin war das erste entdeckte Peptidhormon. Frederick Banting und Charles Herbert Best , die im Labor von JJR Macleod an der University of Toronto arbeiteten , waren die ersten, die 1921 Insulin aus der Bauchspeicheldrüse von Hunden isolierten. Frederick Sanger sequenzierte 1951 die Aminosäurestruktur, was Insulin zum ersten Protein machte vollständig sequenziert. Die Kristallstruktur von Insulin im Festkörper wurde 1969 von Dorothy Hodgkin bestimmt . Insulin ist auch das erste Protein, das chemisch synthetisiert und mittels DNA-rekombinanter Technologie hergestellt wurde . Es steht auf der WHO Model List of Essential Medicines , den wichtigsten Medikamenten , die in einem Basisgesundheitssystem benötigt werden .
Evolution und Artenverteilung
Insulin könnte vor mehr als einer Milliarde Jahren entstanden sein. Die molekularen Ursprünge des Insulins reichen mindestens bis zu den einfachsten einzelligen Eukaryoten zurück . Abgesehen von Tieren sind insulinähnliche Proteine auch in den Reichen der Pilze und Protisten bekannt.
Insulin wird bei den meisten Wirbeltieren von Betazellen der Pankreasinseln und bei einigen Knochenfischen vom Brockmann-Körper produziert . Kegelschnecken Conus geographus und Conus tulipa , giftige Meeresschnecken, die kleine Fische jagen, verwenden modifizierte Formen von Insulin in ihren Giftcocktails. Das Insulin-Toxin, das in seiner Struktur dem von Fischen ähnlicher ist als dem von Schnecken, bremst die Beutefische, indem es ihren Blutzuckerspiegel senkt.
Gen
Der Präproinsulin- Vorläufer von Insulin wird vom INS- Gen kodiert , das sich auf Chromosom 11p15.5 befindet. Bei einigen Säugetieren, wie Ratten und Mäusen, gibt es zwei Insulingene, von denen eines das Homolog der meisten Säugetiergene ( Ins2 ) ist und das andere eine retroponierte Kopie ist, die eine Promotorsequenz enthält, aber ein Intron fehlt ( Eins1 )). Beide Nagetier-Insulingene sind funktionsfähig.
Allele
eine Vielzahl von mutierten Allelen mit Veränderungen in der kodierenden Region wurden identifiziert. Ein Durchlese-Gene , IN-IGF2, Überlappungen mit diesem Gen am 5' - Region und mit der IGF2 - Gen am 3' - Region.
Verordnung
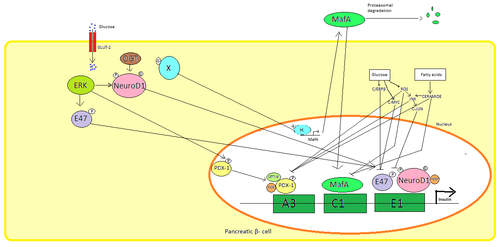
In den β-Zellen der Bauchspeicheldrüse ist Glukose der primäre physiologische Stimulus für die Regulierung der Insulinsynthese. Insulin wird hauptsächlich durch die Transkriptionsfaktoren PDX1 , NeuroD1 und MafA reguliert .
Während eines niedrigen Glukosezustands befindet sich PDX1 (Pankreas- und Duodenal-Homeobox-Protein 1) als Folge der Interaktion mit HDAC1 und 2 in der Kernperipherie, was zu einer Herunterregulierung der Insulinsekretion führt. Ein Anstieg des Blutzuckerspiegels verursacht eine Phosphorylierung von PDX1 , was dazu führt, dass es eine Kerntranslokation durchmacht und das A3-Element innerhalb des Insulinpromotors bindet. Bei der Translokation interagiert es mit den Coaktivatoren HAT p300 und SETD7 . PDX1 beeinflusst die Histonmodifikationen durch Acetylierung und Deacetylierung sowie Methylierung . Es soll auch Glukagon unterdrücken .
NeuroD1 , auch bekannt als β2, reguliert die Insulinexozytose in Pankreas- β-Zellen, indem es direkt die Expression von Genen induziert, die an der Exozytose beteiligt sind. Es ist in der lokalisierten Cytosol , aber in Reaktion auf hohe Glukose wird es glykosyliert durch OGT und / oder phosphoryliert durch ERK , die Translokation in den Zellkern führt. Im Kern heterodimerisiert β2 mit E47 , bindet an das E1-Element des Insulinpromotors und rekrutiert den Co-Aktivator p300, der β2 acetyliert. Es ist in der Lage, mit anderen Transkriptionsfaktoren sowie bei der Aktivierung des Insulin-Gens zu interagieren.
MafA wird bei niedrigen Blutzuckerspiegeln durch Proteasomen abgebaut . Erhöhte Glukosespiegel machen ein unbekanntes Protein glykosyliert . Dieses Protein wirkt auf unbekannte Weise als Transkriptionsfaktor für MafA und MafA wird aus der Zelle transportiert. MafA wird dann zurück in den Zellkern transloziert, wo es das C1-Element des Insulinpromotors bindet.
Diese Transkriptionsfaktoren wirken synergistisch und in komplexer Anordnung. Erhöhter Blutzucker kann nach einiger Zeit die Bindungskapazitäten dieser Proteine zerstören und somit die Insulinausschüttung reduzieren, was zu Diabetes führt . Die verminderten Bindungsaktivitäten können durch Glucose- induzierten oxidativen Stress vermittelt werden, und Antioxidantien sollen die verminderte Insulinsekretion in glukotoxischen pankreatischen β-Zellen verhindern . Stress-Signalmoleküle und reaktive Sauerstoffspezies hemmen das Insulin-Gen, indem sie die Kofaktoren, die die Transkriptionsfaktoren binden, und die Transkriptionsfaktoren selbst stören.
Mehrere regulatorische Sequenzen in der Promotorregion des Humaninsulingens binden an Transkriptionsfaktoren . Im Allgemeinen binden die A-Boxen an Pdx1- Faktoren, E-Boxen binden an NeuroD , C-Boxen binden an MafA und cAMP-Antwortelemente an CREB . Es gibt auch Schalldämpfer , die die Transkription hemmen.
| Regulatorischer Ablauf | Bindung von Transkriptionsfaktoren |
|---|---|
| ILPR | Par1 |
| A5 | Pdx1 |
| negatives regulatorisches Element (NRE) | Glukokortikoid-Rezeptor , Oct1 |
| Z (überlappende NRE und C2) | ISF |
| C2 | Pax4 , MafA (?) |
| E2 | USF1 / USF2 |
| A3 | Pdx1 |
| CREB RE | CREB , CREM |
| A2 | – |
| CAAT-Enhancer-Bindung (CEB) (teilweise überlappend A2 und C1) | – |
| C1 | – |
| E1 | E2A , NeuroD1 , HEB |
| A1 | Pdx1 |
| G1 | – |
Struktur

Entgegen einer anfänglichen Annahme, dass Hormone im Allgemeinen kleine chemische Moleküle sind, stellte sich heraus, dass Insulin als das erste Peptidhormon, das von seiner Struktur bekannt ist, ziemlich groß ist. Ein einzelnes Protein (Monomer) des Humaninsulins besteht aus 51 Aminosäuren und hat eine Molekülmasse von 5808 Da . Die Summenformel von Humaninsulin ist C 257 H 383 N 65 O 77 S 6 . Es ist eine Kombination aus zwei Peptidketten ( Dimer ), die als A-Kette und B-Kette bezeichnet werden und durch zwei Disulfidbrücken miteinander verbunden sind . Die A-Kette besteht aus 21 Aminosäuren, während die B-Kette aus 30 Resten besteht. Die verbindenden Disulfidbindungen (zwischen den Ketten) werden an Cysteinresten zwischen den Positionen A7-B7 und A20-B19 gebildet. Es gibt eine zusätzliche (intrakettige) Disulfidbindung innerhalb der A-Kette zwischen den Cysteinresten an den Positionen A6 und A11. Die A-Kette weist zwei α-helikale Regionen bei A1-A8 und A12-A19 auf, die antiparallel sind; während die B-Kette eine zentrale α-Helix (die die Reste B9-B19 abdeckt), flankiert von der Disulfidbindung auf beiden Seiten und zwei β-Faltblätter (die B7-B10 und B20-B23 abdecken) aufweist.
Die Aminosäuresequenz von Insulin ist stark konserviert und variiert zwischen den Spezies nur geringfügig. Rinderinsulin unterscheidet sich von Human in nur drei Aminosäureresten und Schweineinsulin in einem. Sogar Insulin von einigen Fischarten ist dem Menschen ähnlich genug, um beim Menschen klinisch wirksam zu sein. Insulin bei einigen Wirbellosen ist in der Sequenz dem Humaninsulin ziemlich ähnlich und hat ähnliche physiologische Wirkungen. Die starke Homologie, die in der Insulinsequenz verschiedener Arten beobachtet wird, legt nahe, dass sie über einen Großteil der Evolutionsgeschichte der Tiere hinweg konserviert wurde. Das C-Peptid von Proinsulin unterscheidet sich jedoch viel stärker zwischen den Arten; es ist auch ein Hormon, aber ein sekundäres.
Insulin wird im Körper als Hexamer (eine Einheit von sechs Insulinmolekülen) produziert und gespeichert, während die aktive Form das Monomer ist. Das Hexamer ist etwa 36000 Da groß. Die sechs Moleküle sind als drei dimere Einheiten miteinander verbunden, um ein symmetrisches Molekül zu bilden. Ein wichtiges Merkmal ist das Vorhandensein von Zinkatomen (Zn 2+ ) auf der Symmetrieachse, die von drei Wassermolekülen und drei Histaminresten an Position B10 umgeben sind.
Das Hexamer ist eine inaktive Form mit Langzeitstabilität, die dazu dient, das hochreaktive Insulin geschützt und dennoch leicht verfügbar zu halten. Die Hexamer-Monomer-Umwandlung ist einer der zentralen Aspekte von Insulinformulierungen zur Injektion. Das Hexamer ist weitaus stabiler als das Monomer, was aus praktischen Gründen wünschenswert ist; das Monomer ist jedoch ein viel schneller reagierendes Arzneimittel, da die Diffusionsrate umgekehrt zur Partikelgröße korreliert. Ein schnell reagierendes Medikament bedeutet, dass die Insulininjektionen den Mahlzeiten nicht stundenlang vorausgehen müssen, was wiederum Menschen mit Diabetes mehr Flexibilität in ihrem Tagesablauf gibt. Insulin kann fibrilläre ineinandergreifende Beta-Blätter aggregieren und bilden . Dies kann zu einer Injektions- Amyloidose führen und verhindert die Speicherung von Insulin über einen längeren Zeitraum.
Synthese, physiologische Wirkungen und Abbau
Synthese
Insulin wird in der Bauchspeicheldrüse und im Brockmann-Körper (bei einigen Fischen) produziert und freigesetzt, wenn einer von mehreren Reizen erkannt wird. Zu diesen Reizen gehört der Anstieg der Plasmakonzentrationen von Aminosäuren und Glukose, die aus der Verdauung der Nahrung resultieren. Kohlenhydrate können Polymere von Einfachzuckern oder die Einfachzucker selbst sein. Wenn die Kohlenhydrate Glukose enthalten, wird diese Glukose in den Blutkreislauf aufgenommen und der Blutzuckerspiegel beginnt zu steigen. In Zielzellen, initiiert eine Insulin - Signaltransduktion , die die Wirkung der Erhöhung hat Glukoseaufnahme und -speicherung. Schließlich wird Insulin abgebaut, wodurch die Reaktion beendet wird.

Bei Säugetieren wird Insulin in der Bauchspeicheldrüse innerhalb der Betazellen synthetisiert. Eine Million bis drei Millionen Pankreasinseln bilden den endokrinen Teil der Bauchspeicheldrüse, der in erster Linie eine exokrine Drüse ist . Der endokrine Anteil macht nur 2% oder weniger der Gesamtmasse der Bauchspeicheldrüse aus. Innerhalb der Pankreasinseln machen Betazellen 70–90% aller Zellen aus.
Insulin besteht aus zwei Polypeptidketten, den A- und B-Ketten, die durch Disulfidbrücken miteinander verbunden sind. Es wird jedoch zuerst als einzelnes Polypeptid namens Präproinsulin in Betazellen synthetisiert. Preproinsulin enthält ein 24-Reste- Signalpeptid , das die entstehende Polypeptidkette zum rauen endoplasmatischen Retikulum (RER) leitet . Das Signalpeptid wird gespalten, wenn das Polypeptid in das Lumen des RER transloziert wird, wodurch Proinsulin gebildet wird . Im RER faltet sich das Proinsulin in die richtige Konformation und es werden 3 Disulfidbrücken gebildet. Etwa 5–10 min nach seiner Montage im endoplasmatischen Retikulum wird Proinsulin zum Trans-Golgi-Netzwerk (TGN) transportiert, wo sich unreife Granula bilden. Der Transport zum TGN kann etwa 30 Minuten dauern.
Proinsulin erfährt Reifung in aktives Insulin durch die Wirkung von zellulärem Endopeptidasen als bekannt Prohormonkonvertasen ( PC1 und PC2 ), sowie die Exoprotease Carboxypeptidase E . Die Endopeptidasen spalten an 2 Positionen, setzen ein Fragment frei, das als C-Peptid bezeichnet wird , und hinterlassen 2 Peptidketten, die B- und A-Ketten, die durch 2 Disulfidbrücken verbunden sind. Die Schnittstellen befinden sich jeweils nach einem Paar basischer Reste (Lysin-64 und Arginin-65 sowie Arginin-31 und -32). Nach Spaltung des C-Peptids werden diese 2 Paare basischer Reste durch die Carboxypeptidase entfernt. Das C-Peptid ist der zentrale Teil von Proinsulin, und die Primärsequenz von Proinsulin geht in die Reihenfolge "BCA" (die B- und A-Ketten wurden anhand der Masse identifiziert und das C-Peptid wurde später entdeckt).
Das resultierende reife Insulin ist in reife Granula verpackt und wartet darauf, dass Stoffwechselsignale (wie Leucin, Arginin, Glukose und Mannose) und Vagusnervstimulation von der Zelle in den Kreislauf exocytiert werden.
Die körpereigene Produktion von Insulin wird entlang des Syntheseweges in mehreren Schritten reguliert:
- Bei der Transkription vom Insulin-Gen
- In der mRNA- Stabilität
- Bei der mRNA-Übersetzung
- Bei den posttranslationalen Modifikationen
Es wurde gezeigt, dass Insulin und seine verwandten Proteine im Gehirn produziert werden, und reduzierte Mengen dieser Proteine werden mit der Alzheimer-Krankheit in Verbindung gebracht.
Die Insulinfreisetzung wird auch durch Beta-2-Rezeptorstimulation stimuliert und durch Alpha-1-Rezeptorstimulation gehemmt. Darüber hinaus antagonisieren Cortisol, Glukagon und Wachstumshormon die Wirkung von Insulin in Stresszeiten. Insulin hemmt auch die Fettsäurefreisetzung durch hormonsensitive Lipase im Fettgewebe.
Veröffentlichung
Betazellen in den Langerhans-Inseln setzen Insulin in zwei Phasen frei. Die Freisetzung der ersten Phase wird als Reaktion auf einen erhöhten Blutzuckerspiegel schnell ausgelöst und dauert etwa 10 Minuten. Die zweite Phase ist eine anhaltende, langsame Freisetzung neu gebildeter Vesikel, die unabhängig vom Zucker ausgelöst wird und den Höhepunkt in 2 bis 3 Stunden erreicht. Die zwei Phasen der Insulinfreisetzung legen nahe, dass Insulingranulate in verschiedenen angegebenen Populationen oder "Pools" vorhanden sind. Während der ersten Phase der Insulinexozytose werden die meisten Granula, die für die Exozytose prädisponieren, nach der Calcium-Internalisierung freigesetzt. Dieser Pool wird als Readily Releaseable Pool (RRP) bezeichnet. Die RRP-Granula stellen 0,3–0,7% der gesamten insulinhaltigen Granulatpopulation dar und befinden sich unmittelbar neben der Plasmamembran. Während der zweiten Phase der Exozytose erfordern Insulingranulate die Mobilisierung der Granula an die Plasmamembran und eine vorherige Vorbereitung, um ihre Freisetzung zu erfahren. Somit wird die zweite Phase der Insulinfreisetzung durch die Geschwindigkeit bestimmt, mit der das Granulat zur Freisetzung bereit wird. Dieser Pool wird als Reservepool (RP) bezeichnet. Die RP wird langsamer freigesetzt als die RRP (UVP: 18 Gran/min; RP: 6 Gran/min). Eine reduzierte Insulinfreisetzung der ersten Phase könnte der früheste nachweisbare Betazelldefekt sein, der das Auftreten von Typ-2-Diabetes vorhersagt . Die Freisetzung in der ersten Phase und die Insulinsensitivität sind unabhängige Prädiktoren für Diabetes.
Die Beschreibung des Releases der ersten Phase lautet wie folgt:
- Glucose tritt in die β-Zellen durch die Glukosetransporter , GLUT - 2 . Diese Glukosetransporter haben eine relativ geringe Affinität zu Glukose, wodurch sichergestellt wird, dass die Geschwindigkeit des Glukoseeintrags in die β-Zellen proportional zur extrazellulären Glukosekonzentration (innerhalb des physiologischen Bereichs) ist. Bei niedrigem Blutzuckerspiegel gelangt nur sehr wenig Glukose in die β-Zellen; bei hohen Blutglukosekonzentrationen gelangen große Mengen an Glukose in diese Zellen.
- Die Glukose, die in die β-Zelle eindringt, wird durch Glukokinase ( Hexokinase IV ) zu Glukose-6-Phosphat (G-6-P) phosphoryliert, die durch G-6-P nicht wie die Hexokinasen in anderen Geweben (Hexokinase .) gehemmt wird I – III) sind von diesem Produkt betroffen. Dies bedeutet, dass die intrazelluläre G-6-P-Konzentration proportional zur Blutzuckerkonzentration bleibt.
- Glucose-6-Phosphat tritt in den glykolytischen Weg ein und gelangt dann über die Pyruvat-Dehydrogenase- Reaktion in den Krebs-Zyklus , wo durch die Oxidation von Acetyl-CoA (dem Substrat des Krebs-Zyklus) mehrere energiereiche ATP- Moleküle produziert werden , was zu einem Anstieg der das ATP:ADP-Verhältnis innerhalb der Zelle.
- Ein erhöhtes intrazelluläres ATP:ADP-Verhältnis schließt den ATP-sensitiven SUR1/ Kir6.2- Kaliumkanal (siehe Sulfonylharnstoff-Rezeptor ). Dies verhindert, dass Kaliumionen (K + ) die Zelle durch erleichterte Diffusion verlassen, was zu einer Ansammlung von intrazellulären Kaliumionen führt. Dadurch wird das Innere der Zelle gegenüber dem Äußeren weniger negativ, was zur Depolarisation der Zelloberflächenmembran führt.
- Bei der Depolarisation öffnen sich spannungsgesteuerte Calciumionen (Ca 2+ )-Kanäle , wodurch Calciumionen durch erleichterte Diffusion in die Zelle gelangen können.
- Die zytosolische Calciumionenkonzentration kann auch durch Calciumfreisetzung aus intrazellulären Speichern über die Aktivierung von Ryanodinrezeptoren erhöht werden.
- Die Calciumionenkonzentration im Cytosol der Betazellen kann auch oder zusätzlich durch die Aktivierung der Phospholipase C durch Bindung eines extrazellulären Liganden (Hormon oder Neurotransmitter) an einen G-Protein- gekoppelten Membranrezeptor erhöht werden. Phospholipase C spaltet das Membranphospholipid, Phosphatidylinositol-4,5-bisphosphat , in Inositol-1,4,5-trisphosphat und Diacylglycerin . Inositol-1,4,5-trisphosphat (IP3) bindet dann an Rezeptorproteine in der Plasmamembran des endoplasmatischen Retikulums (ER). Dies ermöglicht die Freisetzung von Ca 2+ -Ionen aus dem ER über IP3-gesteuerte Kanäle, wodurch die zytosolische Konzentration von Calciumionen unabhängig von den Auswirkungen einer hohen Blutglukosekonzentration erhöht wird. Die parasympathische Stimulation der Pankreasinseln wirkt über diesen Weg, um die Insulinsekretion in das Blut zu erhöhen.
- Die deutlich erhöhte Menge an Calciumionen im Zytoplasma der Zellen bewirkt die Freisetzung von zuvor synthetisiertem Insulin, das in intrazellulären sekretorischen Vesikeln gespeichert wurde, ins Blut .
Dies ist der primäre Mechanismus für die Freisetzung von Insulin. Andere Substanzen, von denen bekannt ist, dass sie die Insulinfreisetzung stimulieren, sind die Aminosäuren Arginin und Leucin, die parasympathische Freisetzung von Acetylcholin (wird über den Phospholipase-C-Weg wirksam), Sulfonylharnstoff , Cholecystokinin (CCK, auch über Phospholipase C) und die aus dem Magen-Darm- Trakt stammenden Inkretine wie Glucagon- wie Peptid-1 (GLP-1) und Glucose-abhängiges insulinotropes Peptid (GIP).
Die Insulinausschüttung wird durch Noradrenalin (Noradrenalin) stark gehemmt , was bei Stress zu einem erhöhten Blutzuckerspiegel führt. Es scheint, dass die Freisetzung von Katecholaminen durch das sympathische Nervensystem einen widersprüchlichen Einfluss auf die Insulinfreisetzung durch Betazellen hat, da die Insulinfreisetzung durch α 2 -adrenerge Rezeptoren gehemmt und durch β 2 -adrenerge Rezeptoren stimuliert wird . Die Nettowirkung von Noradrenalin aus sympathischen Nerven und Adrenalin aus Nebennieren auf die Insulinfreisetzung ist eine Hemmung aufgrund der Dominanz der α-adrenergen Rezeptoren.
Wenn der Glukosespiegel auf den üblichen physiologischen Wert sinkt, verlangsamt oder stoppt die Insulinfreisetzung aus den β-Zellen. Sinkt der Blutzuckerspiegel darunter, insbesondere auf gefährlich niedrige Werte, erzwingt die Freisetzung von hyperglykämischen Hormonen (vor allem Glucagon aus den Langerhans-Alpha-Zellen) die Freisetzung von Glukose in das Blut aus den Glykogenspeichern der Leber, ergänzt durch Gluconeogenese, wenn das Glykogen Läden werden erschöpft. Durch die Erhöhung des Blutzuckers verhindern oder korrigieren die hyperglykämischen Hormone eine lebensbedrohliche Hypoglykämie.
Hinweise auf eine gestörte Insulinfreisetzung der ersten Phase können im Glukosetoleranztest nachgewiesen werden , nachgewiesen durch einen deutlich erhöhten Blutzuckerspiegel 30 Minuten nach der Einnahme einer Glukosemenge (75 oder 100 g Glukose), gefolgt von einem langsamen Abfall über die nächsten 100 Minuten, um zwei Stunden nach Testbeginn über 120 mg/100 ml zu bleiben. Bei einer normalen Person ist der Blutzuckerspiegel am Ende des Tests korrigiert (und kann sogar leicht überkorrigiert sein). Eine Insulinspitze ist eine „erste Reaktion“ auf einen Anstieg des Blutzuckers. Diese Reaktion ist individuell und dosisspezifisch, obwohl bisher immer nur davon ausgegangen wurde, dass sie nur nahrungsmittelspezifisch ist.
Schwingungen
Auch während der Verdauung in der Regel eines oder zwei Stunden nach einer Mahlzeit, die Insulinfreisetzung aus der Bauchspeicheldrüse ist nicht kontinuierlich, sondern oszilliert mit einer Periode von 3-6 Minuten, den Wechsel von einer Blutinsulinkonzentration mehr erzeugen , als etwa 800 p mol / l auf weniger als 100 pmol/l (bei Ratten). Es wird angenommen, dass dies eine Herunterregulierung der Insulinrezeptoren in den Zielzellen verhindert und die Leber bei der Extraktion von Insulin aus dem Blut unterstützt. Diese Oszillation ist bei der Gabe von insulinstimulierenden Medikamenten zu beachten, da im Idealfall die oszillierende Blutkonzentration der Insulinfreisetzung erreicht werden sollte und keine konstant hohe Konzentration. Dies kann durch rhythmische Zufuhr von Insulin in die Pfortader , durch lichtaktivierte Zufuhr oder durch Inselzelltransplantation in die Leber erreicht werden.
Insulinspiegel im Blut
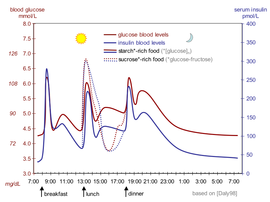
Der Blutinsulinspiegel kann in internationalen Einheiten wie µIU/ml oder in molaren Konzentrationen wie pmol/l gemessen werden, wobei 1 µIU/ml 6,945 pmol/l entspricht. Ein typischer Blutspiegel zwischen den Mahlzeiten beträgt 8–11 μIU/ml (57–79 pmol/l).
Signaltransduktion
Die Wirkung von Insulin wird durch seine Bindung an einen Rezeptor, den Insulinrezeptor (IR) , ausgelöst, der in der Zellmembran vorhanden ist. Das Rezeptormolekül enthält eine α- und eine β-Untereinheit. Zwei Moleküle werden zu einem sogenannten Homodimer verbunden. Insulin bindet an die α-Untereinheiten des Homodimers, die der extrazellulären Seite der Zellen zugewandt sind. Die β-Untereinheiten weisen eine Tyrosinkinase-Enzymaktivität auf, die durch die Insulinbindung ausgelöst wird. Diese Aktivität provoziert die Autophosphorylierung der β-Untereinheiten und anschließend die Phosphorylierung von Proteinen innerhalb der Zelle, die als Insulinrezeptorsubstrate (IRS) bekannt sind. Die Phosphorylierung des IRS aktiviert eine Signaltransduktionskaskade, die zur Aktivierung anderer Kinasen sowie von Transkriptionsfaktoren führt, die die intrazelluläre Wirkung von Insulin vermitteln.
Die Kaskade, die zum Einbau von GLUT4-Glukosetransportern in die Zellmembranen von Muskel- und Fettzellen und zur Synthese von Glykogen in Leber und Muskelgewebe sowie zur Umwandlung von Glukose in Triglyzeride in Leber, Fett und Milchdrüsen führt Drüsengewebe, funktioniert über die Aktivierung der Phosphoinositol-3-Kinase ( PI3K ) durch IRS-1 . Dieses Enzym wandelt in der Zellmembran ein Phospholipid namens Phosphatidylinositol 4,5-bisphosphat (PIP2) in Phosphatidylinositol 3,4,5-triphosphat (PIP3) um, das wiederum die Proteinkinase B (PKB) aktiviert . Aktivierte PKB erleichtert die Fusion von GLUT4 enthaltenden Endosomen mit der Zellmembran, was zu einem Anstieg der GLUT4-Transporter in der Plasmamembran führt. PKB phosphoryliert auch die Glykogen-Synthase-Kinase (GSK) und inaktiviert dadurch dieses Enzym. Das bedeutet, dass sein Substrat, die Glykogensynthase (GS), nicht phosphoryliert werden kann und dephosphoryliert und damit aktiv bleibt. Das aktive Enzym Glykogensynthase (GS) katalysiert den geschwindigkeitsbestimmenden Schritt bei der Synthese von Glykogen aus Glukose. Ähnliche Dephosphorylierungen wirken sich auf die Enzyme aus, die die Glykolyserate steuern, die zur Fettsynthese über Malonyl-CoA in den Geweben führt, die Triglyceride erzeugen können , sowie auf die Enzyme, die die Gluconeogeneserate in der Leber steuern . Die Gesamtwirkung dieser abschließenden Enzymdephosphorylierungen besteht darin, dass in den Geweben, die diese Reaktionen durchführen können, die Glykogen- und Fettsynthese aus Glukose stimuliert und die Glukoseproduktion der Leber durch Glykogenolyse und Gluconeogenese gehemmt wird. Auch der Abbau von Triglyceriden durch Fettgewebe in freie Fettsäuren und Glycerin wird gehemmt.
Nachdem das intrazelluläre Signal erzeugt wurde, das aus der Bindung von Insulin an seinen Rezeptor resultierte, ist eine Beendigung der Signalübertragung erforderlich. Wie unten im Abschnitt über den Abbau erwähnt, ist die Endozytose und der Abbau des an Insulin gebundenen Rezeptors ein Hauptmechanismus, um die Signalübertragung zu beenden. Darüber hinaus wird der Signalweg auch durch Dephosphorylierung der Tyrosinreste in den verschiedenen Signalwegen durch Tyrosinphosphatasen terminiert. Es ist auch bekannt, dass Serin/Threonin-Kinasen die Aktivität von Insulin reduzieren.
Die Struktur des Insulin- Insulin-Rezeptor- Komplexes wurde mit den Techniken der Röntgenkristallographie bestimmt .
Physiologische Wirkungen


Die Wirkungen von Insulin auf der globalen Ebene des menschlichen Stoffwechsels umfassen:
- Erhöhung der zellulären Aufnahme bestimmter Stoffe, insbesondere Glukose im Muskel- und Fettgewebe (etwa zwei Drittel der Körperzellen)
- Steigerung der DNA-Replikation und Proteinsynthese durch Kontrolle der Aminosäureaufnahme
- Modifikation der Aktivität zahlreicher Enzyme .
Die Wirkungen von Insulin (indirekt und direkt) auf Zellen umfassen:
- Stimuliert die Aufnahme von Glukose – Insulin senkt die Blutzuckerkonzentration, indem es die Aufnahme von Glukose durch die Zellen induziert. Dies ist möglich, weil Insulin die Insertion des GLUT4-Transporters in die Zellmembranen von Muskel- und Fettgewebe bewirkt, wodurch Glukose in die Zelle eindringen kann.
- Erhöhte Fettsynthese – Insulin zwingt Fettzellen, Blutzucker aufzunehmen, der in Triglyceride umgewandelt wird ; Insulinmangel bewirkt das Gegenteil.
- Erhöhte Veresterung von Fettsäuren – zwingt das Fettgewebe, aus Fettsäuren neutrale Fette (dh Triglyceride ) herzustellen; Insulinmangel bewirkt das Gegenteil.
- Verminderte Lipolyse – erzwingt eine Verringerung der Umwandlung der Lipidspeicher der Fettzellen in Blutfettsäuren und Glycerin; Insulinmangel bewirkt das Gegenteil.
- Glykogensynthese induzieren – Bei hohem Glukosespiegel induziert Insulin die Bildung von Glykogen durch die Aktivierung des Hexokinase-Enzyms, das der Glukose eine Phosphatgruppe hinzufügt, wodurch ein Molekül entsteht, das die Zelle nicht verlassen kann. Gleichzeitig hemmt Insulin das Enzym Glucose-6-Phosphatase, das die Phosphatgruppe entfernt. Diese beiden Enzyme sind der Schlüssel zur Bildung von Glykogen. Außerdem aktiviert Insulin die Enzyme Phosphofructokinase und Glykogensynthase, die für die Glykogensynthese verantwortlich sind.
- Verminderte Glukoneogenese und Glykogenolyse – verringert die Produktion von Glukose aus Nicht-Kohlenhydrat-Substraten, hauptsächlich in der Leber (die überwiegende Mehrheit des endogenen Insulins, das in der Leber ankommt, verlässt die Leber nie); Die Abnahme des Insulins verursacht die Glukoseproduktion der Leber aus verschiedenen Substraten.
- Verminderte Proteolyse – Verringerung des Proteinabbaus
- Verminderte Autophagie – verminderter Abbau beschädigter Organellen. Postprandiale Spiegel hemmen die Autophagie vollständig.
- Erhöhte Aminosäureaufnahme – zwingt die Zellen, zirkulierende Aminosäuren aufzunehmen; Abnahme des Insulins hemmt die Absorption.
- Arterieller Muskeltonus – zwingt den Arterienwandmuskel, sich zu entspannen, wodurch der Blutfluss erhöht wird, insbesondere in Mikroarterien; Die Abnahme des Insulins verringert den Fluss, indem es diesen Muskeln ermöglicht, sich zusammenzuziehen.
- Erhöhung der Salzsäuresekretion durch Belegzellen im Magen.
- Erhöhte Kaliumaufnahme – zwingt Zellen, die Glykogen synthetisieren (eine sehr schwammige, "nasse" Substanz, die den Gehalt an intrazellulärem Wasser und seinen begleitenden K + -Ionen erhöht ), Kalium aus den extrazellulären Flüssigkeiten zu absorbieren; Insulinmangel hemmt die Aufnahme. Die Erhöhung der zellulären Kaliumaufnahme durch Insulin senkt den Kaliumspiegel im Blutplasma. Dies geschieht möglicherweise über eine insulininduzierte Translokation der Na + /K + -ATPase an die Oberfläche von Skelettmuskelzellen.
- Verminderte renale Natriumausscheidung.
Insulin beeinflusst auch andere Körperfunktionen, wie die vaskuläre Compliance und die Kognition . Sobald Insulin in das menschliche Gehirn gelangt, verbessert es das Lernen und das Gedächtnis und fördert insbesondere das verbale Gedächtnis. Die Verstärkung der Insulinsignalgebung im Gehirn durch intranasale Insulinverabreichung verstärkt auch die akute thermoregulatorische und glukoregulatorische Reaktion auf die Nahrungsaufnahme, was darauf hindeutet, dass das zentralnervöse Insulin zur Koordination einer Vielzahl von homöostatischen oder regulatorischen Prozessen im menschlichen Körper beiträgt . Insulin hat auch eine stimulierende Wirkung auf das Gonadotropin-Releasing-Hormon aus dem Hypothalamus und begünstigt so die Fruchtbarkeit .
Degradierung
Sobald ein Insulinmolekül an den Rezeptor andockt und seine Wirkung entfaltet hat, kann es wieder in die extrazelluläre Umgebung freigesetzt oder von der Zelle abgebaut werden. Die beiden primären Stellen für die Insulinclearance sind die Leber und die Niere. Die Leber scheidet das meiste Insulin während des First-Pass-Transits aus, während die Niere den größten Teil des Insulins im systemischen Kreislauf ausscheidet. Der Abbau beinhaltet normalerweise eine Endozytose des Insulin-Rezeptor-Komplexes, gefolgt von der Wirkung des insulinabbauenden Enzyms . Eine Insulinmolekül endogen von den Beta - Zellen produziert wird geschätzt , innerhalb von etwa einer Stunde nach der Erstveröffentlichung in Umlauf (Insulin abgebaut werden Halbwertszeit ~ 4-6 Minuten).
Regulator des Endocannabinoid-Stoffwechsels
Insulin ist ein wichtiger Regulator des Endocannabinoid (EC) -Stoffwechsels und eine Insulinbehandlung reduziert nachweislich intrazelluläre ECs, 2-Arachidonoylglycerol (2-AG) und Anandamid (AEA), die mit insulinsensitiven Expressionsänderungen in Enzymen des EC-Stoffwechsels korrespondieren . In insulinresistenten Adipozyten ist das Muster der insulininduzierten Enzymexpression in einer Weise gestört, die mit einer erhöhten EC- Synthese und einem reduzierten EC-Abbau vereinbar ist. Die Ergebnisse legen nahe, dass insulinresistente Adipozyten den EC-Metabolismus nicht regulieren und die intrazellulären EC-Spiegel als Reaktion auf die Insulinstimulation verringern, wodurch fettleibige insulinresistente Personen erhöhte Konzentrationen von ECs aufweisen. Diese Dysregulation trägt zu einer übermäßigen Ansammlung von viszeralem Fett und einer reduzierten Adiponektinfreisetzung aus dem abdominalen Fettgewebe sowie zum Auftreten mehrerer kardiometabolischer Risikofaktoren bei, die mit Fettleibigkeit und Typ-2-Diabetes verbunden sind .
Hypoglykämie
Hypoglykämie , auch bekannt als "niedriger Blutzucker", liegt vor, wenn der Blutzucker unter das normale Niveau sinkt. Dies kann zu einer Vielzahl von Symptomen führen, einschließlich Ungeschicklichkeit, Schwierigkeiten beim Sprechen, Verwirrung, Bewusstlosigkeit , Krampfanfällen oder Tod. Ein Gefühl von Hunger, Schwitzen, Zittern und Schwäche kann ebenfalls vorhanden sein. Die Symptome treten in der Regel schnell auf.
Die häufigste Ursache einer Hypoglykämie sind Medikamente zur Behandlung von Diabetes mellitus wie Insulin und Sulfonylharnstoffe . Das Risiko ist bei Diabetikern größer, die weniger als üblich gegessen, mehr Sport getrieben oder Alkohol getrunken haben . Andere Ursachen für Hypoglykämie sind Nierenversagen , bestimmte Tumore wie Insulinom , Lebererkrankungen , Hypothyreose , Hunger , angeborene Stoffwechselstörungen , schwere Infektionen , reaktive Hypoglykämie und eine Reihe von Medikamenten, einschließlich Alkohol. Niedriger Blutzucker kann bei ansonsten gesunden Babys auftreten, die einige Stunden lang nichts gegessen haben.
Krankheiten und Syndrome
Es gibt mehrere Zustände, bei denen eine Insulinstörung pathologisch ist:
-
Diabetes mellitus – Oberbegriff für alle Zustände, die durch Hyperglykämie gekennzeichnet sind. Es kann von den folgenden Typen sein:
- Typ 1 – autoimmunvermittelte Zerstörung der insulinproduzierenden β-Zellen in der Bauchspeicheldrüse, was zu einem absoluten Insulinmangel führt
-
Typ 2 – entweder unzureichende Insulinproduktion durch die β-Zellen oder Insulinresistenz oder beides aus nicht vollständig verstandenen Gründen.
- Es besteht ein Zusammenhang mit der Ernährung , mit Bewegungsmangel, mit Fettleibigkeit , mit dem Alter und mit dem metabolischen Syndrom . Kausalität wurde in mehreren Modellorganismen einschließlich Mäusen und Affen nachgewiesen; Wichtig ist, dass nicht adipöse Menschen aufgrund von Ernährung, Bewegungsmangel und unbekannten Risikofaktoren an Typ-2-Diabetes erkranken, obwohl es wichtig zu beachten ist, dass dies möglicherweise kein kausaler Zusammenhang ist.
- es ist wahrscheinlich, dass unter bestimmten Umweltbedingungen eine genetische Anfälligkeit für die Entwicklung von Typ-2-Diabetes besteht
- Andere Arten von gestörter Glukosetoleranz (siehe Diabetes )
- Insulinom – ein Tumor von Betazellen, der überschüssiges Insulin produziert oder reaktive Hypoglykämie .
- Metabolisches Syndrom – ein wenig verstandener Zustand, der zuerst von Gerald Reaven als Syndrom X bezeichnet wurde . Es ist nicht klar, ob das Syndrom eine einzige, behandelbare Ursache hat oder das Ergebnis von Körperveränderungen ist, die zu Typ-2-Diabetes führen. Sie ist gekennzeichnet durch erhöhten Blutdruck, Dyslipidämie (Störungen der Blutcholesterinformen und anderer Blutfette) und erhöhtem Taillenumfang (zumindest bei Bevölkerungen in weiten Teilen der entwickelten Welt). Die zugrunde liegende Ursache kann die dem Typ-2-Diabetes vorausgehende Insulinresistenz sein, bei der es sich um eine verminderte Fähigkeit zur Insulinreaktion in einigen Geweben (z. B. Muskeln, Fett) handelt. Es ist üblich, dass sich Morbiditäten wie essentielle Hypertonie , Fettleibigkeit , Typ-2-Diabetes und Herz-Kreislauf-Erkrankungen (CVD) entwickeln.
- Polyzystisches Ovarialsyndrom – ein komplexes Syndrom bei Frauen in den reproduktiven Jahren, bei dem Anovulation und Androgenüberschuss häufig als Hirsutismus dargestellt werden . In vielen Fällen von PCOS liegt eine Insulinresistenz vor.
Medizinische Anwendungen
Biosynthetisches Humaninsulin (Insulin human rDNA, INN) für den klinischen Gebrauch wird durch rekombinante DNA- Technologie hergestellt. Biosynthetisches Humaninsulin hat im Vergleich zu extraktivem tierischem Insulin eine erhöhte Reinheit, eine erhöhte Reinheit reduziert die Antikörperbildung. Forschern ist es gelungen, das Gen für Humaninsulin in Pflanzen als eine weitere Methode zur Herstellung von Insulin ("biopharming") in Saflor einzuführen . Es wird erwartet, dass diese Technik die Produktionskosten senkt.
Es stehen mehrere Analoga von Humaninsulin zur Verfügung. Diese Insulinanaloga sind eng mit der Humaninsulinstruktur verwandt und wurden für spezifische Aspekte der glykämischen Kontrolle im Hinblick auf schnelle Wirkung (prandiale Insuline) und lange Wirkung (basale Insuline) entwickelt. Das erste biosynthetische Insulinanalogon wurde für die klinische Anwendung zu den Mahlzeiten entwickelt (Prandialinsulin), Humalog (Insulin lispro). Es wird nach subkutaner Injektion schneller resorbiert als normales Insulin, mit einer Wirkung 15 Minuten nach der Injektion. Andere schnell wirkende Analoga sind NovoRapid und Apidra mit ähnlichen Profilen. Alle werden aufgrund von Aminosäuresequenzen, die die Bildung von Dimeren und Hexameren reduzieren, schnell resorbiert (monomere Insuline werden schneller resorbiert). Bei schnell wirkenden Insulinen ist das Intervall zwischen Injektion und Mahlzeit nicht erforderlich, das zuvor für Humaninsulin und tierisches Insulin empfohlen wurde. Der andere Typ ist lang wirkendes Insulin; die erste davon war Lantus (Insulin Glargin). Diese wirken über einen längeren Zeitraum von 18 bis 24 Stunden konstant. Ebenso basiert ein weiteres protrahiertes Insulin-Analogon ( Levemir ) auf einem Fettsäure-Acylierungs-Ansatz. An dieses Analogon ist ein Myristinsäuremolekül gebunden , das das Insulinmolekül mit dem reichlich vorhandenen Serumalbumin verbindet, was wiederum die Wirkung verlängert und das Risiko einer Hypoglykämie verringert. Beide protrahierten Analoga müssen nur einmal täglich eingenommen werden und werden bei Typ-1-Diabetikern als Basalinsulin eingesetzt. Eine Kombination aus schnell wirkendem und protrahiertem Insulin ist ebenfalls erhältlich, wodurch es für Patienten wahrscheinlicher wird, ein Insulinprofil zu erreichen, das dem der körpereigenen Insulinfreisetzung nachempfunden ist.
Insulin wird in der Regel als subkutane Injektionen durch Einmalspritzen mit Nadeln , über eine Insulinpumpe oder durch Insulinpens zum wiederholten Gebrauch mit Einwegnadeln eingenommen. Inhalatives Insulin ist auch auf dem US-Markt erhältlich.
Im Gegensatz zu vielen Arzneimitteln kann Insulin nicht oral eingenommen werden, da es wie fast alle anderen Proteine, die in den Magen-Darm-Trakt gelangen , in Bruchstücke zerlegt wird, woraufhin alle Aktivität verloren geht. Es gab einige Forschungen über Möglichkeiten, Insulin vor dem Verdauungstrakt zu schützen, so dass es oral oder sublingual verabreicht werden kann.
Im Jahr 2021 hat die Weltgesundheitsorganisation Insulin in ihre Modellliste unentbehrlicher Medikamente aufgenommen .
Geschichte des Studiums
Entdeckung
1869, während er die Struktur der Bauchspeicheldrüse unter einem Mikroskop untersuchte , identifizierte Paul Langerhans , ein Medizinstudent in Berlin , einige zuvor unbemerkte Gewebeklumpen, die über den Großteil der Bauchspeicheldrüse verstreut waren. Die Funktion der „kleinen Haufen von Zellen“, später bekannt als die Langerhans'schen Inseln , blieb zunächst unbekannt, aber Édouard Laguesse vorgeschlagen später könnten sie Sekrete produzieren , die eine regulatorische Rolle bei der Verdauung spielen. Auch der Sohn von Paul Langerhans, Archibald, half, diese regulatorische Rolle zu verstehen.
1889 entfernte der Arzt Oskar Minkowski in Zusammenarbeit mit Joseph von Mering einem gesunden Hund die Bauchspeicheldrüse, um seine vermutete Rolle bei der Verdauung zu testen. Beim Urintest fanden sie Zucker und stellten damit erstmals einen Zusammenhang zwischen Bauchspeicheldrüse und Diabetes her. 1901 machte der amerikanische Arzt und Wissenschaftler Eugene Lindsay Opie einen weiteren großen Schritt , als er die Rolle der Bauchspeicheldrüse auf die Langerhans-Inseln isolierte: "Diabetes mellitus, wenn die Folge einer Pankreasläsion durch Zerstörung der Inseln von Langerhans und tritt nur auf, wenn diese Körper teilweise oder vollständig zerstört sind".
In den nächsten zwei Jahrzehnten unternahmen Forscher mehrere Versuche, die Sekrete der Inseln zu isolieren. 1906 erzielte George Ludwig Zülzer einen Teilerfolg bei der Behandlung von Hunden mit Pankreasextrakt, konnte seine Arbeit jedoch nicht fortsetzen. Zwischen 1911 und 1912 versuchte EL Scott von der University of Chicago wässrige Pankreasextrakte und stellte "eine leichte Abnahme der Glykosurie" fest, konnte seinen Direktor jedoch nicht vom Wert seiner Arbeit überzeugen; es wurde geschlossen. Israel Kleiner zeigte 1915 ähnliche Effekte an der Rockefeller University , aber der Erste Weltkrieg unterbrach seine Arbeit und er kehrte nicht darauf zurück.
1916 entwickelte Nicolae Paulescu einen wässrigen Pankreasextrakt , der bei Injektion in einen diabetischen Hund eine normalisierende Wirkung auf den Blutzuckerspiegel hatte . Er musste seine Experimente wegen des Ersten Weltkriegs unterbrechen und schrieb 1921 vier Aufsätze über seine in Bukarest durchgeführte Arbeit und seine Tests an einem diabetischen Hund. Später in diesem Jahr veröffentlichte er "Research on the Role of the Pancreas in Food Assimilation".
Der Name "Insulin" wurde 1916 von Edward Albert Sharpey-Schafer für ein hypothetisches Molekül geprägt, das von den Langerhans-Inseln der Bauchspeicheldrüse (lateinisch insula für Insel oder Insel) produziert wird und den Glukosestoffwechsel steuert. Unbemerkt von Sharpey-Schafer hatte Jean de Meyer 1909 das sehr ähnliche Wort "Insulin" für dasselbe Molekül eingeführt.
Extraktion und Reinigung
Im Oktober 1920 kam der Kanadier Frederick Banting zu dem Schluss, dass die Verdauungssekrete, die Minkowski ursprünglich untersucht hatte, das Inselsekret abbauen und somit eine erfolgreiche Extraktion unmöglich machten. Banting war ausgebildeter Chirurg und wusste, dass Blockaden des Pankreasgangs den größten Teil der Bauchspeicheldrüse zur Atrophie führen würden, während die Langerhans-Inseln intakt bleiben würden. Er argumentierte, dass ein relativ reiner Extrakt aus den Inseln hergestellt werden könnte, sobald der Rest der Bauchspeicheldrüse verschwunden war. Er machte sich eine Notiz: "Pankreasgänge des Hundes unterbinden. Hunde am Leben halten, bis Azini degenerieren und Inseln zurücklassen. Versuchen Sie, die innere Sekretion dieser zu isolieren und Glykosurie zu lindern."

Im Frühjahr 1921 reiste Banting nach Toronto , um JJR Macleod , Professor für Physiologie an der Universität Toronto , seine Idee zu erläutern . Macleod war anfangs skeptisch, da Banting keinen Hintergrund in der Forschung hatte und mit der neuesten Literatur nicht vertraut war, aber er stimmte zu, Banting Laborraum zur Verfügung zu stellen, um seine Ideen zu testen. Macleod arrangierte in diesem Sommer auch, dass zwei Studenten Bantings Laborassistenten waren, aber Banting brauchte nur einen Laborassistenten. Charles Best und Clark Noble warfen eine Münze; Best gewann den Münzwurf und übernahm die erste Schicht. Dies erwies sich für Noble als unglücklich, da Banting Best den ganzen Sommer über behielt und schließlich die Hälfte seines Nobelpreisgeldes und die Anerkennung für die Entdeckung mit Best teilte. Am 30. Juli 1921 isolierten Banting und Best erfolgreich einen Extrakt ("Isleton") aus den Inseln eines kanalgebundenen Hundes und injizierten ihn einem diabetischen Hund, wobei festgestellt wurde, dass der Extrakt seinen Blutzucker in 1 Stunde um 40% reduzierte.
Banting und Best präsentierten Macleod bei seiner Rückkehr nach Toronto im Herbst 1921 ihre Ergebnisse, aber Macleod wies auf Mängel im Versuchsdesign hin und schlug vor, die Experimente mit mehr Hunden und besserer Ausrüstung zu wiederholen. Er verlegte Banting und Best in ein besseres Labor und begann, Banting ein Gehalt aus seinen Forschungsstipendien zu zahlen. Einige Wochen später war auch die zweite Versuchsrunde ein Erfolg, und Macleod half, ihre Ergebnisse im November privat in Toronto zu veröffentlichen. Durch die zeitraubende Aufgabe, Hunde zu verbinden und mehrere Wochen zu warten, um Insulin zu extrahieren, kam Banting auf die Idee, Insulin aus der Bauchspeicheldrüse des Fötus zu extrahieren, die noch keine Verdauungsdrüsen entwickelt hatte. Bis Dezember war es ihnen auch gelungen, Insulin aus der Bauchspeicheldrüse der erwachsenen Kuh zu extrahieren. Macleod stellte alle anderen Forschungen in seinem Labor ein, um sich auf die Reinigung von Insulin zu konzentrieren. Er lud den Biochemiker James Collip ein , bei dieser Aufgabe zu helfen, und das Team fühlte sich innerhalb eines Monats bereit für einen klinischen Test.
Am 11. Januar 1922 erhielt Leonard Thompson , ein 14-jähriger Diabetiker, der im Toronto General Hospital im Sterben lag, die erste Insulinspritze. Der Extrakt war jedoch so unrein, dass Thompson eine schwere allergische Reaktion erlitt und weitere Injektionen abgesagt wurden. In den nächsten 12 Tagen arbeitete Collip Tag und Nacht daran, den Ochsen-Pankreas-Extrakt zu verbessern. Eine zweite Dosis wurde am 23. Januar injiziert, wodurch die für Diabetes typische Glykosurie vollständig eliminiert wurde, ohne dass es zu offensichtlichen Nebenwirkungen kam. Die erste amerikanische Patientin war Elizabeth Hughes , die Tochter des US-Außenministers Charles Evans Hughes . Der erste in den USA behandelte Patient war der spätere Holzschnittkünstler James D. Havens ; Dr. John Ralston Williams importierte Insulin von Toronto nach Rochester, New York , um Havens zu behandeln.
Banting und Best arbeiteten nie gut mit Collip zusammen und betrachteten ihn als eine Art Eindringling, und Collip verließ das Projekt kurz darauf. Im Frühjahr 1922 gelang es Best, seine Techniken so weit zu verbessern, dass bei Bedarf große Mengen Insulin extrahiert werden konnten, das Präparat blieb jedoch unrein. Die Pharmafirma Eli Lilly and Company hatte nicht lange nach den ersten Veröffentlichungen 1921 Hilfe angeboten und nahm das Angebot im April an. Im November entdeckte Lillys Chefchemiker George B. Walden die isoelektrische Fällung und konnte große Mengen hochraffinierten Insulins herstellen. Kurz darauf wurde Insulin der breiten Öffentlichkeit zum Verkauf angeboten.
Patent
Gegen Ende Januar 1922 drohten die Spannungen zwischen den vier "Mitentdeckern" des Insulins und Collip kurzzeitig, seinen Reinigungsprozess separat zu patentieren . John G. FitzGerald , Direktor der nichtkommerziellen öffentlichen Gesundheitseinrichtung Connaught Laboratories , trat daher als Friedensstifter ein. Die daraus resultierende Vereinbarung vom 25. Januar 1922 legte zwei Schlüsselbedingungen fest: 1) dass die Kollaborateure einen Vertrag unterzeichnen, in dem sie sich verpflichten, während einer anfänglichen Arbeitsperiode mit Connaught kein Patent mit einem kommerziellen Pharmaunternehmen zu erwerben; und 2) dass keine Änderungen in der Forschungspolitik erlaubt sind, es sei denn, sie besprechen dies zuerst mit FitzGerald und den vier Mitarbeitern. Es half, Meinungsverschiedenheiten einzudämmen und verband die Forschung mit dem öffentlichen Auftrag von Connaught.
Aus medizinethischen Gründen waren Macleod und Banting anfangs besonders zurückhaltend, ihr Verfahren für Insulin zu patentieren. Es blieben jedoch Bedenken, dass ein privater Dritter die Forschung kapern und monopolisieren könnte (wie Eli Lilly and Company andeutete) und dass eine sichere Verbreitung ohne Qualitätskontrollen schwer zu gewährleisten wäre. Dazu gab Edward Calvin Kendall wertvolle Ratschläge. Er hatte Thyroxin 1914 in der Mayo Clinic isoliert und das Verfahren durch eine Vereinbarung zwischen ihm, den Brüdern Mayo und der University of Minnesota patentiert, die das Patent an die öffentliche Universität übertrug. Am 12. April schrieben Banting, Best, Collip, Macleod und FitzGerald gemeinsam an den Präsidenten der University of Toronto , um eine ähnliche Vereinbarung mit dem Ziel vorzuschlagen, dem Board of Governors der University ein Patent zu übertragen. Das Schreiben betonte:
Das Patent würde zu keinem anderen Zweck verwendet werden, als die Erlangung eines Patents durch andere Personen zu verhindern. Wenn die Einzelheiten der Herstellungsmethode veröffentlicht werden, wäre es jedem freigestellt, den Auszug herzustellen, aber niemand könnte sich ein gewinnbringendes Monopol sichern.
Der Auftrag an das Board of Governors der University of Toronto wurde am 15. Januar 1923 für die symbolische Zahlung von 1,00 USD abgeschlossen. Das Arrangement wurde 1923 in The World's Work als "ein Schritt vorwärts in der medizinischen Ethik" beglückwünscht . Es hat in den 2010er Jahren auch viel Medienaufmerksamkeit in Bezug auf das Thema Gesundheitsversorgung und Erschwinglichkeit von Arzneimitteln erhalten .
Nach weiteren Bedenken hinsichtlich Eli Lillys Versuchen, Teile des Herstellungsprozesses separat zu patentieren, führte Robert Defries , stellvertretender Direktor und Leiter der Insulinabteilung von Connaught , eine Richtlinie zum Patentpooling ein, die von den Herstellern verlangt, alle Verbesserungen des Herstellungsprozesses frei zu teilen, ohne die Erschwinglichkeit zu beeinträchtigen.
Strukturanalyse und Synthese
Gereinigtes tierisches Insulin war zunächst die einzige Insulinart, die für Experimente und Diabetiker zur Verfügung stand. John Jacob Abel war der erste, der 1926 die kristallisierte Form herstellte. Beweise für die Proteinnatur wurden erstmals 1924 von Michael Somogyi , Edward A. Doisy und Philip A. Shaffer gegeben. Es wurde vollständig bewiesen, als Hans Jensen und Earl A. Evans Jr. isolierte 1935 die Aminosäuren Phenylalanin und Prolin.
Die Aminosäurestruktur von Insulin wurde erstmals 1951 von Frederick Sanger charakterisiert , und Mitte der 1960er Jahre wurde in den Labors von Panayotis Katsoyannis an der University of Pittsburgh und Helmut Zahn an der RWTH Aachen gleichzeitig das erste synthetische Insulin hergestellt . Synthetische kristallines Rinderinsulin wurde im Jahr 1965 Die vollständige 3-dimensionale Struktur des Insulins wurde bestimmt , indem durch die chinesischen Forscher erreicht Kristallographie X-ray in Dorothy Hodgkin ‚s Labor im Jahr 1969.
Das erste gentechnisch veränderte, synthetische "humane" Insulin wurde 1978 von Arthur Riggs und Keiichi Itakura am Beckman Research Institute der City of Hope in Zusammenarbeit mit Herbert Boyer von Genentech mit E. coli hergestellt . Genentech, gegründet von Swanson, Boyer und Eli Lilly and Company , verkaufte 1982 das erste kommerziell erhältliche biosynthetische Humaninsulin unter dem Markennamen Humulin . Die überwiegende Mehrheit des weltweit verwendeten Insulins ist biosynthetisches rekombinantes "humanes" Insulin oder seine Analoga. Kürzlich wurde von einer Pioniergruppe kanadischer Forscher ein anderer Ansatz verwendet, der eine leicht zu züchtende Färberdistelpflanze zur Herstellung von viel billigerem Insulin verwendet.
Rekombinantes Insulin wird entweder in Hefe (normalerweise Saccharomyces cerevisiae ) oder E. coli produziert . In Hefe kann Insulin als ein einkettiges Protein mit einer KexII-Endoprotease (ein Hefe-Homolog von PCI/PCII) konstruiert werden, die die Insulin-A-Kette von einer C-terminal verkürzten Insulin-B-Kette trennt. Ein chemisch synthetisierter C-terminaler Schwanz wird dann durch reverse Proteolyse unter Verwendung der kostengünstigen Protease Trypsin auf Insulin gepfropft; typischerweise wird das Lysin am C-terminalen Schwanz mit einer chemischen Schutzgruppe geschützt, um eine Proteolyse zu verhindern. Die Leichtigkeit der modularen Synthese und die relative Sicherheit von Modifikationen in dieser Region erklärt gängige Insulinanaloga mit C-terminalen Modifikationen (zB Lispro, Aspart, Glulisin). Die Genentech-Synthese und die vollständig chemische Synthese wie die von Bruce Merrifield werden nicht bevorzugt, da die Effizienz der Rekombination der beiden Insulinketten gering ist, hauptsächlich aufgrund der Konkurrenz mit der Präzipitation der Insulin-B-Kette.
Nobelpreise
Das Nobelpreiskomitee schrieb 1923 die praktische Extraktion von Insulin einem Team der University of Toronto zu und verlieh den Nobelpreis an zwei Männer: Frederick Banting und JJR Macleod . Für die Entdeckung des Insulins erhielten sie 1923 den Nobelpreis für Physiologie oder Medizin . Banting, verärgert darüber, dass Best nicht erwähnt wurde, teilte seinen Preis mit ihm, und Macleod teilte seinen Preis sofort mit James Collip . Das Patent für Insulin wurde für einen Dollar an die University of Toronto verkauft .
Zwei weitere Nobelpreise wurden für Arbeiten zum Insulin verliehen. Der britische Molekularbiologe Frederick Sanger , der 1955 die Primärstruktur von Insulin aufklärte, erhielt 1958 den Nobelpreis für Chemie . Rosalyn Sussman Yalow erhielt 1977 den Nobelpreis für Medizin für die Entwicklung des Radioimmunoassays für Insulin.
Auch mehrere Nobelpreise haben einen indirekten Zusammenhang mit Insulin. George Minot , Mitträger des Nobelpreises 1934 für die Entwicklung der ersten wirksamen Behandlung der perniziösen Anämie , litt an Diabetes mellitus . Dr. William Castle stellte fest, dass die Entdeckung von Insulin im Jahr 1921, das rechtzeitig eintraf, um Minot am Leben zu erhalten, daher auch für die Entdeckung eines Heilmittels für perniziöse Anämie verantwortlich war . Dorothy Hodgkin erhielt 1964 den Nobelpreis für Chemie für die Entwicklung der Kristallographie , der Technik, mit der sie 1969 die vollständige Molekülstruktur von Insulin entschlüsselte.
Kontroverse
Die von Banting, Best, Collip und Macleod veröffentlichte Arbeit stellte die Herstellung eines gereinigten Insulinextrakts dar, der für die Verwendung bei menschlichen Patienten geeignet ist. Obwohl Paulescu die Prinzipien der Behandlung entdeckte, konnte sein Kochsalzextrakt nicht am Menschen angewendet werden; er wurde 1923 beim Nobelpreis nicht erwähnt. Professor Ian Murray arbeitete besonders aktiv daran, "das historische Unrecht" gegen Nicolae Paulescu zu korrigieren . Murray war Professor für Physiologie am Anderson College of Medicine in Glasgow , Schottland , Leiter der Abteilung für Stoffwechselkrankheiten an einem führenden Krankenhaus in Glasgow, Vizepräsident der British Association of Diabetes und Gründungsmitglied der International Diabetes Federation . Murray schrieb:
Dem angesehenen rumänischen Wissenschaftler Paulescu, der zu der Zeit, als das Team in Toronto seine Forschungen aufnahm, bereits die Gewinnung des antidiabetischen Hormons der Bauchspeicheldrüse und seine Wirksamkeit bei der Reduzierung der Hyperglykämie bei diabetischen Hunden erfolgreich war, wurde nicht genügend Anerkennung geschenkt .
In einer privaten Mitteilung äußerte Professor Arne Tiselius , ehemaliger Leiter des Nobel-Instituts, seine persönliche Meinung, dass Paulescu 1923 der Auszeichnung ebenso würdig sei.
Siehe auch
- Behandlung
- Anatomie und Physiologie
- Andere medizinische / diagnostische Verwendungen
- Insulin-Signaltransduktionsweg
- Andere Verwendungen
Verweise
Weiterlesen
- Gesetze GM, Reaven A (1999). Insulinresistenz: das metabolische Syndrom X . Totowa, New Jersey: Humana Press. doi : 10.1226/0896035883 (inaktiv 31. Mai 2021). ISBN 978-0-89603-588-1.CS1-Wartung: DOI ab Mai 2021 inaktiv ( Link )
- Leahy JL, Cefalu WT (2002-03-22). Insulintherapie (1. Aufl.). New York: Marcel Dekker. ISBN 978-0-8247-0711-8.
- Kumar S, O'Rahilly S (2005-01-14). Insulinresistenz: Insulinwirkung und ihre Störungen bei Krankheiten . Chichester, England: Wiley. ISBN 978-0-470-85008-4.
- Ehrlich A, Schroeder CL (2000-06-16). Medizinische Terminologie für Gesundheitsberufe (4. Aufl.). Thomson Delmar Lernen. ISBN 978-0-7668-1297-0.
- Draznin B , LeRoith D (September 1994). Molekularbiologie von Diabetes: Autoimmunität und Genetik; Insulinsynthese und -sekretion . Totowa, New Jersey: Humana Press. doi : 10.1226/0896032868 (inaktiv 31. Mai 2021). ISBN 978-0-89603-286-6.CS1-Wartung: DOI ab Mai 2021 inaktiv ( Link )
- Berühmte kanadische Ärzte: Sir Frederick Banting bei Library and Archives Canada
- McKeage K, Goa KL (2001). "Insulin Glargin: eine Überprüfung seiner therapeutischen Verwendung als langwirksames Mittel zur Behandlung von Diabetes mellitus Typ 1 und 2". Drogen . 61 (11): 1599–624. doi : 10.2165/00003495-200161110-00007 . PMID 11577797 . S2CID 46972328 .
- de Leiva A, Brugués E, de Leiva-Pérez A (November 2011). „[Die Entdeckung des Insulins: anhaltende Kontroversen nach neunzig Jahren]“. Endocrinologia y Nutricion (auf Spanisch). 58 (9): 449–56. doi : 10.1016/j.endonu.2011.10.001 . PMID 22036099 .
- Vecchio I, Tornali C, Bragazzi NL, Martini M (2018). „Die Entdeckung des Insulins: Ein wichtiger Meilenstein in der Geschichte der Medizin“ . Grenzen in der Endokrinologie . 9 : 613. doi : 10.3389/fendo.2018.000613 . PMC 6205949 . PMID 30405529 .
Externe Links
- Bibliothekssammlung der Universität von Toronto: Entdeckung und frühe Entwicklung von Insulin, 1920–1925
- CBC Digital Archives – Banting, Best, Macleod, Collip: Auf der Suche nach einem Heilmittel für Diabetes
- Animationen der Wirkung von Insulin im Körper bei AboutKidsHealth.ca
- Übersicht aller verfügbaren Strukturinformationen in der PDB für UniProt : P01308 (Insulin) bei der PDBe-KB .