Jasmonsäure - Jasmonic acid
|
|

|
|
| Namen | |
|---|---|
|
Bevorzugter IUPAC-Name
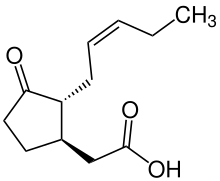
[(1 R ,2 R )-3-Oxo-2-[(2 Z )-pent-2-en-1-yl]cyclopentyl]essigsäure |
|
| Andere Namen
Jasmonsäure
(−)-Jasmonsäure JA, ( 1R,2R )-3-Oxo-2-( 2Z )-2-Pentenyl-cyclopentylethansäure {(1R,2R)-3-Oxo-2-[(2Z)- 2-Penten-1-yl]cyclopentyl}essigsäure |
|
| Bezeichner | |
|
3D-Modell ( JSmol )
|
|
| ChEBI | |
| ChemSpider | |
|
PubChem- CID
|
|
| UNII | |
|
CompTox-Dashboard ( EPA )
|
|
|
|
|
|
| Eigenschaften | |
| C 12 H 18 O 3 | |
| Molmasse | 210,27 g/mol |
| Dichte | 1,1 g / cm 3 |
| Siedepunkt | 160 °C (320 °F; 433 K) bei 0,7 mmHg |
|
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Infobox-Referenzen | |
Jasmonsäure ( JA ) ist eine organische Verbindung, die in mehreren Pflanzen einschließlich Jasmin vorkommt . Das Molekül gehört zur Klasse der Jasmonate der Pflanzenhormone . Es wird über den Octadecanoid-Weg aus Linolensäure biosynthetisiert . Es wurde erstmals im Jahr 1957 als Methyl isoliert Ester von Jasmonsäure vom Schweizeren Chemiker Edouard Demol und seine Kollegen.
Biosynthese
Seine Biosynthese geht von der Fettsäure Linolensäure aus , die durch Lipoxygenase (13-LOX) mit Sauerstoff angereichert wird und ein Peroxid bildet. Dieses Peroxid cyclisiert dann in Gegenwart von Allenoxid-Synthase, um ein Allenoxid zu bilden . Diese Allenoxid-umlagert , wie es durch das Enzym katalysiert wird Allenoxidcyclase 12-oxophytodienoic Säure zu bilden, und durchläuft eine Reihe von β-Oxidationen bis 7-iso-Jasmonsäure. In Abwesenheit eines Enzyms isomerisiert diese Iso-Jasmonsäure zu Jasmonsäure.
Funktion
Die Hauptfunktion von JA und seinen verschiedenen Metaboliten ist die Regulierung der Pflanzenreaktionen auf abiotischen und biotischen Stress sowie des Pflanzenwachstums und der Pflanzenentwicklung. Regulated Pflanzenwachstum und Entwicklungsprozesse umfassen Wachstumshemmung, Seneszenz , Rankenwickel, Blütenentwicklung und Blattabwurf. JA ist auch für die Knollenbildung bei Kartoffeln und Yamswurzeln verantwortlich. Es spielt eine wichtige Rolle als Reaktion auf die Verletzung von Pflanzen und systemisch erworbene Resistenzen . Das Dgl-Gen ist verantwortlich für die Aufrechterhaltung des JA-Spiegels unter üblichen Bedingungen in Zea mays sowie für die vorläufige Freisetzung von Jasmonsäure kurz nach der Fütterung. Wenn Pflanzen von Insekten angegriffen werden, reagieren sie mit der Freisetzung von JA, das neben vielen anderen Abwehrstoffen gegen Pflanzenfresser die Expression von Protease-Inhibitoren aktiviert . Diese Protease-Inhibitoren verhindern die proteolytische Aktivität der Verdauungsproteasen oder "Speichelproteine" der Insekten, wodurch sie daran gehindert werden, den für ihr eigenes Wachstum im Protein benötigten Stickstoff aufzunehmen . JA aktiviert auch die Expression von Polyphenoloxidase , die die Produktion von Chinolinen fördert . Diese können die Enzymproduktion des Insekts stören und den Nährstoffgehalt der aufgenommenen Pflanze verringern.
JA kann eine Rolle bei der Schädlingsbekämpfung spielen. Tatsächlich wurde JA als Saatgutbehandlungsmittel in Betracht gezogen, um die natürlichen Abwehrkräfte der Pflanzen, die aus den behandelten Samen keimen, zu stimulieren. Bei dieser Anwendung werden Jasmonate auf Pflanzen gesprüht, die bereits zu wachsen begonnen haben. Diese Anwendungen stimulieren die Produktion von Protease-Inhibitoren in der Pflanze. Diese Produktion von Protease-Inhibitor kann die Pflanze vor Insekten schützen, wodurch die Befallsraten und der durch Pflanzenfresser erlittene physische Schaden verringert werden. Aufgrund seiner antagonistischen Beziehung zu Salicylsäure (ein wichtiges Signal in der Pathogenabwehr) kann es jedoch bei einigen Pflanzenarten zu einer erhöhten Anfälligkeit für virale Erreger und andere Pathogene führen. In Zea mays werden Salicylsäure und JA durch NPR1 (Non-Expressor of Pathogenese-related Genes1) vermittelt, was wesentlich ist, um zu verhindern, dass Pflanzenfresser dieses antagonistische System ausnutzen. Heerwürmer ( Spodoptera spp.) sind durch unbekannte Mechanismen in der Lage, die Aktivität des Salicylsäure- Pfads in Mais zu erhöhen , was zu einer Unterdrückung der JA-Synthese führt, aber dank der NPR1- Vermittlung werden die JA-Spiegel nicht signifikant gesenkt.
Derivate
Jasmonsäure wird auch in eine Vielzahl von Derivaten umgewandelt, einschließlich des Esters Methyljasmonat . Diese Umwandlung wird durch das Enzym Jasmonsäure-Carboxylmethyltransferase katalysiert. Es kann in einigen biologischen Zusammenhängen auch an Aminosäuren konjugiert werden. Decarboxylierung liefert den verwandten Duftstoff Jasmon .
Verweise
-
^
Demole, E.; Lederer, E.; Mercier, D. (1962). "Isolement et Determination de la structure du jasmonate de methyle, Constituent odorant characteristique de l'essence de jasmin" Helvetica Chimica Acta (auf Französisch). 45 : 675–685. doi : 10.1002/hlca.19620450233 .
- Chapuis, Christian (Dezember 2011). „Die Chemie und das kreative Erbe von Methyljasmonat und Hedion“ . Parfümeur & Flavorist . 36 : 36–48.
- ^ Dewick, Paul (2009). Medizinische Naturprodukte: Ein biosynthetischer Ansatz . Vereinigtes Königreich: John Wiley & Sons, Ltd. S. 42 –53. ISBN 978-0-470-74168-9.
- ^ Delker, C.; Stenzel, I.; Hause, B.; Miersch, O.; Feußner, I.; Wasternack, C. (2006). „Jasmonat-Biosynthese in Arabidopsis thaliana – Enzyme, Produkte, Regulierung“. Pflanzenbiologie . 8 (3): 297–306. doi : 10.1055/s-2006-923935 . PMID 16807821 .
- ^ Galis, I.; Gaquerel, E.; Pandey, SP; Baldwin, INT (2009). „Molekulare Mechanismen, die dem Pflanzengedächtnis in JA-vermittelten Abwehrreaktionen zugrunde liegen“. Pflanze, Zelle & Umwelt . 32 (6): 617–27. doi : 10.1111/j.1365-3040.2008.01862.x . PMID 18657055 .
- ^ Lutz, Diana (2012). Schlüsselteil des Schnellreaktionssystems der Pflanzen enthüllt. Washington-Universität in St. Louis. http://news.wustl.edu/news/Pages/23979.aspx
- ^ Zavala, JA; Patankar, AG; Gase, K.; Hui, D.; Baldwin, IT (2004). „Manipulation der endogenen Trypsin-Proteinase-Inhibitor-Produktion in Nicotiana Attenuata demonstriert ihre Funktion als Abwehr gegen Pflanzenfresser“ . Pflanzenphysiologie . 134 (3): 1181-1190. doi : 10.1104/pp.103.035634 . PMC 389942 . PMID 14976235 .
- ^ Die Auswirkungen von Bakterien- und Jasmonsäurebehandlungen auf Rapsinsekten . 2008.
- ^ "Erfolg für Pflanzenschädlingsbekämpfung" . BBC-Nachrichten . 2008-10-07 . Abgerufen 2010-05-05 .
- ^ Worrall, D.; Holroyd, GH; Moore, JP; Glowacz, M.; Croft, P.; Taylor, JE; Paul, ND; Roberts, M.R. (2012). "Die Behandlung von Saatgut mit Aktivatoren der Pflanzenabwehr erzeugt eine lang anhaltende Grundierung der Resistenz gegen Schädlinge und Krankheitserreger" (PDF) . Neuer Phytologe . 193 (3): 770–778. doi : 10.1111/j.1469-8137.2011.03987.x . PMID 22142268 .
- ^ Bauer, EE; Johnson, RR; Ryan, CA (März 1992). "Regulation der Expression von Proteinase-Inhibitor-Genen durch Methyljasmonat und Jasmonsäure" . Pflanzenphysiologie . 98 (3): 995–1002. doi : 10.1104/pp.98.3.995 . ISSN 0032-0889 . PMC 1080300 . PMID 16668777 .
- ^ Fouad, Hany Ahmed; El-Gepaly, Hosam Mohamed Khalil Hammam; Fouad, Osama Ahmed (2016-08-26). „Nanosilica und Jasmonsäure als alternative Methoden zur Bekämpfung von Tuta absoluta (Meyrick) in Tomatenkulturen unter Freilandbedingungen“. Archiv für Phytopathologie und Pflanzenschutz . 49 (13–14): 362–370. doi : 10.1080/03235408.2016.1219446 . ISSN 0323-5408 . S2CID 89119004 .
- ^ Lyon, R.; Manieren, JM; Kasan, K. (2013). „Jasmonat-Biosynthese und Signalgebung in Monokotyledonen: Ein vergleichender Überblick“. Berichte zu Pflanzenzellen . 32 (6): 815–27. doi : 10.1007/s00299-013-1400-y . PMID 23455708 . S2CID 10778582 .
- ^ a b Ballaré, Carlos L. (2011). „Jasmonat-induzierte Verteidigung: Eine Geschichte von Geheimdiensten, Kollaborateuren und Schurken“. Trends in der Pflanzenwissenschaft . 16 (5): 249–57. doi : 10.1016/j.tplants.2010.12.001 . PMID 21216178 .
- ^ SEO, HS; Lied, JT; Cheong, JJ; Lee, YH; Lee, YW; Hwang, I.; Lee, JS; Choi, YD (2001-04-10). „Jasmonsäure-Carboxyl-Methyltransferase: ein Schlüsselenzym für Jasmonat-regulierte Pflanzenreaktionen“ . Proceedings of the National Academy of Sciences of the United States of America . 98 (8): 4788–4793. Bibcode : 2001PNAS...98.4788S . doi : 10.1073/pnas.081557298 . ISSN 0027-8424 . PMC 31912 . PMID 11287667 .
- Sankawa, Ushio; Barton, Derek HR; Nakanishi, Koji; Meth-Cohn, Otto, Hrsg. (1999). Umfassende Naturstoffchemie: Polyketide und andere Sekundärmetaboliten einschließlich Fettsäuren und deren Derivate . Pergamon-Presse. ISBN 978-0-08-043153-6.

