Lacton - Lactone
Lactone sind cyclische Carbonsäureester , die eine 1-Oxacycloalkan-2-on-Struktur ( -C(=O)-O- ) enthalten, oder Analoga mit Ungesättigtheit oder Heteroatomen, die ein oder mehrere Kohlenstoffatome des Rings ersetzen.
Lactone entstehen durch intramolekulare Veresterung der entsprechenden Hydroxycarbonsäuren, die spontan abläuft, wenn der gebildete Ring fünf- oder sechsgliedrig ist. Lactone mit Drei- oder Vierringen (α-Lactone und β-Lactone) sind sehr reaktiv, was ihre Isolierung erschwert. Für die Laborsynthese von kleinringigen Lactonen sowie solchen, die Ringe größer als sechsgliedrig enthalten, sind normalerweise spezielle Methoden erforderlich.
Nomenklatur
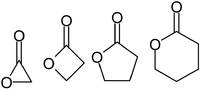
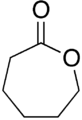
Lactone werden normalerweise nach dem Säurevorläufermolekül benannt ( Aceto = 2 Kohlenstoffatome, Propio = 3, Butyro = 4, Valero = 5, Capro = 6 usw.), mit einem -Lacton- Suffix und einem griechischen Buchstabenpräfix , das die Anzahl der Kohlenstoffatome im Heterocyclus – d. h. der Abstand zwischen den relevanten -OH- und -COOH-Gruppen entlang des Rückgrats. Das erste Kohlenstoffatom nach dem Kohlenstoff in der -COOH-Gruppe der Stammverbindung wird mit α bezeichnet, das zweite mit β und so weiter. Daher geben die Präfixe auch die Größe des Lactonrings an: α-Lacton = 3-gliedrig, β-Lacton = 4-gliedrig, γ-Lacton = 5-gliedrig usw.Makrozyklische Lactone werden als Makrolactone bezeichnet .
Das andere Suffix zur Bezeichnung eines Lactons ist -olid , das in Substanzklassennamen wie Butenolid , Makrolid , Cardenolid oder Bufadienolid verwendet wird .
Um die bevorzugten IUPAC-Namen zu erhalten , werden Lactone als heterocyclische Pseudoketone bezeichnet, indem dem Namen des heterocyclischen Stammhydrids das Suffix 'one', 'dion', 'thion' usw. und die entsprechenden multiplikativen Präfixe hinzugefügt werden.
Etymologie
Der Name „Lacton“ wurde 1844 von dem französischen Chemiker Théophile-Jules Pelouze geprägt , der es zunächst als Derivat der Milchsäure erhielt. Der Name Lacton leitet sich von der Ringverbindung Lactid ab , die bei der Dehydratisierung von 2-Hydroxypropansäure ( Milchsäure ) CH 3 -CH(OH)-COOH entsteht. Milchsäure wiederum hat ihren Namen von ihrer ursprünglichen Isolierung aus Sauermilch (lateinisch: lac, lactis). Eine interne Dehydratisierung innerhalb desselben Milchsäuremoleküls hätte Alpha-Propiolacton erzeugt , ein Lacton mit einem 3-gliedrigen Ring.
1880 erweiterte der deutsche Chemiker Wilhelm Rudolph Fittig den Namen "Lacton" auf alle intramolekularen Carbonsäureester.
Natürliche Quellen
Natürlich vorkommende Lactone sind hauptsächlich gesättigte und ungesättigte - und δ-Lactone und in geringerem Maße makrocyclische Lactone. Die γ- und δ-Lactone sind intramolekulare Ester der entsprechenden Hydroxyfettsäuren. Sie tragen zum Aroma von Früchten, Butter, Käse und anderen Lebensmitteln bei. Cyclopentadecanolid ist für den moschusartigen Geruch von Angelikawurzelöl verantwortlich . Von den natürlich vorkommenden bizyklischen Lactonen sind Phthalide für die Gerüche von Sellerie- und Liebstöckelöl und Cumarin für Waldmeister verantwortlich . Lactone sind in Eichenholz enthalten und tragen zum Geschmacksprofil von im Fass gereiften Bieren bei .
Lactonringe treten häufig als Blöcke in der Natur den Aufbau, wie in Ascorbinsäure , Kavain , nepetalactone , Gluconolacton , Hormone ( Spironolacton , Mevalonolacton ), Enzyme ( Lactonase ), Neurotransmittern ( Butyrolacton , Avermectine ), Antibiotika ( Makrolide wie Erythromycin ; Amphotericin B ) , Krebsmedikamente ( Vernolepin , Epothilone ), Phytoöstrogene ( Resorcylsäurelactone , Herzglykoside ).
Synthese
Viele Methoden der Estersynthese lassen sich auch auf die von Lactonen anwenden. In einer industriellen Oxandrolon- Synthese ist der wichtigste Schritt der Lactonbildung eine organische Reaktion - Veresterung .
In Halolaktonisierung , ein Alken von einem angegriffenen Halogen über elektrophile Addition mit dem kationischen Zwischen erfaßt intramolekular durch eine benachbarte Carbonsäure (siehe auch iodolactamization ).
Spezifische Methoden umfassen die Yamaguchi-Veresterung , die Shiina-Makrolactonisierung , die Corey-Nicolaou-Makrolactonisierung , die Baeyer-Villiger-Oxidation und die nukleophile Abstraktion .
Die γ-Lactone γ-Octalacton , γ-Nonalacton , γ-Decalacton , γ-Undecalacton lassen sich in guter Ausbeute in einem einstufigen Verfahren durch radikalische Addition primärer Fettalkohole an Acrylsäure unter Verwendung von Di-tert-butylperoxid als ein Katalysator.
Reaktionen
Die stabilste Struktur für Lactone sind die 5-gliedrigen γ-Lactone und 6-gliedrigen δ-Lactone, da, wie in allen organischen Zyklen, 5- und 6-gliedrige Ringe die Spannung der Bindungswinkel minimieren . -Lactone sind so stabil, dass 4-Hydroxysäuren (R-CH(OH)-(CH 2 ) 2 -COOH) in Gegenwart verdünnter Säuren bei Raumtemperatur sofort spontan verestert und zum Lacton cyclisiert werden. β-Lactone existieren zwar, können aber nur durch spezielle Verfahren hergestellt werden. α-Lactone können in Massenspektrometrie- Experimenten als transiente Spezies nachgewiesen werden.
Die Reaktionen von Lactonen sind denen von Estern ähnlich, am Beispiel von Gamma-Lacton in den folgenden Abschnitten:
Hydrolyse
Das Erhitzen eines Lactons mit einer Base ( Natriumhydroxid ) hydrolysiert das Lacton zu seiner Stammverbindung, der geradkettigen bifunktionellen Verbindung. Wie bei geradkettigen Estern ist die Hydrolyse-Kondensationsreaktion von Lactonen eine reversible Reaktion mit einem Gleichgewicht . Allerdings ist die Gleichgewichtskonstante der Hydrolysereaktion des Lactons niedriger als die des geradkettigen Esters, dh die Produkte (Hydroxysäuren) werden bei den Lactonen weniger begünstigt. Dies liegt daran, dass, obwohl die Enthalpien der Hydrolyse von Estern und Lactonen ungefähr gleich sind, die Entropie der Hydrolyse von Lactonen geringer ist als die Entropie von geradkettigen Estern. Geradkettige Ester ergeben bei der Hydrolyse zwei Produkte, wodurch die Entropieänderung günstiger ist als bei Lactonen, die nur ein einziges Produkt ergeben.
Die Ermäßigung
Lactone können mit Lithiumaluminiumhydrid in trockenem Ether zu Diolen reduziert werden. Die Reduktionsreaktion bricht zuerst die Esterbindung des Lactons und reduziert dann die Aldehydgruppe (-CHO) zur Alkoholgruppe (-OH). Gamma-Lactone werden beispielsweise zu Butan-1,4-diol (CH 2 (OH)-(CH 2 ) 2 -CH 2 (OH) ) reduziert .
Aminolyse
Lactone reagieren auch mit ethanolischem Ammoniak, das aufgrund der basischen Eigenschaften von Ammoniak zuerst die Esterbindung bricht und dann mit der sauren -COOH-Gruppe reagiert, um eine difunktionelle Gruppe, dh Alkohol und Amid, zu bilden. Gamma-Lactone reagieren, um CH 2 (OH)-(CH 2 ) 2 -CO-NH 2 zu ergeben .
Polymerisation
Lactone bilden leicht Polyester gemäß der Formel und es wurde gezeigt, dass sie auch ohne Katalysator oligomerisieren:
Michael-Reaktion
Sesquiterpenlactone , die in vielen Pflanzen vorkommen, können über eine Michael-Reaktion mit anderen Molekülen reagieren .
Verwendet
Aromen und Düfte
Lactone tragen wesentlich zum Geschmack von Früchten sowie von unfermentierten und fermentierten Milchprodukten bei und werden daher als Geschmacks- und Duftstoffe verwendet. Einige Beispiele sind γ-Decalacton (4-Decanolid), das einen charakteristischen Pfirsichgeschmack hat; δ-Decalacton (5-Decanolid), das einen cremigen Kokos-/Pfirsich-Geschmack hat; γ-Dodecalacton (4-Dodecanolid), das ebenfalls einen kokos/fruchtigen Geschmack hat, eine Beschreibung, die auch auf also -Octalacton (4-Octanolid) zutrifft, obwohl es auch einen krautigen Charakter hat; γ-Nonalacton , das einen intensiven Kokosgeschmack dieser Serie hat, obwohl es in Kokos nicht vorkommt, und γ-Undecalacton .
Makrocyclische Lactone ( Cyclopentadecanolid , 15-Pentadec-11/12-enolid ) haben einen ähnlichen Geruch wie makrocyclische Ketone tierischen Ursprungs ( Muscon , Civeton ), lassen sich jedoch beispielsweise durch Depolymerisation der entsprechenden linearen Polyester leichter herstellen . Der Ersatz einer Methyleneinheit durch Sauerstoff beeinflusst den Geruch dieser Verbindungen kaum, und neben Cyclopentadecanolid (zB 12-Oxa-16-Hexadecanolid ) entstehen auch Oxalactone mit 15 – 17-gliedrigen Ringen .
Präbiotische Chemie
Es wurde gezeigt, dass präbiotisch plausible Lactone, wie -Caprolacton und -Valerolacton, ohne Verwendung von Katalysatoren oligomerisieren und Oligomere bilden, die während der Entstehung des Lebens relevant gewesen sein könnten .
Kunststoffe
Polycaprolacton ist ein wichtiger Kunststoff.
Beispiele
γ-Butyrolacton (GBL)
- Makrolide
- Kavalactone
Dilactone
- Ellagsäure (Hexahydroxydiphensäuredilacton)
- Flavogallonsäuredilacton findet sich in Rhynchosia volubilis- Samen und in Shorea laeviforia
- Lactid
- Tergallussäuredilacton ist in Samen von Rhynchosia volubilis enthalten
- Valonsäuredilacton kann aus dem Kernholz von Shorea laeviforia isoliert werden
- Ethylenbrassylat (Musk T), ein weit verbreiteter synthetischer Moschus
Siehe auch
- Lactam , ein zyklisches Amid
- Lactim , ein zyklisches Imid
- Lactid , ein cyclischer Diester
- Halolactonisierung
- Phthalein