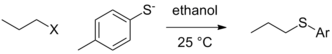Abgangsgruppe - Leaving group
In der Chemie ist eine Abgangsgruppe ein Molekülfragment, das mit einem Elektronenpaar bei der heterolytischen Bindungsspaltung abreist . Abgangsgruppen können Anionen , Kationen oder neutrale Moleküle sein. In beiden Fällen ist es jedoch entscheidend, dass die Abgangsgruppe die zusätzliche Elektronendichte stabilisieren kann, die sich aus der Bindungsheterolyse ergibt. Gemeinsame anionische Abgangsgruppen sind Halogenide wie Cl - , Br - und I - und Sulfonat Ester wie Tosylat (TsO - ). Fluorid (F - ) fungiert als Abgangsgruppe im Nervengift Saringas . Übliche neutrale Molekülabgangsgruppen sind Wasser und Ammoniak . Abgangsgruppen können auch positiv geladene Kationen sein (wie H +, das während der Nitrierung von Benzol freigesetzt wird ); Diese werden auch speziell als Elektrofuges bezeichnet .
Gruppenfähigkeit verlassen
Die physische Manifestation der Fähigkeit, die Gruppe zu verlassen, ist die Geschwindigkeit, mit der eine Reaktion stattfindet. Gute Abgangsgruppen reagieren schnell. Nach der Übergangszustandstheorie impliziert dies, dass Reaktionen mit guten Abgangsgruppen niedrige Aktivierungsbarrieren aufweisen, die zu relativ stabilen Übergangszuständen führen.
Es ist hilfreich, das Konzept der Abgangsgruppenfähigkeit im Fall des ersten Schritts einer S N 1 / E1-Reaktion mit einer anionischen Abgangsgruppe (Ionisation) zu berücksichtigen, wobei zu berücksichtigen ist, dass dieses Konzept auf alle beteiligten Reaktionen verallgemeinert werden kann Gruppen verlassen. Da die Abgangsgruppe im Übergangszustand (und in den Produkten) eine größere negative Ladung trägt als im Ausgangsmaterial, muss eine gute Abgangsgruppe in der Lage sein, diese negative Ladung zu stabilisieren, dh stabile Anionen zu bilden . Ein gutes Maß für die Anionenstabilität ist der pKa der konjugierten Säure eines Anions , und die Fähigkeit der Abgangsgruppe folgt im Allgemeinen diesem Trend, wobei ein niedrigerer pK a H mit einer besseren Fähigkeit der Abgangsgruppe verbunden ist.
Die Korrelation zwischen pK a H und der Fähigkeit zur Abgangsgruppe ist jedoch nicht perfekt. Die Fähigkeit zur Abgangsgruppe stellt den Unterschied in der Energie zwischen Ausgangsmaterialien und einem Übergangszustand (ΔG ‡ ) dar, und Unterschiede in der Fähigkeit zur Abgangsgruppe spiegeln sich in Änderungen dieser Menge (ΔΔG ‡ ) wider . Die Menge pK a H repräsentiert jedoch den Energieunterschied zwischen Ausgangsmaterialien und Produkten (ΔG), wobei sich Unterschiede im Säuregehalt in Änderungen dieser Menge (ΔΔG) widerspiegeln. Auch die Ausgangsmaterialien sind in diesen Fällen unterschiedlich. Im Fall von pK a ist die "Abgangsgruppe" an ein Proton im Ausgangsmaterial gebunden, während im Fall der Abgangsgruppenfähigkeit die Abgangsgruppe an (normalerweise) Kohlenstoff gebunden ist. Unter Berücksichtigung dieser wichtigen Vorbehalte muss man pK a H als Ausdruck der Fähigkeit zum Verlassen der Gruppe betrachten, aber dennoch tendieren die Trends in jedem dazu, gut miteinander zu korrelieren. In Übereinstimmung mit diesem Bild neigen starke Basen wie OH - , OR - und NR 2 - dazu, schlechte Abgangsgruppen zu bilden, da sie eine negative Ladung nicht stabilisieren können.
| Abgangsgruppen geordnet ungefähr mit abnehmender Abgangsfähigkeit | |
|---|---|
| R - N 2 + | Distickstoff |
| R - OR ' 2 + | Dialkylether |
| R - OSO 2 R F. | Perfluoralkylsulfonate (zB Triflat ) |
| R-OTs, R-OMs usw. | Tosylate , Mesylate und ähnliche Sulfonate |
| R - I. | Jodid |
| R - Br | Bromid |
| R-OH 2 + , R'-OHR + | Wasser , Alkohole |
| R - Cl | Chlorid |
| R-ONO 2 , R-OPO (ODER ') 2 | Nitrat , Phosphat und andere anorganische Ester |
| R - SR ' 2 + | Thioether |
| R-NR ' 3 + , R-NH 3 + | Amine , Ammoniak |
| R - F. | Fluorid |
| R - OCOR | Carboxylat |
| Brüllen | Phenoxide |
| R-OH, R-OR | Hydroxid , Alkoxide |
| R - NR 2 | Amide |
| R - H. | Hydrid |
| R - R ' | Arenid, Alkanid |
Was eine vernünftige Abgangsgruppe ausmacht, hängt vom Kontext ab. Für S N 2 -Reaktionen umfassen typische synthetisch nützliche Abgangsgruppen Cl - , Br - , I - , - OTs, - OMs, - OTf und H 2 O. Substrate, die Phosphat- und Carboxylat-Abgangsgruppen enthalten, reagieren eher durch kompetitive Addition -Eliminierung, während Sulfonium- und Ammoniumsalze im Allgemeinen Ylide bilden oder wenn möglich eine E2-Eliminierung eingehen. Phenoxide ( - OAr) bilden die untere Grenze für das, was als S möglich ist N 2 Abgangsgruppen: sehr starke Nucleophile wie Ph 2 P - oder EtS - haben zu demethylieren verwendet Anisol - Derivate durch S N an der Methylgruppe 2 Verschiebung. Hydroxid, Alkoxide, Amide, Hydrid und Alkylanionen dienen bei S N 2 -Reaktionen nicht als Abgangsgruppen .
Wenn andererseits anionische oder dianionische tetraedrische Zwischenprodukte kollabieren, erleichtert die hohe Elektronendichte des benachbarten Heteroatoms das Ausstoßen einer Abgangsgruppe. Daher werden im Fall der Ester- und Amidhydrolyse unter basischen Bedingungen üblicherweise Alkoxide und Amide als Abgangsgruppen vorgeschlagen. Ebenso sind E1cb- Reaktionen mit Hydroxid als Abgangsgruppe nicht ungewöhnlich (z. B. bei der Aldolkondensation ). Es ist äußerst selten, dass Gruppen wie H - ( Hydride ) und R 3 C - ( Alkylanionen , R = Alkyl oder H) aufgrund der hohen Energie dieser Spezies mit einem Elektronenpaar abreisen. Die Chichibabin-Reaktion liefert ein Beispiel für Hydrid als Abgangsgruppe, während die Wolff-Kishner-Reaktion und die Haller-Bauer-Reaktionen nicht stabilisierte Carbanion-Abgangsgruppen aufweisen.
Kontextbezogene Unterschiede bei der Fähigkeit, die Gruppe zu verlassen
Es ist wichtig zu beachten, dass die oben angegebene Liste qualitativ ist und Trends beschreibt . Die Fähigkeit einer Gruppe zu gehen ist kontextabhängig. Beispielsweise wird bei S N Ar- Reaktionen die Geschwindigkeit im Allgemeinen erhöht, wenn die Abgangsgruppe im Vergleich zu den anderen Halogenen Fluorid ist. Dieser Effekt beruht auf der Tatsache, dass der höchste Energieübergangszustand für diesen zweistufigen Additions-Eliminierungs-Prozess im ersten Schritt auftritt, in dem die größere Elektronenentzugsfähigkeit von Fluorid im Vergleich zu den anderen Halogeniden die sich entwickelnde negative Ladung am aromatischen Ring stabilisiert. Der Abgang der Abgangsgruppe erfolgt schnell von diesem hochenergetischen Meisenheimer-Komplex , und da der Abgang nicht an dem Geschwindigkeitsbegrenzungsschritt beteiligt ist, hat er keinen Einfluss auf die Gesamtgeschwindigkeit der Reaktion. Dieser Effekt ist allgemein, um Baseneliminierungen zu konjugieren.
Selbst wenn der Abgang der Abgangsgruppe in den geschwindigkeitsbegrenzenden Schritt einer Reaktion involviert ist, können immer noch kontextbezogene Unterschiede bestehen, die die Reihenfolge der Abgangsgruppenfähigkeit ändern können. Bei Friedel-Crafts-Alkylierungen ist die normale Reihenfolge der Halogen-Abgangsgruppen umgekehrt, so dass die Reaktionsgeschwindigkeit RF> RCl> RBr> RI folgt. Dieser Effekt ist auf ihre größere Fähigkeit zurückzuführen, den Lewis-Säure- Katalysator zu komplexieren , und die tatsächlich austretende Gruppe ist ein "aß" -Komplex zwischen der Lewis-Säure und der abgehenden Abgangsgruppe. Diese Situation wird allgemein als Verlassen der Gruppenaktivierung definiert .
Es können immer noch kontextbezogene Unterschiede in der Fähigkeit der Abgangsgruppe in der reinsten Form bestehen, dh wenn die tatsächliche Gruppe, die die Abgangsgruppe verlässt, nicht von den Reaktionsbedingungen (durch Protonierung oder Lewis-Säure-Komplexierung) beeinflusst wird und die Abfahrt der Abgangsgruppe bei der Geschwindigkeitsbestimmung auftritt Schritt. In der Situation, in der andere Variablen konstant gehalten werden (Art des Alkylelektrophils, Lösungsmittels usw.), kann eine Änderung des Nucleophils zu einer Änderung der Reaktivitätsreihenfolge für Abgangsgruppen führen. Im folgenden Fall ist Tosylat die beste Abgangsgruppe, wenn Ethoxid das Nucleophil ist, aber Iodid und sogar Bromid werden im Fall des Thiolat- Nucleophils bessere Abgangsgruppen .
| Abgangsgruppe (X) | ||
|---|---|---|
| Cl | 0,0074 | 0,0024 (bei 40 ° C) |
| Br | 1 | 1 |
| ich | 3.5 | 1.9 |
| OTs | 0,44 | 3.6 |
Aktivierung
Bei E1- und S N 1 -Reaktionen ist es üblich, dass eine schlechte Abgangsgruppe durch Protonierung oder Komplexierung mit einer Lewis-Säure in eine gute umgewandelt wird . Durch Protonierung vor dem Abflug kann ein Molekül formal so schlechte Abgangsgruppen wie Hydroxid verlieren.
Das gleiche Prinzip gilt für die Friedel-Crafts-Reaktion . Hier ist eine starke Lewis-Säure erforderlich, um entweder ein Carbokation aus einem Alkylhalogenid in der Friedel-Crafts-Alkylierungsreaktion oder ein Acyliumion aus einem Acylhalogenid zu erzeugen .
In den allermeisten Fällen erzeugen Reaktionen, bei denen die Gruppenaktivierung verlassen wird, in einem separaten Schritt ein Kation, bevor sie entweder nukleophil angegriffen oder eliminiert werden. Beispielsweise können S N 1 - und E 1 -Reaktionen einen Aktivierungsschritt beinhalten, während S N 2 - und E 2 -Reaktionen dies im Allgemeinen nicht tun.
In konjugierten Baseneliminierungen
Das Erfordernis einer guten Abgangsgruppe wird bei konjugierten Baseneliminierungsreaktionen gelockert. Diese Reaktionen umfassen den Verlust einer Abgangsgruppe in der β-Position eines Enolats sowie die Regeneration einer Carbonylgruppe aus dem tetraedrischen Intermediat bei der nukleophilen Acylsubstitution. Unter Zwangsbedingungen können sogar Amide einer basischen Hydrolyse unterzogen werden, bei der eine extrem arme Abgangsgruppe, R 2 N - , ausgestoßen wird . Noch dramatischer kann die Decarboxylierung von Benzoatanionen durch Erhitzen mit Kupfer oder Cu 2 O erfolgen, wobei ein Arylanion verloren geht. Diese Reaktion wird durch die Tatsache erleichtert, dass die Abgangsgruppe höchstwahrscheinlich eher eine Arylkupferverbindung als das viel basischere Alkalimetallsalz ist.
Diese dramatische Abweichung von den normalen Anforderungen der Abgangsgruppe tritt hauptsächlich im Bereich der Bildung von C = O-Doppelbindungen auf, wo die Bildung der sehr starken C = O-Doppelbindung ansonsten ungünstige Reaktionen vorantreiben kann. Das Erfordernis einer guten Abgangsgruppe ist im Fall der Bildung von C = C-Bindungen über E1cB-Mechanismen immer noch gelockert , aber aufgrund der relativen Schwäche der C = C-Doppelbindung zeigt die Reaktion immer noch eine gewisse Empfindlichkeit der Abgangsgruppe. Insbesondere kann eine Änderung der Identität der Abgangsgruppe (und der Bereitschaft zum Verlassen) die Art des Mechanismus bei Eliminierungsreaktionen ändern. Bei schlechten Abgangsgruppen wird der E1cB-Mechanismus bevorzugt, aber wenn sich die Fähigkeit der Abgangsgruppe ändert, verschiebt sich die Reaktion von einem geschwindigkeitsbestimmenden Verlust der Abgangsgruppe aus dem carbanionischen Zwischenprodukt B über TS BC ‡ zu einem geschwindigkeitsbestimmenden Deprotonierungsschritt über TS AB ‡ (nicht abgebildet) zu einer konzertierten E2-Eliminierung. In der letzteren Situation ist die Abgangsgruppe X so gut geworden, dass der frühere Übergangszustand, der die Zwischenprodukte B und C verbindet, energiearmer geworden ist als B , was kein stationärer Punkt mehr auf der potentiellen Energieoberfläche für die Reaktion ist. Da nur ein Übergangszustand das Ausgangsmaterial A und das Produkt C verbindet , ist die Reaktion aufgrund der Zunahme der Abgangsgruppenfähigkeit von X nun konzertiert (wenn auch im abgebildeten Fall sehr asynchron).
"Super" und "Hyper" verlassen Gruppen
Die prototypische Super-Abgangsgruppe ist dreifach , und der Begriff bezeichnet inzwischen jede Abgangsgruppe mit vergleichbaren Fähigkeiten. Verbindungen, bei denen der Verlust einer Super-Abgangsgruppe eine stabile Carbokation erzeugen kann, sind normalerweise hochreaktiv und instabil. Daher sind die am häufigsten vorkommenden organischen Triflate Methyltriflat und Alkenyl- oder Aryltriflate, die bei der Ionisierung keine stabilen Carbokationen bilden können, was sie relativ stabil macht. Es wurde festgestellt, dass aus Alkoholen und Perfluorbutansulfonylfluorid erzeugte steroidale Alkylnonaflate (eine andere Superabgangsgruppe) als solche nicht isolierbar waren, sondern sofort die Produkte der Eliminierung oder Substitution durch durch das Reagenz erzeugtes Fluorid bildeten . Gemischte Acyl-Trifluormethansulfonylanhydride werden im Gegensatz zu den entsprechenden Acylhalogeniden, die eine starke Lewis-Säure erfordern, problemlos ohne Katalysator einer Friedel-Crafts-Acylierung unterzogen. Methyltriflat ist jedoch nicht an Friedel-Crafts-Alkylierungsreaktionen mit elektronenneutralen aromatischen Ringen beteiligt.
Jenseits der Super-Abgangsgruppen in der Reaktivität liegen die "Hyper" -Abgangsgruppen. Unter diesen sind λ 3 -Iodane hervorzuheben , zu denen Diaryliodoniumsalze und andere Haloniumionen gehören . In einer Studie wurde ein quantitativer Vergleich dieser und anderer Abgangsgruppen durchgeführt. Relativ zu Chlorid (k rel = 1) erhöhten sich die Reaktivitäten in der Reihenfolge Bromid (k rel = 14), Iodid (k rel = 91), Tosylat (k rel = 3,7 × 10 4 ), Triflat (k rel = 1,4 × 10) 8 ) Phenyliodoniumtetrafluorborat (PhI + BF 4 - , k rel = 1,2 × 10 14 ). Zusammen mit dem Kriterium, dass eine Hyper-Abgangsgruppe eine stärkere Abgangsgruppe als Triflat ist, besteht die Notwendigkeit, dass die Abgangsgruppe eine reduktive Eliminierung durchläuft. Im Fall von Haloniumionen beinhaltet dies die Reduktion von einem dreiwertigen Halonium zu einem einwertigen Halogenid, gekoppelt mit der Freisetzung eines anionischen Fragments. Ein Teil der außergewöhnlichen Reaktivität von Verbindungen mit Hyperabgangsgruppen wurde auf die entropische Begünstigung zurückgeführt, ein Molekül in drei zu teilen.
Dialkylhaloniumionen wurden ebenfalls isoliert und für einfache Alkylgruppen charakterisiert. Diese Verbindungen können trotz ihrer extremen Reaktivität gegenüber Nucleophilen im festen Zustand mit sehr schwach nukleophilen Gegenionen wie SbF rein erhalten werden -
6 und CHB 11 Cl 11 - . Die stark elektrophile Natur dieser Verbindungen, die durch ihre Bindung an extrem labile RX-Abgangsgruppen (R = Alkyl, X = Cl, Br, I) hervorgerufen wird, wird durch ihre Neigung veranschaulicht, sehr schwache Nucleophile zu alkylieren. Das Erhitzen von reinen Proben von (CH 3 ) 2 Cl + [CHB 11 Cl 11 ] - unter vermindertem Druck führte zur Methylierung des sehr schwach nukleophilen Carborananions unter gleichzeitiger Ausscheidung der CH 3 Cl-Abgangsgruppe. Dialkylhaloniumhexafluorantimonatsalze Alkylatüberschuss Alkylhalogenide ergeben ausgetauschte Produkte. Ihre stark elektrophile Natur sowie die Instabilität der primären Carbokationen, die durch die Ionisierung ihrer Alkylgruppen entstehen, weisen auf ihre mögliche Beteiligung an der Friedel-Crafts-Alkylierungschemie hin. Die Reihenfolge der Erhöhung der Labilität dieser Abgangsgruppen ist RI <R-Br <R-Cl.