Lewis-Säure-Katalyse - Lewis acid catalysis
Bei der Lewis-Säure-Katalyse organischer Reaktionen wirkt eine metallbasierte Lewis-Säure als Elektronenpaar-Akzeptor, um die Reaktivität eines Substrats zu erhöhen. Übliche Lewis-Säure-Katalysatoren basieren auf Hauptgruppenmetallen wie Aluminium , Bor , Silizium und Zinn sowie vielen frühen ( Titan , Zirkonium ) und späten ( Eisen , Kupfer , Zink ) d-Block-Metallen. Das Metallatom bildet ein Addukt mit einem Elektronenpaar , das ein elektronegatives Atom im Substrat trägt, wie Sauerstoff (sowohl sp 2 als auch sp 3 ), Stickstoff , Schwefel und Halogene . Die Komplexierung hat partiellen Charge-Transfer-Charakter und macht den freien Elektronenpaar-Donor effektiv elektronegativer, indem sie das Substrat für nukleophilen Angriff, heterolytische Bindungsspaltung oder Cycloaddition mit 1,3-Dienen und 1,3-Dipolen aktiviert.
Viele klassische Reaktionen mit Kohlenstoff-Kohlenstoff- oder Kohlenstoff-Heteroatom-Bindungsbildung können durch Lewis-Säuren katalysiert werden. Beispiele umfassen die Friedel-Crafts-Reaktion , die Aldolreaktion und verschiedene pericyclische Prozesse, die bei Raumtemperatur langsam ablaufen, wie die Diels-Alder-Reaktion und die En-Reaktion . Neben der Beschleunigung der Reaktionen können Lewis-Säure-Katalysatoren in vielen Fällen Regio- und Stereoselektivität bewirken.
Frühe Entwicklungen bei Lewis-Säure-Reagentien konzentrierten sich auf leicht zugängliche Verbindungen wie TiCl 4 , BF 3 , SnCl 4 und AlCl 3 . Im Laufe der Jahre haben vielseitige Katalysatoren mit Liganden, die für spezifische Anwendungen entwickelt wurden, sowohl die Reaktivität als auch die Selektivität von Lewis-Säure-katalysierten Reaktionen verbessert. In jüngerer Zeit sind Lewis-Säure-Katalysatoren mit chiralen Liganden zu einer wichtigen Klasse von Werkzeugen für die asymmetrische Katalyse geworden .
Zu den Herausforderungen bei der Entwicklung der Lewis-Säure-Katalyse zählen ein ineffizienter Katalysatorumsatz (verursacht durch die Affinität des Katalysators zum Produkt) und die häufige Notwendigkeit einer Zweipunktbindung für die Stereoselektivität, die häufig den Einsatz von Hilfsgruppen erfordert.
Mechanismus
Bei Reaktionen mit polaren Mechanismen beinhaltet die Lewis-Säure-Katalyse oft die Bindung des Katalysators an Lewis-basische Heteroatome und den Entzug der Elektronendichte, was wiederum die heterolytische Bindungsspaltung erleichtert (im Fall der Friedel-Crafts-Reaktion ) oder das Substrat direkt für einen nukleophilen Angriff aktiviert ( bei Carbonyladditionsreaktionen ). Die Dichotomie kann bei einigen Reaktionen wichtige Konsequenzen haben, wie im Fall von Lewis-Säure-vermittelten Acetal-Substitutionsreaktionen, bei denen die unten gezeigten S N 1 - und S N 2 -Mechanismen zu unterschiedlichen stereochemischen Ergebnissen führen können. Bei der Untersuchung des Produktverhältnisses in einem bicyclischen System zeigten Denmark und Kollegen, dass beide Mechanismen in Abhängigkeit von der Zähnigkeit der Lewis-Säure und der Identität der R' -Gruppe wirksam sein können .

In Diels-Alder- und 1,3-dipolaren Cycloadditionsreaktionen senken Lewis-Säuren die LUMO- Energie des Dienophils bzw. Dipolarphils, wodurch es reaktiver gegenüber dem Dien oder Dipol wird.
Lewis-Säure-Katalyse mit carbonylhaltigen Substraten
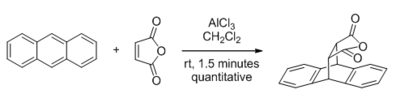
Unter den Reaktionen, die durch Lewis-Säuren katalysiert werden können , haben diejenigen mit carbonylhaltigen Substraten die größte Aufmerksamkeit erhalten. Die erste große Entdeckung auf diesem Gebiet war 1960, als Yates und Eaton über die signifikante Beschleunigung der Diels-Alder-Reaktion durch AlCl 3 berichteten, wenn Maleinsäureanhydrid das Dienophil ist.
Frühe theoretische Studien, die auf Grenzorbitalanalysen beruhten, zeigten, dass die Lewis-Säure-Katalyse über eine Verringerung der LUMO-Energie des Dienophils funktioniert,. Neuere Studien haben jedoch gezeigt, dass diese Begründung für Lewis-Säure-katalysierte Diels-Alder-Reaktionen falsch ist. Es wurde gefunden, dass Lewis-Säuren die Diels-Alder-Reaktion beschleunigen, indem sie die destabilisierende sterische Pauli-Abstoßung zwischen dem wechselwirkenden Dien und Dienophil verringern und nicht durch Erniedrigen der Energie des LUMO des Dienophils und folglich durch die Erhöhung der normalen Elektronenbedarfsorbitalwechselwirkung. Die Lewis-Säure bindet über eine Donor-Akzeptor-Wechselwirkung an das Dienophil und polarisiert über diesen Mechanismus die besetzte Orbitaldichte weg von der reaktiven C=C-Doppelbindung des Dienophils hin zur Lewis-Säure. Diese reduzierte besetzte Orbitaldichte an der C=C-Doppelbindung des Dienophils wird wiederum eine weniger abstoßende Orbitalwechselwirkung zwischen geschlossener Schale und geschlossener Schale mit dem ankommenden Dien eingehen, wodurch die destabilisierende sterische Pauli-Abstoßung verringert und somit die Diels- Erle Reaktionsbarriere. Darüber hinaus erhöht der Lewis-Säure-Katalysator auch die Asynchronität der Diels-Alder-Reaktion, wodurch das besetzte π-Orbital an der C=C-Doppelbindung des Dienophils asymmetrisch wird. Als Ergebnis führt diese verstärkte Asynchronität zu einer zusätzlichen Reduzierung der destabilisierenden sterischen Pauli-Abstoßung sowie zu einem geringeren Druck auf die Reaktanten, sich zu verformen, mit anderen Worten, sie reduziert die destabilisierende Aktivierungsspannung (auch als Verzerrungsenergie bekannt). Dieser funktionierende katalytische Mechanismus ist als Pauli-senkende Katalyse bekannt , die in einer Vielzahl von organischen Reaktionen wirksam ist.
Die ursprüngliche Überlegung hinter Lewis-Säure-katalysierten Diels-Alder-Reaktionen ist falsch, denn die Lewis-Säure senkt nicht nur die Energie des LUMO des Dienophils, sondern auch die Energie des HOMOs des Dienophils und erhöht somit den inversen Elektronenbedarf der LUMO-HOMO-Orbitalenergie Lücke. Somit verstärken Lewis-Säure-Katalysatoren zwar die normale Elektronenbedarf-Orbital-Wechselwirkung, indem sie das LUMO des Dienophils erniedrigen, aber sie schwächen gleichzeitig die inverse Elektronenbedarf-Orbital-Wechselwirkung, indem sie auch die Energie des HOMOs des Dienophils senken. Diese beiden gegenläufigen Phänomene heben sich effektiv auf, was zu nahezu unveränderten Orbitalwechselwirkungen im Vergleich zu den entsprechenden unkatalysierten Diels-Alder-Reaktionen führt und dies nicht zum aktiven Mechanismus hinter Lewis-Säure-katalysierten Diels-Alder-Reaktionen macht.
Lewis-Säure-katalysierte Reaktionen zeigen neben der Geschwindigkeitsbeschleunigung manchmal eine erhöhte Stereoselektivität, was die Entwicklung von Stereoinduktionsmodellen stimulierte. Die Modelle haben ihre Wurzeln in der Kenntnis der Strukturen von Lewis-Säure-Carbonyl-Komplexen, die durch jahrzehntelange Forschung in theoretischen Berechnungen , NMR- Spektroskopie und Röntgenkristallographie in den frühen 1990er Jahren ziemlich fest etabliert waren:
- σ-Komplexierung: Der Komplex, in dem die Lewis-Säure mit der Carbonylverbindung über eine σ-Bindung mit dem freien Elektronenpaar des Sauerstoffs wechselwirkt, ist sowohl thermodynamisch begünstigt als auch katalytisch relevant. Mehrere Übergangsmetallkomplexe von Aldehyden und Ketonen wurden kristallographisch charakterisiert.
- Gebogene Geometrie: Der Metall-Sauerstoff-Kohlenstoff-Bindungswinkel beträgt weniger als 180°, und das Metall ist syn zum kleineren Substituenten, es sei denn, es wird durch eine Chelatgruppe am größeren Substituenten beeinflusst.
- Eine s-trans- Präferenz für α,β-ungesättigte Verbindungen.
Addition und konjugierte Addition an Carbonylverbindungen
Die Mukaiyama-Aldolreaktion und die Sakurai-Reaktion beziehen sich auf die Addition von Silylenolethern bzw. Allylsilanen an Carbonylverbindungen. Nur unter Lewis-Säure-Katalyse laufen diese Reaktionen unter synthetisch nützlichen Bedingungen ab. Es wird angenommen, dass acyclische Übergangszustände in beiden Reaktionen entweder für die 1,2- oder 1,4-Addition wirksam sind, und sterische Faktoren steuern die Stereoselektivität. Dies steht im Gegensatz zum starren cyclischen Zimmerman-Traxler- Übergangszustand, der für die Aldolreaktion mit Lithium-, Bor- und Titanenolaten weithin akzeptiert wurde . Infolgedessen lässt sich die Doppelbindungsgeometrie im Silylenolether oder Allylsilan nicht gut auf die Produktstereochemie übertragen. Ein von Kumada vorgeschlagenes Modell für die Sakurai 1,2-Addition ist im folgenden Schema dargestellt; das syn- Diastereomer ist vorherrschend, wenn das (E) -Silan verwendet wird, und auch etwas bevorzugt, wenn das (Z) -Silan verwendet wird. Eine ähnliche Analyse von Heathcock erklärt die Tatsache, dass es mit einfachen Substraten im Wesentlichen keine Diastereoselektivität für die intermolekulare Mukaiyama-Aldolreaktion gibt.
Der Lewis-Säure-Katalysator spielt eine Rolle bei der Stereoselektivität, wenn der Aldehyd an das Metallzentrum chelatisieren und eine starre cyclische Zwischenstufe bilden kann. Das stereochemische Ergebnis stimmt dann mit der Annäherung des Nucleophils anti an den sperrigeren Substituenten am Ring überein .
Diels-Erle-Reaktion
Lewis-Säuren wie ZnCl 2 , BF 3 , SnCl 4 , AlCl 3 und MeAlCl 2 können Diels-Alder-Reaktionen sowohl mit normalem als auch inversem Elektronenbedarf katalysieren . Die Geschwindigkeitserhöhung ist oft dramatisch, und die Regioselektivität gegenüber ortho- oder para-ähnlichen Produkten wird oft verbessert, wie die Reaktion zwischen Isopren und Methylacrylat zeigt .
Es wird angenommen, dass die katalysierte Diels-Alder-Reaktion konzertiert ist . Eine rechnerische Untersuchung auf B3LYP/6-31G(d)-Niveau hat jedoch gezeigt, dass der Übergangszustand der BF 3 -katalysierten Diels-Alder-Reaktion zwischen Propenal und 1,3-Butadien asynchroner ist als der der thermischen Reaktion – die weiter von der Carbonylgruppe entfernte Bindung wird vor der anderen Bindung gebildet.
En-Reaktion
Die Carbonyl-En-Reaktion wird in synthetischen Anwendungen fast immer durch Lewis-Säuren katalysiert. Basierend auf kinetischen Isotopeneffektstudien wurde ein schrittweiser oder weitgehend asynchroner Mechanismus für die katalysierte Reaktion vorgeschlagen . Nichtsdestotrotz werden cyclische Übergangszustände häufig herangezogen, um die Diastereoselektivität zu interpretieren. In einem bahnbrechenden Übersichtsartikel in den frühen 1990er Jahren schlugen Mikami und Kollegen einen späten, sesselartigen Übergangszustand vor, der viele beobachtete stereochemische Ergebnisse, einschließlich der Rolle des sterischen Anspruchs für die Diastereoselektivität, erklären könnte:
In jüngerer Zeit führte dieselbe Gruppe jedoch HF/6-31G*-Rechnungen zu Zinn- oder Aluminium-Lewis-Säure-katalysierten En-Reaktionen durch. Unter Berufung daß Methylformiat gloxylate Chelate tin Lewis - Säuren , aber nicht diejenigen , Aluminium, aufgerufen sie einen frühen, umschlagartigen Übergangszustand und das divergente stereochemische Ergebnis der En - Reaktion zwischen rationalisierten (E) -2-buten und Methylglyoxylat.
Anwendung in der Synthese
Lewis-Säure-katalysierte Carbonyladditionen werden routinemäßig zur Bildung von Kohlenstoff-Kohlenstoff-Bindungen in der Naturstoffsynthese eingesetzt . Die ersten beiden unten gezeigten Reaktionen stammen aus der Synthese von (+)-Lycoflexin bzw. Zaragozinsäure C, die direkte Anwendungen von Sakurai- und Mukaiyama-Reaktionen sind. Die dritte Reaktion auf dem Weg zu (+)-Fawcettimin ist eine Lewis-Säure-katalysierte Cyclopropanöffnung, die einer Mukaiyama- Michael-Reaktion analog ist .
Die durch Lewis-Säuren katalysierte oder geförderte Diels-Alder-Reaktion ist eine leistungsfähige und weit verbreitete Methode in der Naturstoffsynthese , um in einem einzigen Schritt mit stereochemischer Kontrolle komplexe Gerüststrukturen zu erreichen. Die beiden unten gezeigten Reaktionen sind eine intramolekulare Diels-Alder-Reaktion zu (–)-Fusarisetin A bzw. eine intermolekulare Hetero-Diels-Alder-Reaktion zu (–)-Epibatidin.
Bei der Friedel-Crafts- Alkylierung fördert eine Lewis-Säure – normalerweise ein einfaches Metallhalogenidsalz – die heterolytische Spaltung einer Kohlenstoff-Halogen-Bindung in einem Alkylhalogenid und erzeugt ein Carbokation , das eine elektrophile aromatische Substitution eingeht . Obwohl sie in der Synthese sehr nützlich ist, leidet die Reaktion oft an Nebenreaktionen, die aus einer Carbokation- Umlagerung, einer Alkylmigration und einer Überalkylierung resultieren. In ähnlicher Weise hilft bei der Friedel-Crafts- Acylierung eine Lewis-Säure bei der Bildung eines Acyliumions aus einem Säurechlorid (oder gelegentlich Säureanhydrid). Obwohl oft angenommen wird, dass das Acyliumion das aktive Intermediat ist, gibt es Hinweise darauf, dass das protonierte Acyliumdikation das aktive Elektrophil ist, das anschließend eine elektrophile aromatische Substitution eingeht.
Wichtige Varianten der Friedel-Crafts-Reaktion sind die Chlormethylierung (mit Formaldehyd und HCl), die Formylierung (mit HCl und CO oder CN − ) und die Acylierung mit einem Nitril als Acylquelle. Die Acylierung auf Nitrilbasis ist besonders nützlich, da sie eine direkte ortho-Acylierung von Anilin ohne Schutz der Amingruppe ermöglicht. Eine Kombination aus einer schwachen und einer starken Lewis-Säure ist notwendig, damit die Reaktion über den unten gezeigten Mechanismus abläuft. Geleitet von diesem Mechanismus und ausgestattet mit dem Wissen, dass Galliumtrihalogenide zu den stärksten Lewis-Säuren gehören, konnten Prozesschemiker bei Merck hocheffiziente Bedingungen für diese Bedingung für einen Wirkstoffkandidaten entwickeln.
Asymmetrische Lewis-Säure-Katalyse
Gemeinsame chirale Liganden
Die asymmetrische Katalyse durch Lewis-Säuren beruht auf Katalysatoren mit chiralen Liganden, die an das Metallzentrum koordiniert sind. Im Laufe der Jahre hat sich eine kleine Anzahl von chiralen Ligandengerüsten durch "privilegierte" katalytische Eigenschaften hervorgetan, die für eine breite Palette von Anwendungen geeignet sind, oft mit nicht verwandten Mechanismen. Aktuelle Forschungsbemühungen in der asymmetrischen Lewis-Säure-Katalyse verwenden oder modifizieren diese Liganden meist, anstatt neue Gerüste de novo zu schaffen . Die "privilegierten" Gerüste haben einige gemeinsame Merkmale, einschließlich chemischer Stabilität und relativer Einfachheit der Ausarbeitung. Die meisten Gerüste sind mehrzähnig . Die meisten von ihnen weisen auch eine hohe Gerüststeifigkeit innerhalb des Liganden auf. Einige von ihnen haben ziemlich ausgereifte Stereoinduktionsmodelle zur Verfügung. Einige "privilegierte" Gerüste, wie sie von Jacobsen und Zhou identifiziert wurden, werden im Folgenden vorgestellt.
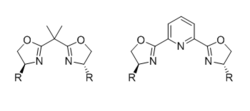
Bisoxazoline (BOX)
Die gebräuchlichsten chiralen Bisoxazolin(BOX)-Liganden bestehen aus zwei identischen chiralen Oxazolin-Einheiten, die an den 4-Positionen durch eine sperrige Gruppe substituiert und durch einen Linker verbunden sind. Der Ligand ist zweizähnig, wenn der Linker eine einzelne Kohlenstoffeinheit ist, ist jedoch dreizähnig (normalerweise meridional), wenn der Linker ein zusätzliches koordinierendes Atom trägt, wie beispielsweise ein Pyridinstickstoff im Fall von PyBOX-Liganden. Die Auswirkungen von Liganden Zähnigkeit und aktiver Zwischengeometrie auf dem stereochemische Ergebnis gründlich überprüft wurden.
Viele zweizähnige BOX-basierte Lewis-Säure-katalysierte Reaktionen basieren auf Kupfer(II)-Katalysatoren mit Substraten, die für die Zweipunktbindung geeignet sind. Das stereochemische Ergebnis stimmt mit einem verdrillten quadratisch-planaren Intermediat überein , das basierend auf verwandten Kristallstrukturen vorgeschlagen wurde. Der Substituent an der 4-Position des Oxazolins blockiert eine enantiotope Seite des Substrats, was zu Enantioselektivität führt. Dies wird in der folgenden Aldol- Reaktion demonstriert , ist aber auf eine Vielzahl von Reaktionen anwendbar, wie Mannich- Reaktionen, En-Reaktionen , Michael-Additionen , Nazarov-Cyclisierungen und Hetero- Diels-Alder-Reaktionen .
Andererseits würde die Zweipunktbindung an einer Lewis-Säure mit dem meridional dreizähnigen PyBOX-Liganden zu einem quadratisch-pyramidalen Komplex führen. Eine Studie mit Benzyloxyacetaldehyd als Elektrophil zeigte, dass das stereochemische Ergebnis mit der äquatorialen Bindung des Carbonylsauerstoffs und der axialen Bindung des Ethersauerstoffs übereinstimmt.
BINAP
BINAP (2,2'-Diphenylphosphino-1,1'-binaphthyl) wurde von Noyori entwickelt und ist eine Familie chiraler Diphosphinliganden mit zwei Triarylphosphin-Einheiten, die auf einem Binaphthalin-Rückgrat installiert sind. BINAP chelatisiert mit einem Metall (normalerweise ein spätes Übergangsmetall), um einen C 2 -symmetrischen Komplex zu bilden. Wie unten in der Struktur eines (R) -BINAP- Rutheniumkomplexes gezeigt , werden von den vier verbleibenden Koordinationsstellen an einem oktaedrischen Metallzentrum die beiden äquatorialen Stellen (violett) stark von den äquatorialen Phenylgruppen beeinflusst, während die beiden axialen Stellen ( grün) werden von den axialen Phenylgruppen beeinflusst.
Basierend auf der Struktur wurden Modelle für die beobachtete Enantioselektivität in vielen BINAP-basierten Lewis-Säure-katalysierten Reaktionen vorgeschlagen. In der unten gezeigten palladiumkatalysierten enantioselektiven Diels-Alder-Reaktion wird beispielsweise angenommen, dass das Dienophil das Metallzentrum an den äquatorialen Stellen koordiniert. Somit versperrt die äquatoriale Phenylgruppe am Phosphor die Si- Fläche , was zu einer ausgezeichneten Enantioselektivität führt. Ein sehr ähnliches Modell wurde verwendet, um das Ergebnis einer nickelkatalysierten asymmetrischen Enolatalkylierung zu erklären, bei der das Substrat auch ein Auxiliar trägt, das es ihm ermöglicht, mit dem Metall zu chelatisieren . Andererseits wird angenommen, dass eine Kupfer(I)-katalysierte Hetero-En-Reaktion über ein tetraedrisches Intermediat verläuft, was einen alternativen Modus der Stereoinduktion durch Veränderung des Metallzentrums bietet.
BINOL
BINOL (1,1'-Binaphthyl-2,2'-diol) wird üblicherweise in Verbindung mit oxophilen Lewis-sauren Metallen wie Aluminium, Titan, Zirkonium und verschiedenen Seltenerdmetallen verwendet. In Fällen, in denen BINOL selbst keine ideale enantioselektive Kontrolle bietet, kann es leicht durch Substitution an den 3,3'-Positionen (über Lithiierung ) und 6,6'-Positionen (über die 6,6'-Dibromid-Verbindung, hergestellt durch elektrophile aromatische Substitution ) zur Modulation des sterischen Volumens und der elektronischen Eigenschaften. Beispielsweise wurden Aluminiumkatalysatoren auf Basis von sperrigen 3,3'-Disilyl-substituierten BINOL als frühe Beispiele für katalytische asymmetrische Hetero- Diels-Alder-Reaktionen und Claisen-Umlagerungen entwickelt , während elektronenziehende Gruppen an den 6,6'-Positionen eingeführt wurden war entscheidend für die Erhöhung der Lewis-Acidität und damit der katalytischen Aktivität von Zirconium(IV)-Katalysatoren in Richtung einer Mannich- Reaktion. Bisher wurde jedoch kein Modell für die entscheidenden Faktoren der BINOL-gerichteten Stereoinduktion allgemein akzeptiert.
TADDOL
TADDOL steht für Tetraaryl-1,3-dioxolan-4,5-dimethanol. Die breite Anwendung von Titan-TADDOLat-Katalysatoren für Carbonyladditionen und Cycloadditionen wurde von Seebach und Mitarbeitern vorgestellt und in einem bahnbrechenden Übersichtsartikel umfassend zusammengefasst, in dem ein funktionierendes Stereoinduktionsmodell vorgelegt wurde, das mit der beobachteten Selektivität in einer Vielzahl von Reaktionen übereinstimmt trotz des Fehlens eines klaren Bildes des Mechanismus.
Anwendungen
Die Lewis-Säure-Katalyse wurde im Schritt der Asymmetrieeinstellung für die Synthese vieler Naturstoffe eingesetzt . Die unten gezeigte erste Reaktion aus der Synthese des Taxangerüsts verwendet einen Katalysator auf Kupferbasis, der von einem chiralen Phosphoramiditliganden getragen wird, für eine konjugierte Carbonyladditionsreaktion. Die zweite Reaktion, aus der Synthese von ent - Hyperforin , verwendet eine Eisen pybox Katalysator für eine asymmetrische Diels-Alder - Reaktion .