Lysin - Lysine
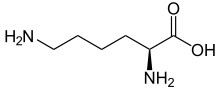
Skelettformel von L- Lysin
|
|||
|
|
|||
| Namen | |||
|---|---|---|---|
|
IUPAC-Name
(2 S ) -2,6-Diaminohexansäure ( L - lysin) (2 R ) -2,6-Diaminohexansäure ( D - lysin)
|
|||
| Andere Namen
Lysin, D - Lysin, L - Lysin, LYS, H-Lys-OH
|
|||
| Bezeichner | |||
|
3D-Modell ( JSmol )
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA-Infokarte |
100.000.673 |
||
| KEGG | |||
|
PubChem- CID
|
|||
| UNII | |||
|
|||
|
|||
| Eigenschaften | |||
| C 6 H 14 N 2 O 2 | |||
| Molmasse | 146,190 g·mol -1 | ||
| 1,5 kg/l | |||
| Pharmakologie | |||
| B05XB03 ( WER ) | |||
| Ergänzende Datenseite | |||
|
Brechungsindex ( n ), Dielektrizitätskonstante (ε r ) usw. |
|||
|
Thermodynamische
Daten |
Phasenverhalten fest-flüssig-gas |
||
| UV , IR , NMR , MS | |||
|
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Infobox-Referenzen | |||
Lysin (Symbol Lys oder K ) ist eine α-Aminosäure , die bei der Biosynthese von Proteinen verwendet wird . Es enthält eine α-Aminogruppe (die unter biologischen Bedingungen in der protonierten -NH 3 + -Form vorliegt), eine α-Carbonsäuregruppe (die unter biologischen Bedingungen in der deprotonierten -COO - -Form vorliegt) und ein Seitenketten-Lysyl ( (CH 2 ) 4 NH 2 ), wobei es als basische , geladene (bei physiologischem pH) aliphatische Aminosäure klassifiziert wird. Es wird von den Codons AAA und AAG kodiert . Wie fast alle anderen Aminosäuren ist der α-Kohlenstoff chiral und Lysin kann sich entweder auf ein Enantiomer oder eine racemische Mischung aus beiden beziehen . Für die Zwecke dieses Artikels bezieht sich Lysin auf das biologisch aktive Enantiomer L-Lysin, bei dem der α-Kohlenstoff in der S-Konfiguration vorliegt.
Der menschliche Körper kann Lysin nicht synthetisieren. Es ist für den Menschen lebensnotwendig und muss über die Nahrung aufgenommen werden. In Organismen, die Lysin synthetisieren, hat es zwei Hauptbiosynthesewege , den Diaminopimelat- und den α-Aminoadipat- Weg, die unterschiedliche Enzyme und Substrate verwenden und in verschiedenen Organismen vorkommen. Der Lysin- Katabolismus erfolgt über einen von mehreren Wegen, von denen der Saccharopin-Weg am häufigsten ist .
Lysin spielt beim Menschen mehrere Rollen, vor allem die Proteinogenese , aber auch bei der Vernetzung von Kollagenpolypeptiden , der Aufnahme essentieller Mineralstoffe und bei der Produktion von Carnitin , das für den Fettsäurestoffwechsel entscheidend ist . Lysin ist auch häufig an Histonmodifikationen beteiligt und beeinflusst somit das Epigenom . Die ε- Aminogruppe nimmt häufig an Wasserstoffbrückenbindungen und als allgemeine Base in der Katalyse teil . Die ε- Ammoniumgruppe (NH 3 + ) ist an das vierte Kohlenstoffatom des α-Kohlenstoffs gebunden, das an die Carboxylgruppe (C=OOH) gebunden ist.
Aufgrund seiner Bedeutung in mehreren biologischen Prozessen kann ein Mangel an Lysin zu verschiedenen Krankheitszuständen führen, einschließlich defektem Bindegewebe, gestörtem Fettsäurestoffwechsel, Anämie und systemischem Protein-Energie-Mangel. Im Gegensatz dazu kann ein Überschuss an Lysin, der durch einen ineffektiven Katabolismus verursacht wird, schwere neurologische Störungen verursachen .
Lysin wurde erstmals 1889 vom deutschen Biochemiker Ferdinand Heinrich Edmund Drechsel aus dem Protein Casein in Milch isoliert . Er nannte es „ Lysin “. 1902 bestimmten die deutschen Chemiker Emil Fischer und Fritz Weigert die chemische Struktur von Lysin, indem sie es synthetisierten.
Biosynthese
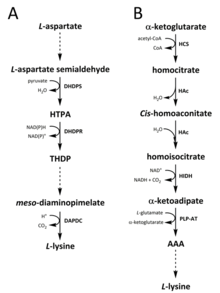
Für die Synthese von Lysin wurden in der Natur zwei Wege identifiziert. Der Diaminopimelat (DAP)-Weg gehört zur Familie der von Aspartat abgeleiteten Biosynthese, die auch an der Synthese von Threonin , Methionin und Isoleucin beteiligt ist . Während der α-Aminoadipat (AAA)-Weg zur Familie der Glutamat- Biosynthese gehört.
Der DAP-Weg wird sowohl in Prokaryoten als auch in Pflanzen gefunden und beginnt mit der durch die Dihydrodipicolinatsynthase (DHDPS) (EC 4.3.3.7) katalysierten Kondensationsreaktion zwischen dem von Aspartat abgeleiteten L- Aspartat-Semialdehyd und Pyruvat zur Bildung von (4 S )-4-Hydroxy -2,3,4,5-tetrahydro- (2 S ) -dipicolinic Säure (HPTA). Das Produkt wird dann durch Dihydrodipicolinat-Reduktase (DHDPR) (EC 1.3.1.26) mit NAD(P)H als Protonendonor reduziert , um 2,3,4,5-Tetrahydrodipicolinat (THDP) zu ergeben. Von diesem Punkt an wurden vier Variationen des Stoffwechselweges gefunden, nämlich der Acetylase-, Aminotransferase-, Dehydrogenase- und Succinylase-Weg. Sowohl der Acetylase- als auch der Succinylase-Variantenweg verwenden vier enzymkatalysierte Schritte, der Aminotransferase-Weg verwendet zwei Enzyme und der Dehydrogenase-Weg verwendet ein einzelnes Enzym. Diese vier Varianten Wege konvergieren bei der Bildung des vorletzten Produkt, meso -diaminopimelate, das anschließend enzymatisch decarboxyliert in einer irreversiblen Reaktion katalysiert durch Diaminopimelatdecarboxylase (DAPDC) (EC 4.1.1.20) zur Herstellung von L - Lysin. Der DAP-Weg wird auf mehreren Ebenen reguliert, einschließlich stromaufwärts bei den Enzymen, die an der Aspartat-Prozessierung beteiligt sind, sowie beim anfänglichen DHDPS-katalysierten Kondensationsschritt. Lysin verleiht diesen Enzymen eine starke negative Rückkopplungsschleife und reguliert anschließend den gesamten Stoffwechselweg.
Der AAA-Weg beinhaltet die Kondensation von α-Ketoglutarat und Acetyl-CoA über das Zwischenprodukt AAA für die Synthese von L- Lysin. Es wurde gezeigt, dass dieser Weg bei mehreren Hefearten sowie bei Protisten und höheren Pilzen vorhanden ist. Es wurde auch berichtet, dass eine alternative Variante des AAA-Weges in Thermus thermophilus und Pyrococcus horikoshii gefunden wurde , was darauf hinweisen könnte, dass dieser Weg in Prokaryonten weiter verbreitet ist als ursprünglich vorgeschlagen. Der erste und geschwindigkeitsbestimmende Schritt im AAA-Weg ist die durch Homocitrat-Synthase (HCS) (EC 2.3.3.14) katalysierte Kondensationsreaktion zwischen Acetyl-CoA und α-Ketoglutarat zum Zwischenprodukt Homocitryl-CoA, das durch die hydrolysiert wird gleiches Enzym, um Homocitrat zu produzieren . Homocitrat wird durch Homoaconitase (HAc) (EC 4.2.1.36) enzymatisch dehydratisiert , um cis- Homoaconitat zu ergeben . HAc katalysiert dann eine zweite Reaktion , in der cis -homoaconitate erfährt Rehydratation zu produzieren homoisocitrate . Das resultierende Produkt durchläuft eine oxidative Decarboxylierung durch Homoisocitrat-Dehydrogenase (HIDH) (EC 1.1.1.87) zu α-Ketoadipat. AAA wird dann über eine Pyridoxal 5'-Phosphat (PLP) -abhängige Aminotransferase (PLP-AT) (EC 2.6.1.39) unter Verwendung von Glutamat als Aminodonor gebildet. Von diesem Punkt an variiert der AAA-Pfad mit [fehlt hier etwas? -> zumindest Abschnittsüberschrift! ] über das Königreich. In Pilzen wird AAA über die AAA-Reduktase (EC 1.2.1.95) in einem einzigartigen Prozess, der sowohl eine Adenylierung als auch eine Reduktion umfasst und durch eine Phosphopantetheinyl-Transferase (EC 2.7.8.7) aktiviert wird, zu α-Aminoadipat-Semialdehyd reduziert . Sobald der Semialdehyd gebildet ist, katalysiert Saccharopin- Reduktase (EC 1.5.1.10) eine Kondensationsreaktion mit Glutamat und NAD(P)H als Protonendonor, und das Imin wird reduziert, um das vorletzte Produkt, Saccharopin, herzustellen. Der letzte Schritt des Stoffwechselwegs in Pilzen beinhaltet die Saccharopin-Dehydrogenase (SDH) (EC 1.5.1.8) katalysierte oxidative Desaminierung von Saccharopin, was zu L- Lysin führt. Bei einer Variante des AAA-Wegs, die in einigen Prokaryoten gefunden wird, wird AAA zuerst in N- Acetyl-α-aminoadipat umgewandelt, das phosphoryliert und dann reduktiv zum ε-Aldehyd dephosphoryliert wird . Der Aldehyd wird dann zu N- Acetyl-Lysin transaminiert , das zu L -Lysin deacetyliert wird . Die Enzyme, die an diesem varianten Weg beteiligt sind, müssen jedoch weiter validiert werden.
Katabolismus
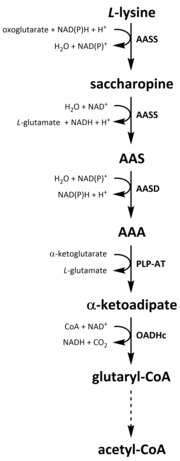
Wie alle Aminosäuren, Katabolismus von Lysin aus der Aufnahme von diätetischen Lysin oder aus dem Abbau von initiierte intrazelluläre Protein. Katabolismus wird auch als Mittel verwendet, um die intrazelluläre Konzentration von freiem Lysin zu kontrollieren und einen Steady-State aufrechtzuerhalten , um die toxischen Wirkungen von überschüssigem freiem Lysin zu verhindern. Am Lysin-Katabolismus sind mehrere Wege beteiligt, aber der am häufigsten verwendete ist der Saccharopin-Weg, der bei Tieren hauptsächlich in der Leber (und entsprechenden Organen) stattfindet, insbesondere in den Mitochondrien . Dies ist die Umkehrung des zuvor beschriebenen AAA-Wegs. In Tieren und Pflanzen werden die ersten beiden Schritte des Saccharopin-Wegs durch das bifunktionelle Enzym α-Aminoadipinsäure-Semialdehyd-Synthase (AASS) katalysiert , die sowohl Lysin-Ketoglutarat-Reduktase (LKR) (EC 1.5.1.8) als auch SDH-Aktivität besitzt, während in anderen Organismen wie Bakterien und Pilzen werden diese beiden Enzyme von separaten Genen kodiert . Der erste Schritt beinhaltet die LKR-katalysierte Reduktion von L- Lysin in Gegenwart von α-Ketoglutarat, um Saccharopin zu produzieren, wobei NAD(P)H als Protonendonor fungiert. Saccharopin durchläuft dann eine Dehydratisierungsreaktion, katalysiert durch SDH in Gegenwart von NAD + , um AAS und Glutamat zu produzieren. AAS-Dehydrogenase (AASD) (EC 1.2.1.31) dehydratisiert dann das Molekül weiter zu AAA. Anschließend katalysiert PLP-AT die umgekehrte Reaktion zu der des AAA-Biosynthesewegs, was dazu führt, dass AAA in α-Ketoadipat umgewandelt wird. Das Produkt, α‑Ketoadipat, wird in Gegenwart von NAD + und Coenzym A zu Glutaryl-CoA decarboxyliert , das daran beteiligte Enzym muss jedoch noch vollständig aufgeklärt werden. Einige Hinweise deuten darauf hin, dass der 2-Oxoadipat-Dehydrogenase-Komplex (OADHc), der strukturell homolog zur E1-Untereinheit des Oxoglutarat-Dehydrogenase-Komplexes (OGDHc) (EC 1.2.4.2) ist, für die Decarboxylierungsreaktion verantwortlich ist. Schließlich wird Glutaryl-CoA durch die Glutaryl-CoA-Dehydrogenase (EC 1.3.8.6) oxidativ zu Croton-CoA decarboxyliert , die anschließend durch mehrere enzymatische Schritte zu Acetyl-CoA weiterverarbeitet wird; ein essentieller Kohlenstoffmetabolit , der am Tricarbonsäurezyklus (TCA) beteiligt ist .
Nährwert
Lysin ist eine essentielle Aminosäure beim Menschen. Der Nahrungsbedarf des Menschen variiert von ~60 mg·kg −1 ·d −1 im Säuglingsalter bis ~30 mg·kg −1 ·d −1 bei Erwachsenen. Dieser Bedarf wird in einer westlichen Gesellschaft üblicherweise durch die Aufnahme von Lysin aus Fleisch- und Gemüsequellen gedeckt, die weit über dem empfohlenen Bedarf liegt. Bei vegetarischer Ernährung ist die Aufnahme von Lysin aufgrund der begrenzten Lysinmenge in Getreidekulturen im Vergleich zu Fleischquellen geringer .
Angesichts der limitierenden Lysinkonzentration in Getreide wird seit langem spekuliert, dass der Lysingehalt durch gentechnische Verfahren erhöht werden kann . Häufig haben diese Praktiken die absichtliche Fehlregulation des DAP-Wegs durch die Einführung von Lysin-Feedback-unempfindlichen Orthologen des DHDPS-Enzyms involviert. Diese Verfahren haben wahrscheinlich aufgrund der toxischen Nebenwirkungen von erhöhtem freien Lysin und indirekten Auswirkungen auf den TCA-Zyklus nur begrenzten Erfolg gehabt . Pflanzen akkumulieren Lysin und andere Aminosäuren in Form von Samenspeicherproteinen , innerhalb dem Samen der Pflanze gefunden, und dies stellt den eßbaren Komponente von Getreide. Dies unterstreicht die Notwendigkeit, nicht nur freies Lysin zu erhöhen, sondern Lysin auch auf die Synthese stabiler Samenspeicherproteine zu lenken und anschließend den Nährwert der konsumierbaren Komponente von Nutzpflanzen zu erhöhen. Während genetische Modifikationsverfahren nur begrenzten Erfolg hatten, ermöglichten traditionellere selektive Züchtungstechniken die Isolierung von " Quality Protein Maize ", der den Lysin- und Tryptophanspiegel , ebenfalls eine essentielle Aminosäure, signifikant erhöht hat . Dieser Anstieg des Lysin-Gehalts wird einer Opaque-2- Mutation zugeschrieben, die die Transkription von Lysin-Mangel- Zein- verwandten Samenspeicherproteinen reduziert und dadurch die Häufigkeit anderer lysinreicher Proteine erhöht. Allgemein ist die Begrenzung Fülle von Lysin in zu überwinden Vieh wird Futtermittel, industriell hergestellte Lysin zugesetzt. Der industrielle Prozess umfasst die fermentative Kultivierung von Corynebacterium glutamicum und die anschließende Reinigung von Lysin.
Nahrungsquellen
Gute Lysinquellen sind proteinreiche Lebensmittel wie Eier, Fleisch (insbesondere rotes Fleisch, Lamm, Schweinefleisch und Geflügel), Soja , Bohnen und Erbsen, Käse (insbesondere Parmesan) und bestimmte Fische (wie Kabeljau und Sardinen ). Lysin ist die limitierende Aminosäure (die essentielle Aminosäure, die in der kleinsten Menge in dem jeweiligen Lebensmittel vorkommt) in den meisten Getreidekörnern , aber in den meisten Hülsenfrüchten (Leguminosen) reichlich vorhanden . Eine vegetarische oder eiweißarme Ernährung kann für Protein, einschließlich Lysin, ausreichend sein, wenn sie sowohl Getreidekörner als auch Hülsenfrüchte enthält, aber es ist nicht erforderlich, dass die beiden Lebensmittelgruppen in denselben Mahlzeiten verzehrt werden.
Ein Lebensmittel gilt als ausreichend lysinhaltig, wenn es mindestens 51 mg Lysin pro Gramm Protein enthält (so dass das Protein 5,1 % Lysin enthält). L-Lysin HCl wird als Nahrungsergänzungsmittel verwendet und liefert 80,03 % L-Lysin. Als solches ist 1 g L-Lysin in 1,25 g L-Lysin-HCl enthalten.
Biologische Rollen
Die häufigste Rolle für Lysin ist die Proteinogenese. Lysin spielt häufig eine wichtige Rolle in der Proteinstruktur . Da seine Seitenkette eine positiv geladene Gruppe an einem Ende und einen langen hydrophoben Kohlenstoffschwanz in der Nähe des Rückgrats enthält, wird Lysin als etwas amphipathisch angesehen . Aus diesem Grund kann Lysin sowohl vergraben als auch häufiger in Lösungsmittelkanälen und auf der Außenseite von Proteinen gefunden werden, wo es mit der wässrigen Umgebung interagieren kann. Lysin kann auch zur Proteinstabilität beitragen, da seine ε-Aminogruppe häufig an Wasserstoffbrückenbindungen , Salzbrücken und kovalenten Wechselwirkungen beteiligt ist, um eine Schiffsche Base zu bilden .
Eine zweite wichtige Rolle von Lysin ist in epigenetischen Regulation durch Histon - Modifikation . Es gibt mehrere Arten von kovalenten Histonmodifikationen, die üblicherweise Lysinreste beinhalten, die im hervorstehenden Schwanz von Histonen vorkommen. Modifikationen umfassen oft die Zugabe oder Entfernung eines Acetyls (-CH 3 CO) , das Acetyllysin bildet oder zu Lysin zurückkehrt, bis zu drei Methyl- (-CH 3 ) , Ubiquitin oder eine Sumoproteingruppe . Die verschiedenen Modifikationen haben nachgeschaltete Auswirkungen auf die Genregulation , bei der Gene aktiviert oder unterdrückt werden können.
Lysin wird auch eine Schlüsselrolle bei anderen biologischen Prozessen zugeschrieben, einschließlich; Strukturproteine von Bindegeweben , Calcium - Homöostase und Fettsäuremetabolismus . Es wurde gezeigt, dass Lysin an der Vernetzung zwischen den drei helikalen Polypeptiden in Kollagen beteiligt ist , was zu seiner Stabilität und Zugfestigkeit führt. Dieser Mechanismus ähnelt der Rolle von Lysin in bakteriellen Zellwänden , bei denen Lysin (und meso- Diaminopimelat) für die Bildung von Quervernetzungen und daher die Stabilität der Zellwand entscheidend sind. Dieses Konzept wurde zuvor untersucht, um die unerwünschte Freisetzung von potenziell pathogenen genetisch veränderten Bakterien zu umgehen . Es wurde vorgeschlagen, dass ein auxotropher Stamm von Escherichia coli ( X 1776) für alle Verfahren zur genetischen Modifikation verwendet werden könnte, da der Stamm ohne die Supplementierung von DAP nicht überleben kann und daher außerhalb einer Laborumgebung nicht leben kann. Es wurde auch vorgeschlagen, dass Lysin an der intestinalen Calciumresorption und der renalen Retention beteiligt ist und somit eine Rolle bei der Calciumhomöostase spielen könnte . Schließlich hat sich Lysin als Vorstufe von Carnitin erwiesen , das Fettsäuren zu den Mitochondrien transportiert , wo sie zur Energiefreisetzung oxidiert werden können. Carnitin wird aus Trimethyllysin synthetisiert , das ein Produkt des Abbaus bestimmter Proteine ist, da solches Lysin zuerst in Proteine eingebaut und methyliert werden muss, bevor es zu Carnitin umgewandelt werden kann. Bei Säugetieren ist die Hauptquelle für Carnitin jedoch die Nahrungsquelle und nicht die Umwandlung von Lysin.
In Opsinen wie Rhodopsin und den visuellen Opsinen (kodiert durch die Gene OPN1SW , OPN1MW und OPN1LW ) bildet Retinaldehyd eine Schiff-Base mit einem konservierten Lysinrest, und die Wechselwirkung von Licht mit der Retinylidengruppe verursacht die Signalübertragung beim Farbsehen (siehe visueller Zyklus für Details).
Umstrittene Rollen
Es wurde lange diskutiert, dass Lysin, wenn es intravenös oder oral verabreicht wird, die Freisetzung von Wachstumshormonen signifikant erhöhen kann . Dies hat dazu geführt, dass Athleten Lysin als Mittel zur Förderung des Muskelwachstums während des Trainings verwenden, jedoch wurden bisher keine signifikanten Beweise für diese Anwendung von Lysin gefunden.
Da die Proteine des Herpes-simplex-Virus (HSV) reicher an Arginin und ärmer an Lysin sind als die Zellen, die sie infizieren, wurden Lysin-Ergänzungen als Behandlung versucht. Da die beiden Aminosäuren im Darm aufgenommen, in der Niere zurückgewonnen und von denselben Aminosäuretransportern in die Zellen transportiert werden , würde ein Überfluss an Lysin theoretisch die für die Virusreplikation verfügbare Argininmenge begrenzen. Klinische Studien liefern keine guten Beweise für die Wirksamkeit als Prophylaxe oder bei der Behandlung von HSV-Ausbrüchen. Als Reaktion auf Produktangaben, dass Lysin die Immunantwort auf HSV verbessern könnte, ergab eine Überprüfung der Europäischen Behörde für Lebensmittelsicherheit keine Hinweise auf eine Ursache-Wirkungs-Beziehung. Derselbe Bericht, der 2011 veröffentlicht wurde, fand keine Beweise für die Behauptung, dass Lysin den Cholesterinspiegel senken, den Appetit steigern, in irgendeiner anderen Rolle als ein gewöhnlicher Nährstoff zur Proteinsynthese beitragen oder die Kalziumaufnahme oder -retention erhöhen könnte.
Rollen bei Krankheiten
Krankheiten im Zusammenhang mit Lysin sind eine Folge der nachgelagerten Verarbeitung von Lysin, dh des Einbaus in Proteine oder der Modifikation in alternative Biomoleküle. Die Rolle von Lysin in Kollagen wurde oben beschrieben, jedoch wurde ein Mangel an Lysin und Hydroxylysin, die an der Vernetzung von Kollagenpeptiden beteiligt sind, mit einem Krankheitszustand des Bindegewebes in Verbindung gebracht. Da Carnitin ein wichtiger von Lysin abgeleiteter Metabolit ist, der am Fettsäurestoffwechsel beteiligt ist, kann eine minderwertige Ernährung mit einem Mangel an Carnitin und Lysin zu einem verringerten Carnitinspiegel führen, was erhebliche Auswirkungen auf die Gesundheit einer Person haben kann. Lysine wurde auch eine Rolle spielen gezeigt Anämie , wie Lysin vermutet wird , eine Wirkung auf die Aufnahme von haben , Eisen und anschließend die Konzentration von Ferritin in Plasma Blut . Der genaue Wirkmechanismus ist jedoch noch nicht geklärt. Am häufigsten wird ein Lysinmangel in nicht-westlichen Gesellschaften beobachtet und manifestiert sich als Protein-Energie-Mangelernährung , die tiefgreifende und systemische Auswirkungen auf die Gesundheit des Einzelnen hat. Es gibt auch eine erbliche genetische Erkrankung, die Mutationen in den Enzymen beinhaltet, die für den Lysin-Katabolismus verantwortlich sind, nämlich das bifunktionelle AASS-Enzym des Saccharopin-Wegs. Aufgrund eines fehlenden Lysin-Katabolismus reichert sich die Aminosäure im Plasma an und die Patienten entwickeln eine Hyperlysinämie , die sich asymptomatisch bis hin zu schweren neurologischen Behinderungen einschließlich Epilepsie , Ataxie , Spastizität und psychomotorischer Beeinträchtigung zeigen kann . Die klinische Bedeutung der Hyperlysinämie wird in der Fachwelt diskutiert, wobei in einigen Studien kein Zusammenhang zwischen körperlichen oder geistigen Behinderungen und Hyperlysinämie festgestellt wurde. Darüber hinaus wurden Mutationen in Genen im Zusammenhang mit dem Lysinstoffwechsel mit mehreren Krankheitszuständen in Verbindung gebracht, darunter Pyridoxin-abhängige Epilepsie ( ALDH7A1-Gen ), α-Ketoadipinsäure und α-Aminoadipinsäure ( DHTKD1-Gen ) und Glutarazidurie Typ 1 ( GCDH Gen ).
Hyperlysinurie ist durch hohe Lysinmengen im Urin gekennzeichnet. Es ist oft auf eine Stoffwechselerkrankung zurückzuführen, bei der ein Protein, das am Abbau von Lysin beteiligt ist, aufgrund einer genetischen Mutation nicht funktionsfähig ist. Es kann auch aufgrund eines Versagens des renalen tubulären Transports auftreten.
Verwendung von Lysin in Tierfutter
Die Lysinproduktion für Tierfutter ist ein weltweit bedeutender Industriezweig und erreichte 2009 fast 700.000 Tonnen mit einem Marktwert von über 1,22 Milliarden Euro. Lysin ist ein wichtiger Zusatzstoff in Tierfutter, da es eine limitierende Aminosäure bei der Wachstumsoptimierung bestimmter Tiere wie Schweine und Hühner für die Fleischproduktion ist. Eine Lysin-Supplementierung ermöglicht die Verwendung von kostengünstigerem Pflanzenprotein (z. B. Mais anstelle von Soja ) bei gleichzeitiger Aufrechterhaltung hoher Wachstumsraten und einer Begrenzung der Belastung durch Stickstoffausscheidung. Die Phosphatbelastung ist jedoch wiederum eine große Umweltbelastung, wenn Mais als Futtermittel für Geflügel und Schweine verwendet wird.
Lysin wird industriell durch mikrobielle Fermentation hauptsächlich aus Zucker hergestellt. Die gentechnische Forschung verfolgt aktiv Bakterienstämme, um die Effizienz der Produktion zu verbessern und die Herstellung von Lysin aus anderen Substraten zu ermöglichen.
In der Populärkultur
Der Film Jurassic Park aus dem Jahr 1993 (basierend auf dem gleichnamigen Roman von Michael Crichton aus dem Jahr 1990 ) zeigt Dinosaurier , die genetisch so verändert wurden , dass sie kein Lysin produzieren konnten, ein Beispiel für künstliche Auxotrophie . Dies war als "Lysin-Kontingenz" bekannt und sollte verhindern, dass die geklonten Dinosaurier außerhalb des Parks überleben, und sie zwingen, auf Lysin-Ergänzungen durch das Veterinärpersonal des Parks angewiesen zu sein. In Wirklichkeit sind keine Tiere in der Lage, Lysin zu produzieren (es ist eine essentielle Aminosäure ).
1996 geriet Lysin in den Mittelpunkt eines Preisfestsetzungsverfahrens , des größten in der Geschichte der Vereinigten Staaten. Die Archer Daniels Midland Company zahlte eine Geldstrafe von 100 Millionen US-Dollar, und drei ihrer Führungskräfte wurden verurteilt und verbüßten Gefängnisstrafen. Im Preisabsprachenverfahren wurden auch zwei japanische Firmen ( Ajinomoto , Kyowa Hakko) und eine südkoreanische Firma (Sewon) für schuldig befunden . Geheime Videoaufzeichnungen der Verschwörer, die den Preis von Lysin festsetzten, können online gefunden werden oder das Video beim US-Justizministerium, Abteilung Kartellrecht, angefordert werden. Dieser Fall diente als Grundlage für den Film The Informant! , und ein Buch mit dem gleichen Titel .
Verweise
![]() Dieser Artikel wurde von der folgenden Quelle unter einer CC BY 4.0- Lizenz ( 2018 ) angepasst ( Berichte von Gutachtern ):
Cody J Hall; Tatiana P. Soares da Costa (1. Juni 2018). "Lysin: Biosynthese, Katabolismus und Rollen" (PDF) . WikiJournal of Science . 1 (1): 4. doi : 10.15347/WJS/2018.004 . ISSN 2470-6345 . Wikidata Q55120301 .
Dieser Artikel wurde von der folgenden Quelle unter einer CC BY 4.0- Lizenz ( 2018 ) angepasst ( Berichte von Gutachtern ):
Cody J Hall; Tatiana P. Soares da Costa (1. Juni 2018). "Lysin: Biosynthese, Katabolismus und Rollen" (PDF) . WikiJournal of Science . 1 (1): 4. doi : 10.15347/WJS/2018.004 . ISSN 2470-6345 . Wikidata Q55120301 .