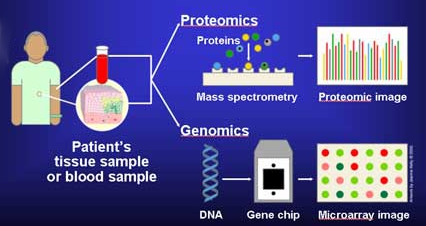
Molekulare Diagnostik - Molecular diagnostics
Molekulardiagnostik ist eine Sammlung von Techniken, die verwendet werden, um biologische Marker im Genom und Proteom zu analysieren und wie ihre Zellen ihre Gene als Proteine exprimieren , wobei die Molekularbiologie auf medizinische Tests angewendet wird . In der Medizin wird die Technik verwendet, um Krankheiten zu diagnostizieren und zu überwachen, Risiken zu erkennen und zu entscheiden, welche Therapien für einzelne Patienten am besten funktionieren, und in der landwirtschaftlichen Biosicherheit ähnlich wie bei der Überwachung von Pflanzen- und Viehkrankheiten , der Risikoabschätzung und der Entscheidung, welche Quarantänemaßnahmen ergriffen werden müssen .
Durch die Analyse der Besonderheiten des Patienten und seiner Erkrankung bietet die Molekulardiagnostik die Perspektive einer personalisierten Medizin . Diese Tests sind in einer Reihe medizinischer Fachgebiete nützlich , darunter Infektionskrankheiten , Onkologie , humane Leukozyten-Antigen- Typisierung (die die Immunfunktion untersucht und vorhersagt ), Gerinnung und Pharmakogenomik – die genetische Vorhersage, welche Medikamente am besten funktionieren. Sie überschneiden sich mit der klinischen Chemie (medizinische Untersuchungen an Körperflüssigkeiten).
Geschichte
Das Gebiet der Molekularbiologie wuchs Ende des 20. Jahrhunderts ebenso wie ihre klinische Anwendung. 1980 haben Yuet Wai Kan et al . schlugen einen pränatalen genetischen Test für Thalassämie vor , der nicht auf DNA-Sequenzierung beruhte – damals noch in den Kinderschuhen – sondern auf Restriktionsenzymen , die DNA dort schneiden, wo sie spezifische kurze Sequenzen erkennen, wodurch unterschiedliche Längen des DNA-Strangs erzeugt werden, je nachdem, welches Allel (genetische Variation) der Fötus ist besessen. In den 1980er Jahren wurde der Begriff in den Namen von Unternehmen wie Molecular Diagnostics Incorporated und Bethseda Research Laboraties Molecular Diagnostics verwendet .
In den 1990er Jahren führte die Identifizierung neu entdeckter Gene und neuer Techniken zur DNA-Sequenzierung zur Entstehung eines eigenen Feldes der molekularen und genomischen Labormedizin; 1995 wurde zur Strukturierung die Association for Molecular Pathology (AMP) gegründet. 1999 war das AMP Mitbegründer des Journal of Medical Diagnostics . Informa Healthcare ins Leben gerufen Expertentests in der medizinischen Diagnostik im Jahr 2001. Ab dem Jahr 2002 das HapMap - Projekt aggregiert Informationen über die Ein-Buchstaben - genetischen Unterschiede , dass recur in den menschlichen Bevölkerung der Einzelnukleotid - Polymorphismen -und ihre Beziehung mit der Krankheit. Im Jahr 2012 verwenden molekulare Diagnosetechniken für Thalassämie genetische Hybridisierungstests , um den spezifischen Einzelnukleotid-Polymorphismus zu identifizieren, der die Krankheit eines Individuums verursacht.
Mit zunehmender Bedeutung der kommerziellen Anwendung der Molekulardiagnostik steht auch die Debatte um die Patentierung der genetischen Entdeckungen im Mittelpunkt . Im Jahr 1998 die Europäische Union ist die Richtlinie 98/44 / ECclarified , dass Patente auf DNA - Sequenzen waren zulässig. Im Jahr 2010 verklagte AMP Myriad Genetics in den USA, um deren Patente in Bezug auf zwei Gene, BRCA1 , BRCA2 , anzufechten , die mit Brustkrebs in Verbindung gebracht werden. Im Jahr 2013 stimmte der Oberste Gerichtshof der USA teilweise zu und entschied, dass eine natürlich vorkommende Gensequenz nicht patentiert werden könne.
Techniken
Entwicklung aus Forschungswerkzeugen
Die Industrialisierung molekularbiologischer Assay-Tools hat ihren Einsatz in Kliniken praktikabel gemacht. Die Miniaturisierung in ein einziges Handgerät kann die medizinische Diagnostik in die Klinik, ins Büro oder nach Hause bringen. Das klinische Labor erfordert hohe Zuverlässigkeitsstandards; Diagnostik kann eine Akkreditierung erfordern oder unter die Vorschriften für Medizinprodukte fallen. Ab 2011 verwendeten einige klinische Labors in den USA dennoch Assays, die nur für "Forschungszwecke" verkauft wurden.
Laborprozesse müssen Vorschriften wie den Clinical Laboratory Improvement Amendments , Health Insurance Portability and Accountability Act , Good Laboratory Practice und den Spezifikationen der Food and Drug Administration in den Vereinigten Staaten einhalten . Laborinformationsmanagementsysteme helfen bei der Verfolgung dieser Prozesse. Die Verordnung gilt sowohl für Personal als auch für Lieferungen. Ab 2012 verlangen zwölf US-Bundesstaaten die Zulassung von Molekularpathologen; mehrere Gremien wie das American Board of Medical Genetics und das American Board of Pathology zertifizieren Technologen, Supervisoren und Laborleiter.
Automatisierung und Proben-Barcoding maximieren den Durchsatz und reduzieren die Möglichkeit von Fehlern oder Kontaminationen bei der manuellen Handhabung und Ergebnisberichterstattung. Einzelne Geräte zur Durchführung des Assays von Anfang bis Ende sind jetzt erhältlich.
Tests
Die Molekulardiagnostik verwendet biologische In-vitro- Assays wie PCR- ELISA oder Fluoreszenz-in-situ-Hybridisierung . Der Test detektiert ein Molekül, oft in geringen Konzentrationen, dass a Marker der Erkrankung oder das Risiko in einer Probe von einem Patienten entnommen. Die Konservierung der Probe vor der Analyse ist entscheidend. Manuelle Handhabung sollte minimiert werden. Das fragile RNA- Molekül stellt gewisse Herausforderungen. Als Teil des zellulären Prozesses der Expression von Genen als Proteine bietet es ein Maß für die Genexpression, ist jedoch anfällig für Hydrolyse und Abbau durch allgegenwärtige RNAse-Enzyme . Proben können in flüssigem Stickstoff schockgefroren oder in Konservierungsmitteln inkubiert werden.
Da molekulardiagnostische Verfahren sensitive Marker erkennen können, sind diese Tests weniger intrusiv als eine herkömmliche Biopsie . Da beispielsweise im menschlichen Plasma zellfreie Nukleinsäuren vorhanden sind , kann eine einfache Blutprobe ausreichen, um genetische Informationen von Tumoren, Transplantaten oder einem ungeborenen Fötus zu entnehmen. Viele, aber nicht alle molekulardiagnostischen Verfahren, die auf dem Nachweis von Nukleinsäuren basieren , verwenden die Polymerase-Kettenreaktion (PCR), um die Anzahl der Nukleinsäuremoleküle erheblich zu erhöhen, wodurch die Zielsequenz(en) in der Patientenprobe amplifiziert wird. PCR ist eine Methode, bei der eine Template-DNA unter Verwendung synthetischer Primer, einer DNA-Polymerase und dNTPs amplifiziert wird. Die Mischung wird zwischen mindestens 2 Temperaturen zyklisch durchlaufen: einer hohen Temperatur zum Denaturieren doppelsträngiger DNA in einzelsträngige Moleküle und einer niedrigen Temperatur für den Primer, um an die Matrize zu hybridisieren und für die Polymerase, um den Primer zu verlängern. Jeder Temperaturzyklus verdoppelt theoretisch die Menge der Zielsequenz. Der Nachweis von Sequenzvariationen unter Verwendung von PCR umfasst typischerweise das Design und die Verwendung von Oligonukleotidreagenzien, die die interessierende Variante effizienter amplifizieren als die Wildtypsequenz. Die PCR ist derzeit die am weitesten verbreitete Methode zum Nachweis von DNA-Sequenzen. Der Nachweis des Markers kann durch Real-Time-PCR, direkte Sequenzierung, Microarray-Chips – vorgefertigte Chips, die viele Marker gleichzeitig testen, oder MALDI-TOF erfolgen. Das gleiche Prinzip gilt für das Proteom und das Genom . Protein-Arrays mit hohem Durchsatz können komplementäre DNA oder Antikörper zum Binden verwenden und somit viele verschiedene Proteine parallel nachweisen. Molekulardiagnostische Tests variieren stark in Bezug auf Sensitivität, Durchlaufzeit, Kosten, Abdeckung und behördliche Zulassung. Sie unterscheiden sich auch in der Validierungsstufe, die in den Labors angewendet wird, die sie verwenden. Daher ist eine robuste lokale Validierung in Übereinstimmung mit den behördlichen Anforderungen und der Einsatz geeigneter Kontrollen erforderlich, insbesondere wenn das Ergebnis als Grundlage für eine Patientenbehandlungsentscheidung dienen kann.
Leistungen
Pränatal
Herkömmliche pränatale Tests auf Chromosomenanomalien wie das Down-Syndrom beruhen auf der Analyse der Anzahl und des Aussehens der Chromosomen – des Karyotyps . Molekulardiagnostische Tests wie der Microarray Comparative Genomic Hybridization Test eine DNA-Probe statt und wegen zellfreier DNA im Plasma könnten weniger invasiv sein, sind aber seit 2013 immer noch eine Ergänzung zu den konventionellen Tests.
Behandlung
Einige der Einzelnukleotidpolymorphismen eines Patienten – leichte Unterschiede in ihrer DNA – können helfen, vorherzusagen, wie schnell sie bestimmte Medikamente metabolisieren; dies wird Pharmakogenomik genannt . Beispielsweise metabolisiert das Enzym CYP2C19 mehrere Medikamente, wie den Gerinnungshemmer Clopidogrel , in ihre aktiven Formen. Einige Patienten besitzen an bestimmten Stellen des 2C19-Gens Polymorphismen, die diese Medikamente schlecht metabolisieren ; Ärzte können auf diese Polymorphismen testen und herausfinden, ob die Medikamente bei diesem Patienten voll wirksam sind. Fortschritte in der Molekularbiologie haben dazu beigetragen, zu zeigen, dass einige Syndrome, die zuvor als eine einzige Krankheit eingestuft wurden, tatsächlich mehrere Subtypen mit völlig unterschiedlichen Ursachen und Behandlungen sind. Die molekulare Diagnostik kann helfen, den Subtyp zu diagnostizieren – zum Beispiel von Infektionen und Krebs – oder die genetische Analyse einer Krankheit mit erblicher Komponente, wie dem Silver-Russell-Syndrom .
Ansteckende Krankheit
Die molekulare Diagnostik dient der Erkennung von Infektionskrankheiten wie Chlamydien , Grippeviren und Tuberkulose ; oder spezifische Stämme wie das H1N1-Virus oder SARS-CoV-2 . Die genetische Identifizierung kann schnell erfolgen; zum Beispiel diagnostiziert ein Schleifen-vermittelter isothermer Amplifikationstest den Malariaparasiten und ist robust genug für Entwicklungsländer. Aber trotz dieser Fortschritte in der Genomanalyse werden Infektionen 2013 noch häufiger auf andere Weise identifiziert – über ihr Proteom, Bakteriophagen oder chromatographisches Profil. Die molekulare Diagnostik dient auch dazu, den spezifischen Stamm des Erregers zu verstehen – etwa indem er erkennt, welche Resistenzgene er besitzt – und somit welche Therapien vermieden werden sollten. Darüber hinaus können Assays basierend auf metagenomischer Next-Generation-Sequenzierung implementiert werden, um pathogene Organismen ohne Verzerrungen zu identifizieren.
Krankheitsrisikomanagement
Das Genom eines Patienten kann eine vererbte oder zufällige Mutation enthalten, die die Wahrscheinlichkeit einer zukünftigen Entwicklung einer Krankheit beeinflusst. Das Lynch-Syndrom zum Beispiel ist eine genetische Erkrankung , die Patienten für kolorektalen und anderen Krebs prädisponiert ; Früherkennung kann zu einer engmaschigen Überwachung führen, die die Chancen des Patienten auf ein gutes Ergebnis verbessert. Das kardiovaskuläre Risiko wird durch biologische Marker angezeigt und das Screening kann das Risiko messen, dass ein Kind mit einer genetischen Krankheit wie Mukoviszidose geboren wird . Gentests sind ethisch komplex: Patienten möchten möglicherweise nicht den Stress haben, ihr Risiko zu kennen. In Ländern ohne allgemeine Gesundheitsversorgung kann ein bekanntes Risiko die Versicherungsprämien erhöhen.
Krebs
Krebs ist eine Veränderung der zellulären Prozesse, die dazu führt, dass ein Tumor außer Kontrolle gerät. Krebszellen weisen manchmal Mutationen in Onkogenen wie KRAS und CTNNB1 (β-Catenin) auf. Die Analyse der molekularen Signatur von Krebszellen – der DNA und ihrer Expression über Boten-RNA – ermöglicht es Ärzten, den Krebs zu charakterisieren und die beste Therapie für ihre Patienten auszuwählen. Ab 2010 sind Assays, die eine Reihe von Antikörpern gegen spezifische Proteinmarkermoleküle enthalten, eine aufkommende Technologie; Es gibt Hoffnungen für diese Multiplex-Assays, die viele Marker gleichzeitig messen könnten. Andere potenzielle zukünftige Biomarker sind Mikro-RNA-Moleküle , von denen Krebszellen mehr exprimieren als gesunde.
Krebs ist eine Krankheit mit übermäßigen molekularen Ursachen und einer ständigen Evolution. Es gibt auch eine Heterogenität der Krankheit sogar bei einem Individuum. Molekulare Krebsstudien haben die Bedeutung von Treibermutationen für das Wachstum und die Metastasierung von Tumoren nachgewiesen. Für die Krebsforschung wurden viele Technologien zum Nachweis von Sequenzvariationen entwickelt. Diese Technologien lassen sich im Allgemeinen in drei Ansätze einteilen: Polymerase-Kettenreaktion (PCR), Hybridisierung und Next-Generation-Sequencing (NGS). Derzeit sind viele PCR- und Hybridisierungsassays von der FDA als In-vitro-Diagnostika zugelassen. NGS-Assays befinden sich jedoch noch in einem frühen Stadium der klinischen Diagnostik.
Um den molekulardiagnostischen Test auf Krebs durchzuführen, ist eines der wichtigsten Probleme der Nachweis von DNA-Sequenzvariationen. Für die Diagnostik verwendete Tumorbiopsieproben enthalten im Vergleich zur Wildtypsequenz immer nur 5 % der Zielvariante. Auch für nichtinvasive Anwendungen aus peripherem Blut oder Urin muss der DNA-Test spezifisch genug sein, um Mutationen bei varianten Allelfrequenzen von weniger als 0,1% nachzuweisen.
Derzeit gibt es durch die Optimierung der traditionellen PCR eine neue Erfindung, das Amplifikations-refraktäre Mutationssystem (ARMS) ist eine Methode zum Nachweis von DNA-Sequenzvarianten bei Krebs. Das Prinzip hinter ARMS besteht darin, dass die enzymatische Verlängerungsaktivität von DNA-Polymerasen gegenüber Fehlpaarungen in der Nähe des 3'-Endes des Primers hochempfindlich ist. Viele verschiedene Unternehmen haben diagnostische Tests auf Basis von ARMS-PCR-Primern entwickelt. Qiagen therascreen, Roche cobas und Biomerieux THxID haben beispielsweise von der FDA zugelassene PCR-Tests zum Nachweis von Lungen-, Dickdarmkrebs und metastasierenden Melanommutationen in den Genen KRAS, EGFR und BRAF entwickelt. Ihre IVD-Kits wurden grundsätzlich an genomischer DNA validiert, die aus FFPE-Gewebe extrahiert wurde.
Es gibt auch Microarrays, die Hybridisierungsmechanismen nutzen, um Krebs zu diagnostizieren. Mehr als eine Million verschiedener Sonden können auf einem Array mit der Genechip-Technologie von Affymetrix mit einer Nachweisgrenze von einer bis zehn Kopien der mRNA pro Vertiefung synthetisiert werden. Von optimierten Mikroarrays wird typischerweise angenommen, dass sie eine wiederholbare relative Quantifizierung verschiedener Targets erzeugen. Derzeit hat die FDA bereits eine Reihe von diagnostischen Assays unter Verwendung von Microarrays zugelassen: Die MammaPrint-Assays von Agendia können das Risiko eines erneuten Auftretens von Brustkrebs durch Profilierung der Expression von 70 Genen im Zusammenhang mit Brustkrebs aufklären; Autogenomics INFNITI CYP2C19 Assay kann genetische Polymorphismen profilieren, deren Auswirkungen auf die therapeutische Reaktion auf Antidepressiva groß sind; und CytoScan Dx von Affymetrix kann geistige Behinderungen und angeborene Störungen durch die Analyse von Chromosomenmutationen beurteilen.
Künftig werden sich die Diagnosewerkzeuge für Krebs wahrscheinlich auf das Next Generation Sequencing (NGS) konzentrieren. Durch die Nutzung der DNA- und RNA-Sequenzierung für die Krebsdiagnostik wird sich die Technologie im Bereich der molekularen Diagnosewerkzeuge besser entwickeln. Obwohl der Durchsatz und der Preis von NGS in den letzten 10 Jahren dramatisch um das 100-Fache reduziert wurden, sind wir noch mindestens 6 Größenordnungen davon entfernt, eine Tiefensequenzierung auf gesamter Genomebene durchzuführen. Derzeit hat Ion Torrent einige NGS-Panels basierend auf translationalem AmpliSeq entwickelt, beispielsweise den Oncomine Comprehensive Assay. Sie konzentrieren sich auf die Nutzung der Tiefensequenzierung von krebsbezogenen Genen, um seltene Sequenzvarianten zu erkennen.
Die molekulare Diagnostik kann zur Bewertung des Krebsrisikos verwendet werden. Zum Beispiel bewertet der BRCA1/2-Test von Myriad Genetics Frauen auf das lebenslange Brustkrebsrisiko. Außerdem werden einige Krebsarten nicht immer mit klaren Symptomen eingesetzt. Es ist sinnvoll, Menschen zu analysieren, die keine offensichtlichen Symptome zeigen und so Krebs im Frühstadium erkennen können. Der ColoGuard-Test kann beispielsweise verwendet werden, um Menschen über 55 auf Darmkrebs zu untersuchen . Krebs ist eine Langzeiterkrankung mit verschiedenen Progressionsstufen, molekulardiagnostische Instrumente können zur Prognose der Krebsprogression eingesetzt werden. Beispielsweise kann der OncoType Dx-Test von Genomic Health das Brustkrebsrisiko einschätzen. Ihre Technologie kann Patienten auffordern, sich bei Bedarf einer Chemotherapie zu unterziehen, indem sie die RNA-Expressionsniveaus im Biopsiegewebe von Brustkrebs untersucht.
Angesichts der steigenden staatlichen Unterstützung für die molekulare DNA-Diagnostik wird erwartet, dass in Kürze eine zunehmende Zahl klinischer DNA-Nachweisassays für Krebs verfügbar sein wird. Derzeit entwickelt sich die Forschung in der Krebsdiagnostik rasant mit dem Ziel niedrigere Kosten, weniger Zeitaufwand und einfachere Methoden für Ärzte und Patienten.
Siehe auch
- Molekulare Medizin (das breitere Feld des molekularen Verständnisses von Krankheiten)
- Molekulare Pathologie
- Labor entwickelter Test
- Pathogenese
- Pathogenomik
- Pathologie
- Präzisionsmedizin
- Personalisierte Medizin