Myelin-Oligodendrozyten-Glykoprotein - Myelin oligodendrocyte glycoprotein
Myelin-Oligodendrozyten-Glykoprotein ( MOG ) ist ein Glykoprotein, von dem angenommen wird, dass es bei der Myelinisierung von Nerven im Zentralnervensystem (ZNS) wichtig ist . Beim Menschen wird dieses Protein vom MOG- Gen kodiert . Es wird spekuliert, dass es als notwendiges "Adhäsionsmolekül" dient, um der Myelinscheide strukturelle Integrität zu verleihen, und es ist bekannt, dass es sich spät auf dem Oligodendrozyten entwickelt .
Molekulare Funktion
Während die primäre molekulare Funktion von MOG noch nicht bekannt ist, liegt seine wahrscheinliche Rolle bei der Myelinscheide entweder in der "Vervollständigung und/oder Aufrechterhaltung der Scheide". Genauer gesagt wird vermutet, dass MOG als "Adhäsionsmolekül" an der Myelinscheide des ZNS "notwendig" ist, um die strukturelle Integrität der Myelinscheide bereitzustellen."
Es wurde gezeigt, dass die cDNA- kodierende Region von MOG beim Menschen "hochgradig homolog" zu Ratten, Mäusen und Rindern ist und daher hochkonserviert ist. Dies legt "eine wichtige biologische Rolle für dieses Protein" nahe.
Physiologie
Das Gen für MOG, gefunden auf Chromosom 6 p21.3-p22, wurde erstmals 1995 sequenziert. Es ist ein Transmembranprotein, das auf der Oberfläche von Oligodendrozytenzellen und auf der äußersten Oberfläche der Myelinscheiden exprimiert wird . "MOG ist ein quantitativ untergeordnetes Typ-I-Transmembranprotein und kommt ausschließlich im ZNS vor Kern Transkript ... ist 15.561 Nukleotide lang „und für den Menschen, es hat acht Exons , die sind‚getrennt durch sieben Introns ‘. Die Introns‚enthalten zahlreiche reptitive [ sic ] DNA‘Sequenzen, unter denen“ 14 Alu - Sequenzen innerhalb von 3 Introns " und haben einen Bereich von 242 bis 6484 bp.
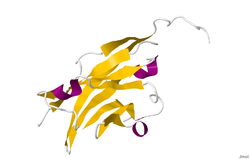
Struktur
Wegen der alternativ aus menschlicher mRNA gespleißten MOG-Gene bilden sich mindestens neun Isoformen.
Die Kristallstruktur des Myelin-Oligodendrozyten-Glykoproteins wurde durch Röntgenbeugung mit einer Auflösung von 1,45 Angström unter Verwendung von Protein aus der norwegischen Ratte bestimmt. Dieses Protein ist 139 Reste lang und gehört zur Immunglobulin-Superfamilie. Die dssp-Sekundärstruktur des Proteins ist 6% helical und 43% Beta-Faltblatt: Es gibt drei kurze helikale Segmente und zehn Beta-Stränge. Die Beta-Stränge befinden sich innerhalb von zwei antiparallelen Beta-Faltblättern, die eine Immunglobulin-ähnliche Beta-Sandwich-Falte bilden. Mehrere Merkmale der Proteinstruktur legen nahe, dass MOG eine Rolle als "Adhäsin bei der Vervollständigung und/oder Verdichtung der Myelinscheide" spielt. Es gibt einen "signifikanten Streifen" elektronegativer Ladung, der in der Nähe des N-Terminus beginnt und etwa die halbe Länge des Moleküls verläuft. Außerdem wurde gezeigt, dass MOG in Lösung dimerisiert und der Formkomplementaritätsindex an der Dimergrenzfläche hoch ist, was auf ein "biologisch relevantes MOG-Dimer" hinweist.
Synthese
Entwicklungsbedingt wird MOG „sehr spät auf Oligodendrozyten und der Myelinscheide“ gebildet.
Rolle bei Krankheiten
Nichtentzündliche demyelinisierende Erkrankungen
Das Interesse an MOG hat sich auf seine Rolle bei demyelinisierenden Krankheiten konzentriert . Einige von ihnen sind nicht entzündlich, wie Adrenoleukodystrophie , verschwindende weiße Substanz und Röteln-induzierte geistige Behinderung.
Anti-MOG-assoziierte entzündliche demyelinisierende Erkrankungen
MOG hat einen Großteil seiner Laboraufmerksamkeit in Studien zu MS erhalten. Mehrere Studien haben eine Rolle von Antikörpern gegen MOG in der Pathogenese der MS gezeigt, obwohl die meisten von ihnen vor der Entdeckung von NMO-IgG und des NMO-Spektrums von Krankheiten geschrieben wurden.
Der Anti-MOG-Status ist unterschiedlich, je nachdem, ob er durch ELISA oder durch Microarray ( CBA ) gemessen wird . Der richtige Weg zur Identifizierung ist ein Microarray, bei dem Patientenserum mit lebenden Zellen reagiert und das bindende IgG über einen fluoreszenzmarkierten sekundären Antikörper nachgewiesen wird.
In Tiermodellen
Tiermodelle von MS, EAE , haben gezeigt, dass "MOG-spezifische EAE-Modelle (von verschiedenen Tierstämmen) die menschliche Multiple Sklerose zeigen / spiegeln", aber im Wesentlichen den an der Optikusneuritis beteiligten Teil erklärt. Diese Modelle mit Anti-MOG-Antikörpern wurden untersucht und gelten als die einzigen Antikörper mit demyelinisierender Kapazität, aber auch hier ist die EAE-Pathologie näher an NMO und ADEM als an der bei MS beobachteten konfluenten Demyelinisierung.
Die Anti-MOG-vermittelte Demyelinisierung verhält sich in Tiermodellen ähnlich wie NMO und gilt derzeit sogar als Biomarker gegen die MS-Diagnose
Bei seronegativer Neuromyelitis optica
Es wurde festgestellt, dass Anti-MOG-Autoimmunität an der seronegativen NMO und auch an der Optikusneuritis beteiligt ist und einige fulminante Formen von ADEM- MOG-Antikörpern bei NMOSD variieren je nach Seropositivitätsstatus
Unter anderen Bedingungen
Das Vorhandensein von Anti-MOG-Autoantikörpern wurde mit den folgenden Erkrankungen in Verbindung gebracht:
- Einige Fälle von Aquaporin-4-seronegativer Neuromyelitis optica: NMO, abgeleitet von einer Anti-MOG-assoziierten Enzephalomyelitis ,
- Einige Fälle von akuter disseminierter Enzephalomyelitis , insbesondere die rezidivierenden (MDEM) und die fulminanten Verläufe
- Einige Fälle von Multipler Sklerose
- isolierte Optikusneuritis oder transversale Myelitis