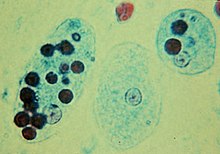
Phagozytose - Phagocytosis
Phagozytose (aus dem Altgriechischen φαγεῖν ( Phagein ) „essen“ und κύτος , ( kytos ) „Zelle“) ist der Prozess, bei dem eine Zelle ihre Plasmamembran verwendet , um ein großes Partikel (≥ 0,5 μm) zu verschlingen, wodurch ein inneres Kompartiment, das Phagosom genannt wird . Es ist eine Art von Endozytose . Eine Zelle, die eine Phagozytose durchführt, wird als Phagocyte bezeichnet .
Im Immunsystem eines vielzelligen Organismus ist die Phagozytose ein wichtiger Mechanismus zur Entfernung von Krankheitserregern und Zelltrümmern. Das aufgenommene Material wird dann im Phagosom verdaut. Bakterien, tote Gewebezellen und kleine Mineralpartikel sind alles Beispiele für Objekte, die phagozytiert werden können. Einige Protozoen verwenden Phagozytose als Mittel, um Nährstoffe zu erhalten.
Geschichte
Phagozytose wurde zuerst vom kanadischen Arzt William Osler (1876) festgestellt und später von Élie Metchnikoff (1880, 1883) untersucht und benannt .
Im Immunsystem

Die Phagozytose ist einer der Hauptmechanismen der angeborenen Immunabwehr . Es ist einer der ersten Prozesse, der auf eine Infektion reagiert , und ist auch einer der initiierenden Zweige einer adaptiven Immunantwort . Obwohl die meisten Zellen zur Phagozytose fähig sind, führen einige Zelltypen diese als Teil ihrer Hauptfunktion aus. Diese werden als „professionelle Fresszellen“ bezeichnet. Die Phagozytose ist evolutionär alt und kommt sogar bei Wirbellosen vor .
Professionelle phagozytäre Zellen
Neutrophile , Makrophagen , Monozyten , dendritische Zellen , Osteoklasten und Eosinophile können als professionelle Fresszellen klassifiziert werden. Die ersten drei haben die größte Rolle bei der Immunantwort auf die meisten Infektionen.
Die Rolle der Neutrophilen besteht darin, den Blutkreislauf zu patrouillieren und nur im Falle einer Infektion in großer Zahl in die Gewebe einzuwandern. Dort wirken sie durch Phagozytose direkt mikrobizide. Nach der Einnahme sind Neutrophile wirksam bei der intrazellulären Abtötung von Krankheitserregern. Neutrophile phagozytieren hauptsächlich über die Fcγ-Rezeptoren und die Komplementrezeptoren 1 und 3. Die mikrobizide Wirkung von Neutrophilen beruht auf einem großen Repertoire an Molekülen, die in vorgeformten Granula vorhanden sind. Enzyme und andere Moleküle, die in diesen Körnchen hergestellt werden, sind Proteasen, wie Collagenase , Gelatinase oder Serinproteasen , Myeloperoxidase , Lactoferrin und antibiotische Proteine. Degranulation von diesen in die phagosome, begleitet von hohen reaktiven Sauerstoffspezies Produktion (oxidative burst) ist hoch mikrobizide.
Monozyten und die daraus reifenden Makrophagen verlassen den Blutkreislauf, um durch Gewebe zu wandern. Dort sind sie residente Zellen und bilden eine Ruhebarriere. Makrophagen initiieren die Phagozytose durch Mannoserezeptoren , Scavenger-Rezeptoren , Fcγ-Rezeptoren und Komplementrezeptoren 1, 3 und 4. Makrophagen sind langlebig und können die Phagozytose fortsetzen, indem sie neue Lysosomen bilden.
Dendritische Zellen befinden sich auch in Geweben und nehmen Krankheitserreger durch Phagozytose auf. Ihre Rolle besteht nicht darin, Mikroben abzutöten oder zu beseitigen, sondern sie für die Antigenpräsentation an die Zellen des adaptiven Immunsystems abzubauen .
Initiierende Rezeptoren
Rezeptoren für die Phagozytose können durch erkannte Moleküle in zwei Kategorien unterteilt werden. Die ersten, opsonischen Rezeptoren, sind von Opsoninen abhängig . Darunter sind Rezeptoren, die den Fc-Teil von gebundenen IgG- Antikörpern erkennen, eingelagertes Komplement oder Rezeptoren, die andere Opsonine von Zell- oder Plasmaursprung erkennen. Nicht-opsonische Rezeptoren umfassen Rezeptoren vom Lektin-Typ, Dectin- Rezeptoren oder Scavenger-Rezeptoren. Einige Phagozytosewege benötigen ein zweites Signal von Mustererkennungsrezeptoren (PRRs), die durch Anheftung an Pathogen-assoziierte molekulare Muster (PAMPS) aktiviert werden , was zur NF-κB- Aktivierung führt.
Fcγ-Rezeptoren
Fcγ-Rezeptoren erkennen mit IgG beschichtete Ziele. Der bekannteste Teil ist das Fc-Fragment . Das Molekül des Rezeptors enthält eine intrazelluläre ITAM-Domäne oder assoziiert mit einem ITAM-enthaltenden Adaptermolekül. ITAM-Domänen übertragen das Signal von der Oberfläche der Fresszelle zum Zellkern. Aktivierende Rezeptoren menschlicher Makrophagen sind beispielsweise FcγRI , FcγRIIA und FcγRIII . Die Fcγ-Rezeptor-vermittelte Phagozytose umfasst die Bildung von Vorsprüngen der Zelle, die als "phagozytische Schale" bezeichnet werden, und aktiviert einen oxidativen Ausbruch in Neutrophilen.
Komplement-Rezeptoren
Diese Rezeptoren erkennen Ziele, die mit C3b , C4b und C3bi beschichtet sind , aus dem Plasmakomplement. Die extrazelluläre Domäne der Rezeptoren enthält eine lektinähnliche Komplementbindungsdomäne. Die Erkennung durch Komplementrezeptoren reicht nicht aus, um eine Internalisierung ohne zusätzliche Signale zu bewirken. In Makrophagen sind CR1 , CR3 und CR4 für die Erkennung von Zielen verantwortlich. Komplementbeschichtete Targets werden durch „Sinken“ in die Phagozytenmembran ohne Vorsprünge internalisiert.
Mannose-Rezeptoren
Mannose und andere pathogenassoziierte Zucker wie Fucose werden vom Mannoserezeptor erkannt. Acht lektinähnliche Domänen bilden den extrazellulären Teil des Rezeptors. Die durch den Mannoserezeptor vermittelte Aufnahme unterscheidet sich in molekularen Mechanismen von der Fcγ-Rezeptor- oder Komplementrezeptor-vermittelten Phagozytose.
Phagosom
Die Aufnahme des Materials wird durch das kontraktile Aktin-Myosin-System erleichtert. Das Phagosom ist die Organelle, die durch Phagozytose von Material gebildet wird. Es bewegt sich dann in Richtung des Zentrosoms der Fresszelle und wird mit Lysosomen fusioniert , wodurch ein Phagolysosom entsteht und zum Abbau führt. Nach und nach wird das Phagolysosom angesäuert, wodurch abbauende Enzyme aktiviert werden.
Der Abbau kann sauerstoffabhängig oder sauerstoffunabhängig sein.
- Der sauerstoffabhängige Abbau hängt von NADPH und der Produktion reaktiver Sauerstoffspezies ab . Wasserstoffperoxid und Myeloperoxidase aktivieren ein Halogenierungssystem, das zur Bildung von Hypochlorit und zur Zerstörung von Bakterien führt.
- Der sauerstoffunabhängige Abbau hängt von der Freisetzung von Granulat ab, das Enzyme wie Lysozymen und kationische Proteine wie Defensine enthält . Andere antimikrobielle Peptide sind in diesen Körnchen vorhanden, einschließlich Lactoferrin , das Eisen maskiert , um ungünstige Wachstumsbedingungen für Bakterien bereitzustellen. Andere Enzyme wie Hyaluronidase, Lipase, Kollagenase, Elastase, Ribonuklease, Desoxyribonuklease spielen ebenfalls eine wichtige Rolle bei der Verhinderung der Ausbreitung von Infektionen und des Abbaus von essentiellen mikrobiellen Biomolekülen, die zum Zelltod führen.
Leukozyten erzeugen während der Phagozytose Blausäure und können Bakterien , Pilze und andere Krankheitserreger abtöten , indem sie mehrere andere giftige Chemikalien erzeugen.
Einige Bakterien, zum Beispiel Treponema pallidum , Escheria coli und Staphylococcus aureus , sind in der Lage, die Phagozytose durch mehrere Mechanismen zu vermeiden.
In Apoptose
Nach der Apoptose müssen die absterbenden Zellen von Makrophagen in das umliegende Gewebe aufgenommen werden, was als Efferozytose bezeichnet wird . Eines der Merkmale einer apoptotischen Zelle ist die Präsentation einer Vielzahl intrazellulärer Moleküle auf der Zelloberfläche, wie Calreticulin , Phosphatidylserin (aus der inneren Schicht der Plasmamembran), Annexin A1 , oxidiertes LDL und veränderte Glykane . Diese Moleküle werden von Rezeptoren auf der Zelloberfläche der Makrophagen wie dem Phosphatidylserin-Rezeptor oder von löslichen (frei schwebenden) Rezeptoren wie Thrombospondin 1 , GAS6 und MFGE8 erkannt , die ihrerseits an andere Rezeptoren auf den Makrophagen wie CD36 . binden und alpha-v-beta-3-Integrin . Defekte in der apoptotischen Zellclearance sind normalerweise mit einer gestörten Phagozytose von Makrophagen verbunden. Die Ansammlung von apoptotischen Zellresten verursacht oft Autoimmunerkrankungen; daher hat die pharmakologische Potenzierung der Phagozytose ein medizinisches Potenzial bei der Behandlung bestimmter Formen von Autoimmunerkrankungen.
Bei Protisten
Bei vielen Protisten wird die Phagozytose als Nahrungsquelle verwendet, um einen Teil oder die gesamte Nahrung bereitzustellen. Dies wird als phagotrophe Ernährung bezeichnet und unterscheidet sich von der osmotrophen Ernährung, die durch Resorption erfolgt.
- Bei einigen, wie Amöben , findet die Phagozytose durch Umgeben des Zielobjekts mit Pseudopodien statt , wie bei tierischen Phagozyten. Beim Menschen kann die Amöbozoe Entamoeba histolytica rote Blutkörperchen phagozytieren .
- Ciliaten beteiligen sich auch an der Phagozytose. Bei Ciliaten gibt es eine spezielle Rille oder Kammer in der Zelle, in der die Phagozytose stattfindet, das Zytostom oder der Mund.
Wie in phagozytische Immunzellen kann das resultierende phagosome mit Lysosomen (verschmolzen Nahrungsvakuolen ) enthaltenden Verdauungsenzymen , eine Form Phagolysosom . Die Nahrungspartikel werden dann verdaut, und die freigesetzten Nährstoffe werden diffundiert oder in das Zytosol transportiert, um in anderen Stoffwechselprozessen verwendet zu werden.
Mixotrophie kann phagotrophe Ernährung und phototrophe Ernährung beinhalten.
Siehe auch
Verweise
Externe Links
-
 Medien im Zusammenhang mit Phagozytose bei Wikimedia Commons
Medien im Zusammenhang mit Phagozytose bei Wikimedia Commons - Phagozytose an der US National Library of Medicine Medical Subject Headings (MeSH)