Phenyllithium - Phenyllithium
|
|
| Namen | |
|---|---|
|
Systematischer IUPAC-Name
Phenyllithium |
|
| Andere Namen
Lithiobenzol
|
|
| Identifikatoren | |
|
3D-Modell ( JSmol )
|
|
| Abkürzungen | LiPh, PhLi |
| 506502 | |
| ChEBI | |
| ChemSpider | |
| ECHA-Infokarte |
100.008.838 |
| EG-Nummer | |
| 2849 | |
| Gittergewebe | Phenyllithium |
|
PubChem- CID
|
|
|
CompTox-Dashboard ( EPA )
|
|
|
|
|
|
| Eigenschaften | |
|
LiC 6h 5 |
|
| Molmasse | 84,045 gmol -1 |
| Aussehen | Farblose Kristalle |
| Dichte | 828 mgcm -3 |
| Siedepunkt | 140 bis 143 °C (284 bis 289 °F; 413 bis 416 K) |
| Reagiert | |
| Thermochemie | |
|
Std
Bildungsenthalpie (Δ f H ⦵ 298 ) |
48,3-52,5 kJmol −1 |
| Gefahren | |
| Sicherheitsdatenblatt | Externes Sicherheitsdatenblatt |
| R-Sätze (veraltet) | R14 , R17 , R23/24/25 , R48 |
| S-Sätze (veraltet) | (S1/2) , S8 , S9 , S16 , S26 , S30 , S46 , S36/37/39 , S45 |
| Verwandte Verbindungen | |
|
Verwandte Verbindungen
|
Phenylkupfer , Phenylnatrium , Phenylcobalt |
|
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Infobox-Referenzen | |
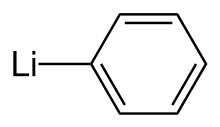
Phenyllithium oder Lithobenzol ist ein metallorganisches Mittel mit der Summenformel C 6 H 5 Li. Es wird am häufigsten als Metallierungsmittel in organischen Synthesen und als Ersatz für Grignard-Reagenzien zur Einführung von Phenylgruppen in organische Synthesen verwendet. Kristallines Phenyllithium ist farblos; Lösungen von Phenyllithium weisen jedoch in Abhängigkeit vom verwendeten Lösungsmittel und den im gelösten Stoff vorhandenen Verunreinigungen verschiedene Braun- oder Rottöne auf.
Vorbereitung
Phenyllithium wurde zuerst durch die Reaktion von Lithiummetall mit Diphenylquecksilber hergestellt :
- (C 6 Η 5 ) 2 Ηg + 2Li → 2C 6 Η 5 Li + Ηg
Die Reaktion eines Phenylhalogenids mit Lithiummetall erzeugt Phenyllithium:
- X-Ph + 2Li → Ph-Li + LiX
Phenyllithium kann auch durch eine Metall-Halogen-Austauschreaktion synthetisiert werden:
- n-BuLi + X-Ph → n-BuX + Ph-Li
Die heute vorherrschende Methode zur Herstellung von Phenyllithium sind die beiden letztgenannten Synthesen.
Reaktionen
PhLi wird hauptsächlich verwendet, um die Bildung von Kohlenstoff-Kohlenstoff-Bindungen durch nukleophile Additions- und Substitutionsreaktionen zu erleichtern:
- PhLi + R 2 C=O → PhR 2 COLi
2-Phenylpyridin wird durch die Reaktion von Phenyllithium mit Pyridin hergestellt, ein Prozess, der einen Additions-Eliminierungs-Weg beinhaltet:
- C 6 H 5 Li + C 5 H 5 N → C 6 H 5 -C 5 H 4 N + LiH
Struktur und Eigenschaften
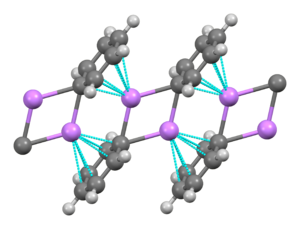
Phenyllithium ist eine Organolithiumverbindung , die monokline Kristalle bildet. Festes Phenyllithium kann als aus dimeren Li 2 Ph 2 -Untereinheiten bestehend beschrieben werden. Die Li-Atome und die ipso- Kohlenstoffatome der Phenylringe bilden einen planaren Vierring. Die Ebene der Phenylgruppen steht senkrecht zur Ebene dieses Li 2 C 2 -Rings. Zwischen diesen Phenyllithiumdimeren und den π-Elektronen der Phenylgruppen in den benachbarten Dimeren treten zusätzliche starke intermolekulare Bindungen auf, was zu einer unendlichen polymeren Leiterstruktur führt.
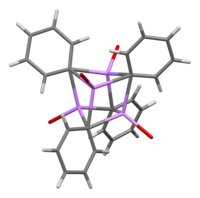
In Lösung nimmt es abhängig vom organischen Lösungsmittel eine Vielzahl von Strukturen an. In Tetrahydrofuran äquilibriert es zwischen Monomer- und Dimerzustand. In Ether, wie es üblicherweise verkauft wird, liegt Phenyllithium als Tetramer vor. Vier Li-Atome und vier ipso-Kohlenstoffzentren besetzen abwechselnde Ecken eines verzerrten Würfels. Ph
Die C-Li-Bindungslängen betragen durchschnittlich 2.33 Å. Ein Ethermolekül bindet über sein Sauerstoffatom an jede der Li-Zentren. In Gegenwart von LiBr, einem Nebenprodukt der direkten Reaktion von Lithium mit einem Phenylhalogenid, wird der [(PhLi•Et 2 O) 4 ]-Komplex stattdessen zu [(PhLi•Et 2 O) 3 •LiBr). Das Li-Atom von LiBr besetzt einen der Lithiumplätze im kubanischen Cluster und das Br-Atom sitzt in einem benachbarten Kohlenstoffplatz.