Hämorrhagische Kaninchenkrankheit - Rabbit hemorrhagic disease
| Virus der hämorrhagischen Kaninchenkrankheit | |
|---|---|
|
|
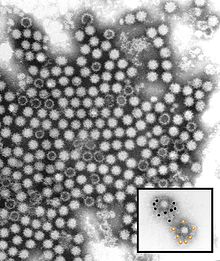
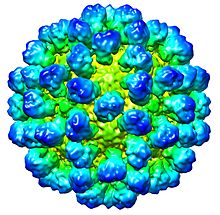
| CryoEM- Rekonstruktion des Viruskapsids . EMDB- Eintrag EMD-1933 | |
|
Virusklassifizierung |
|
| (ohne Rang): | Virus |
| Bereich : | Riboviria |
| Königreich: | Orthornaviren |
| Stamm: | Pisuviricota |
| Klasse: | Pisoniviricetes |
| Befehl: | Picornavirales |
| Familie: | Caliciviridae |
| Gattung: | Lagovirus |
| Spezies: |
Virus der hämorrhagischen Kaninchenkrankheit
|
| Isolate | |
|
|
| Synonyme | |
|
|
Hämorrhagische Kaninchenkrankheit ( RHD ), auch bekannt als virale hämorrhagische Krankheit (VHD), ist eine hochansteckende und tödliche Form der Virushepatitis, die europäische Kaninchen befällt . Einige Virusstämme betreffen auch Hasen und Baumwollschwanzkaninchen. Die Sterblichkeitsraten liegen in der Regel zwischen 70 und 100 Prozent. Die Krankheit wird durch Stämme des Kaninchen-Hemorrhagic-Disease-Virus ( RHDV ), einem Lagovirus aus der Familie der Caliciviridae, verursacht .
Virus der hämorrhagischen Kaninchenkrankheit
Das Kaninchen-Hämorrhagische-Krankheit-Virus (RHDV) ist ein Virus der Gattung Lagovirus und der Familie Caliciviridae . Es ist ein unbehülltes Virus mit einem Durchmesser von etwa 35–40 nm, ikosaedrischer Symmetrie und einem linearen Positiv-Sense-RNA-Genom von 6,4–8,5 kb. RHDV verursacht bei Kaninchen eine generalisierte Infektion, die durch Lebernekrose, disseminierte intravaskuläre Gerinnung und schnellen Tod gekennzeichnet ist. Die Einteilung in Serotypen wurde durch eine fehlende Kreuzneutralisation unter Verwendung spezifischer Antiseren definiert. Kaninchen-Lagoviren umfassen auch verwandte Caliciviren, wie das European Brown-Hase-Syndrom-Virus .
RHDV scheint sich aus einem bereits bestehenden avirulenten Kaninchen-Calicivirus (RCV) entwickelt zu haben. Nicht-pathogene Kaninchen-Caliciviren, die mit RHDV verwandt sind, sich jedoch von RHDV unterscheiden, waren vor dem Auftreten von RHDV anscheinend harmlos in Europa, Australien und Neuseeland im Umlauf. Im Laufe seiner Evolution spaltete sich RHDV in sechs verschiedene Genotypen auf, die alle hochpathogen sind.
Die drei Stämme des hämorrhagischen Kaninchen-Krankheitsvirus von medizinischer Bedeutung sind RHDV, RHDVa und RHDV2. RHDV (auch als RHDV, RHDV1 oder als klassisches RHD bezeichnet) betrifft nur erwachsene europäische Kaninchen ( Oryctolagus cuniculus ). Dieses Virus wurde erstmals 1984 in China gemeldet und verbreitete sich von dort aus in weite Teile Asiens, Europas, Australiens und anderswo. In den Vereinigten Staaten und Mexiko sind einige isolierte Ausbrüche von RHDV aufgetreten, aber sie blieben lokalisiert und wurden ausgerottet.
Im Jahr 2010 wurde in Frankreich ein neues Lagovirus mit einem ausgeprägten Antigenprofil identifiziert. Das neue Virus mit dem Namen Rabbit Hemorrhagic Disease Virus 2 (abgekürzt als RHDV2 oder RHDVb) verursachte ebenfalls RHD, wies jedoch charakteristische genetische, antigene und pathogene Merkmale auf. Bedeutsamerweise tötete RHDV2 Kaninchen, die zuvor mit RHDV-Impfstoffen geimpft worden waren, und betraf junge europäische Kaninchen sowie Hasen ( Lepus spp.). All diese Merkmale deuten stark darauf hin, dass das Virus nicht von RHDVa stammt, sondern von einer anderen unbekannten Quelle. RHDV2 hat sich seitdem in den meisten Teilen Europas sowie in Australien, Kanada und den Vereinigten Staaten verbreitet.
Epidemiologie und Übertragung
Beide Viren, die RHD verursachen, sind extrem ansteckend. Die Übertragung erfolgt durch direkten Kontakt mit infizierten Tieren, Kadavern, Körperflüssigkeiten (Urin, Kot, Atemwegssekrete) und Haaren. Überlebende Kaninchen können bis zu 2 Monate ansteckend sein. Auch kontaminierte Fremdkörper wie Kleidung, Nahrung, Käfige, Einstreu, Futterspender und Wasser verbreiten das Virus. Fliegen, Flöhe und Mücken können das Virus zwischen Kaninchen übertragen. Raubtiere und Aasfresser können das Virus auch verbreiten, indem sie es mit ihrem Kot ausscheiden. Caliciviren sind in der Umwelt sehr resistent und können das Einfrieren für längere Zeit überleben. Das Virus kann monatelang in infiziertem Fleisch und über längere Zeit in zersetzenden Kadavern persistieren. Die Einfuhr von Kaninchenfleisch kann einen wesentlichen Beitrag zur Verbreitung des Virus in neuen geografischen Regionen leisten.
RHD-Ausbrüche treten bei Wildkaninchenpopulationen tendenziell saisonal auf, bei denen die meisten Erwachsenen die Infektion überlebt haben und immun sind. Wenn junge Jungtiere heranwachsen und aufhören zu stillen, erhalten sie nicht mehr die in der Muttermilch enthaltenen Antikörper und werden anfällig für Infektionen. Daher treten RHD- Seuchen während der Brutzeit der Kaninchen häufiger auf.
Im Allgemeinen existiert bei Lagoviren eine hohe Wirtsspezifität. Klassisches RHDVa betrifft nur europäische Kaninchen, eine in Europa heimische Art, von der das Hauskaninchen abstammt. Die neue Variante RHDV2 befällt auch europäische Kaninchen, verursacht aber auch tödliche RHD bei verschiedenen Lepus- Arten, darunter Sardischen Kaphasen ( L. capensis mediterraneus ), Italienischen Hasen ( L. corsicanus ) und Schneehasen ( L. timidus ). Berichte über RHD bei Sylvilagus- Arten stammen aus dem aktuellen Ausbruch in den Vereinigten Staaten.
Durch RHDV und RHDVa verursachte RHD zeigt eine hohe Morbidität (bis zu 100 %) und Mortalität (40-100 %) bei erwachsenen europäischen Kaninchen. Junge Kaninchen im Alter von 6–8 Wochen sind weniger wahrscheinlich infiziert, und Kits, die jünger als 4 Wochen sind, werden nicht krank. Das erst kürzlich aufgetretene RHDV2 verursacht bei Kaninchen ab einem Alter von 15 Tagen Tod und Krankheit. Die Sterblichkeitsraten von RHDV2 sind mit 5-70% variabler. Anfänglich weniger virulent, hat die Pathogenität von RHDV2 zugenommen und ist jetzt ähnlich wie bei RHDV und RHDVa. Bei Kaninchen, die zuvor gegen RHDVa geimpft wurden, wurden Todesfälle durch RHDV2 bestätigt.
Pathophysiologie
Beide Virusstämme von RHDV replizieren sich in der Leber und verursachen Lebernekrose und Leberversagen, was wiederum zu disseminierter intravaskulärer Gerinnung , hepatischer Enzephalopathie und Nephrose führen kann . Es kann zu Blutungen kommen, da Gerinnungsfaktoren und Blutplättchen aufgebraucht sind.
Klinische Anzeichen
Hämorrhagische Kaninchenkrankheit verursacht Hepatitis. Die Inkubationszeit für RHDVa beträgt 1–2 Tage und für RHDV2 3–5 Tage. Mit RHDV2 infizierte Kaninchen zeigen eher subakute oder chronische Symptome als solche, die mit RHDVa infiziert sind. In Kaninchenhaltungen ist eine Epidemie mit hohen Sterblichkeitsraten bei adulten und subadulten Kaninchen typisch. Wird der Ausbruch durch RHDV2 verursacht, kommt es auch bei jungen Kaninchen zu Todesfällen.
RHD kann in der Häufigkeit des Auftretens klinischer Symptome variieren. In perakuten Fällen werden Kaninchen in der Regel tot aufgefunden, ohne dass vorhergehende Symptome auftreten. Es kann vorkommen, dass Kaninchen unmittelbar vor dem Tod normal grasen.
In akuten Fällen sind Kaninchen inaktiv und bewegen sich nur ungern. Sie können Fieber bis zu 42 ° C (107,6 ° F) entwickeln und haben eine erhöhte Herz- und Atemfrequenz. Blutiger Ausfluss aus Nase, Mund oder Vulva ist ebenso üblich wie Blut im Kot oder Urin. Seitenlage, Koma und Krämpfe können vor dem Tod beobachtet werden. Kaninchen mit der akuten Form sterben im Allgemeinen innerhalb von 12 bis 36 Stunden nach Beginn des Fiebers.
Eine subakute bis chronische RHD hat einen längeren klinischen Verlauf und wird häufiger bei RHDV2-Infektionen beobachtet. Klinische Symptome sind Lethargie, Anorexie, Gewichtsverlust und Gelbsucht . Magen-Darm-Dilatation, Herzrhythmusstörungen , Herzgeräusche und neurologische Anomalien können ebenfalls auftreten. Der Tod, wenn er eintritt, tritt normalerweise 1-2 Wochen nach dem Einsetzen der Symptome ein und ist auf Leberversagen zurückzuführen.
Nicht alle Kaninchen, die RHDVa oder RHDV2 ausgesetzt waren, erkranken offen. Ein kleiner Teil der infizierten Kaninchen beseitigt das Virus, ohne Anzeichen einer Krankheit zu entwickeln. Es treten auch asymptomatische Träger auf, die monatelang Viren ausscheiden und dadurch andere Tiere infizieren. Überlebende Kaninchen entwickeln eine starke Immunität gegen die spezifische Virusvariante, mit der sie infiziert wurden.
Diagnose
Eine mutmaßliche Diagnose von RHD kann oft basierend auf dem klinischen Erscheinungsbild, dem Infektionsmuster innerhalb einer Population und post mortem Läsionen gestellt werden. Die endgültige Diagnose erfordert den Nachweis des Virus. Da die meisten Caliciviren nicht in Zellkulturen gezüchtet werden können, werden häufig molekulare und serologische Methoden des Virusnachweises verwendet.
Ein vollständiges Blutbild von Kaninchen mit RHD zeigt oft niedrige Werte an weißen Blutkörperchen und Blutplättchen, und chemische Panels zeigen erhöhte Leberenzyme. Es können auch Hinweise auf Leberversagen vorliegen, einschließlich erhöhter Gallensäuren und Bilirubin sowie verringerter Glukose und Cholesterin. Typisch sind verlängerte Prothrombin- und aktivierte partielle Thromboplastinzeiten. Die Urinanalyse kann Bilirubinurie, Proteinurie und hohe GGT im Urin zeigen.
Die klassische Post-Mortem- Läsion bei Kaninchen mit RHD ist eine ausgedehnte Lebernekrose und Gelbsucht. Außerdem können multifokale Blutungen, Splenomegalie, Bronchopneumonie, Lungenblutung oder -ödem und Myokardnekrose beobachtet werden.
Eine Vielzahl von molekularen Tests kann verwendet werden, um RHD-Viren zu identifizieren. Reverse Transkriptions-Polymerase-Kettenreaktionstests sind eine häufig verwendete und genaue Testmethode für Viren. Andere verwendete Tests umfassen Enzyme-Linked Immunosorbent Assay , Elektronenmikroskopie , Immunfärbung , Western Blot und In-situ- Hybridisierung . Das Gewebe der Wahl für molekulare Tests ist frische oder gefrorene Leber, da sie in der Regel die meisten Viren enthält, aber wenn diese nicht verfügbar ist, können auch Milz und Serum verwendet werden. Die Identifizierung des RHDV-Stamms ist erforderlich, damit die Impfprotokolle entsprechend angepasst werden können.
Prävention und Kontrolle
Impfungen
Eine Reihe von Impfstoffen gegen RHD wird in Ländern verkauft, in denen die Krankheit endemisch ist. Alle bieten 12 Monate Schutz vor RHD-Viren. Da RHD-Viren normalerweise nicht in vitro gezüchtet werden können, wird die Herstellung dieser Impfstoffe beeinflusst. Inaktivierte RHD-Impfstoffe, einschließlich Eravac, Felavac und Cylap, werden aus der Leber gewonnen, was bedeutet, dass Laborkaninchen absichtlich mit RHD infiziert werden und ihre Leber und Milz entnommen werden, um Impfstoffe herzustellen. Jedes verwendete Kaninchen führt zur Produktion von Tausenden von Impfstoffdosen. Dies hat zu Kontroversen unter Kaninchenliebhabern geführt, die die Ethik in Frage stellen, dass einige Kaninchen sterben müssen, um andere zu schützen, aber kein Thema ist, wo Kaninchen hauptsächlich für Fleisch gezüchtet werden. Ein weiteres Verfahren zur Reproduktion des Virus ist die rekombinante Technologie, bei der antigene Teile der RHD-Viren in Viren inseriert werden, die in Kultur gezüchtet werden können. Dies ist die Methode, mit der Nobivac Myxo-RHD PLUS hergestellt wird.
Impfstoffe nur gegen den klassischen RHDVa-Stamm sind: Cylap RCD Vaccine, hergestellt von Zoetis, schützt Kaninchen vor zwei verschiedenen RHDVa-Stämmen (v351 und K5), die in Australien zur Wildkaninchenbekämpfung verwendet werden. CUNIPRAVAC RHD®, hergestellt von HIPRA, schützt vor den in Europa vorkommenden RHDVa-Stämmen. Nobivac Myxo-RHD, hergestellt von MSD Animal Health, ist ein lebender Myxoma-vektorisierter Impfstoff, der eine einjährige Immunität sowohl gegen RHDVa als auch gegen Myxomatose bietet .
Impfstoffe nur gegen den neueren RHDV2-Stamm sind: Eravac-Impfstoff, hergestellt von HIPRA, schützt Kaninchen ein Jahr lang vor RHDV2.
Zu den Impfstoffen, die sowohl gegen RHDVa- als auch gegen RHDV2-Stämme schützen, gehören: Filavac VHD K C+V, hergestellt von Filavie, schützt sowohl gegen klassisches RHDVa als auch gegen RHDV-2. Es ist in Einzeldosis- und Mehrfachdosis-Durchstechflaschen erhältlich. Ein Impfstoff von MSD Animal Health, der demnächst auf den Markt kommt, Nobivac Myxo-RHD PLUS, ist ein rekombinanter Vektor-Lebendimpfstoff, der sowohl gegen RHDVa und RHDV2 als auch gegen Myxomatose wirksam ist.
Länder, in denen RHD nicht als endemisch gilt, können die Einfuhr von RHDV-Impfstoffen einschränken. Die Einfuhr dieser Impfstoffe in die Vereinigten Staaten darf nur mit Zustimmung des US-Landwirtschaftsministeriums und des zuständigen staatlichen Tierarztes erfolgen.
Desinfektion
Caliciviren sind in der Umwelt stabil und schwer zu inaktivieren. Üblicherweise zur Haushaltsdesinfektion verwendete Produkte wie Clorox® und Lysol® Desinfektionstücher wirken gegen diese Viren nicht. Eine effektive Möglichkeit besteht darin, Oberflächen mit einer 10 %igen Bleichlösung abzuwischen und vor dem Abspülen 10 Minuten Kontaktzeit zu lassen. Andere Desinfektionsmittel , die sich als wirksam erwiesen haben, sind 10% Natriumhydroxid , 2% One-Stroke Environ®, Virkon® S, Clorox® Healthcare Bleach Keimtötende Wipes, Trifectant®, Rescue® und Wasserstoffperoxid-Reiniger. Oberflächenablagerungen müssen vor der Desinfektion immer mechanisch entfernt werden. Eine Liste mit Desinfektionsmitteln, die gegen Calicivirus (in diesem Fall Norovirus) wirksam sind, finden Sie auf der Website der Environmental Protection Agency. Studien haben gezeigt, dass viele Desinfektionsmittel auf Basis quartärer Ammoniumverbindungen Caliciviren nicht inaktivieren.
Quarantäne und andere Maßnahmen
Aufgrund der hochansteckenden Natur der Krankheit ist bei Ausbrüchen eine strenge Quarantäne erforderlich. Entvölkerung, Desinfektion, Impfung, Überwachung und Quarantäne sind der einzige Weg, um die Krankheit richtig und effektiv auszurotten. Verstorbene Kaninchen müssen sofort entfernt und sicher entsorgt werden. Überlebende Kaninchen sollten unter Quarantäne gestellt oder auf humane Weise eingeschläfert werden. Testkaninchen können verwendet werden, um das Virus in geimpften Betrieben zu überwachen.
Geografische Verteilung
RHD ist in erster Linie eine Krankheit, die europäische Kaninchen betrifft, die auf der Iberischen Halbinsel beheimatet sind und in weiten Teilen Westeuropas in freier Wildbahn vorkommen. Domestizierte Rassen werden weltweit für Fleisch und Fell gezüchtet und werden immer beliebter. Europäische Kaninchen wurden in Australien, Neuseeland, Chile, Argentinien und auf verschiedenen Inseln eingeführt und wurden verwildert und manchmal invasiv .
RHD wurde erstmals 1984 in der Volksrepublik China gemeldet. Seitdem hat sich RHD in über 40 Ländern in Afrika, Amerika, Asien, Europa und Ozeanien verbreitet und ist in den meisten Teilen der Welt endemisch.
Asien
Der erste gemeldete Ausbruch von RHD verursacht durch RHDVa trat im Jahr 1984 in der Provinz Jiangsu der China . Der Ausbruch ereignete sich bei einer Gruppe von Angorakaninchen , die aus Deutschland importiert worden waren . Als Ursache der Erkrankung wurde ein kleines, unbehülltes RNA-Virus festgestellt. Es wurde ein inaktivierter Impfstoff entwickelt, der sich bei der Vorbeugung von Krankheiten als wirksam erwiesen hat. In weniger als einem Jahr breitete sich die Krankheit über eine Fläche von 50.000 km 2 in China aus und tötete 140 Millionen Hauskaninchen.
Südkorea war das nächste Land, das nach der Einfuhr von Kaninchenfell aus China RHD-Ausbrüche meldete. RHD hat sich seitdem in vielen Ländern Asiens, einschließlich Indien und des Nahen Ostens, ausgebreitet und ist dort endemisch geworden.
Europa
Von China aus verbreitete sich RHDVa westwärts nach Europa. Der erste Bericht über RHD in Europa kam 1986 aus Italien. Von dort breitete es sich in weiten Teilen Europas aus. Spaniens erster gemeldeter Fall war 1988, Frankreich, Belgien und Skandinavien folgten 1990. Spanien erlebte ein großes Absterben von Wildkaninchen, was wiederum zu einem Rückgang der Raubtiere führte, die normalerweise Kaninchen aßen, einschließlich des Iberischen Luchses und der Spanier kaiserlicher Adler .
RHD verursacht durch RHDVa wurde erstmals 1992 im Vereinigten Königreich gemeldet. Diese anfängliche Epidemie wurde Ende der 1990er Jahre durch eine Kombination aus Impfung, strenger Biosicherheit und guter Tierhaltung unter Kontrolle gebracht. Der neuere Virusstamm RHDV2 wurde erstmals 2014 in England und Wales nachgewiesen und breitete sich bald nach Schottland und Irland aus.
Im Jahr 2010 tauchte in Frankreich eine neue Virusvariante namens Rabbit Hemorrhagic Disease Virus 2 (RHDV2) auf. RHDV2 hat sich seitdem von Frankreich auf das restliche Europa, Großbritannien, Australien und Neuseeland ausgebreitet. In den Vereinigten Staaten und auf Vancouver Island, Kanada, traten 2019 Ausbrüche auf.
RHD wurde zum ersten Mal 2016 in Finnland nachgewiesen. Der Ausbruch ereignete sich bei wilden europäischen Kaninchen, und Gentests identifizierten den Virusstamm als RHDV2. Es wurden Fälle von Virusübertragung auf domestizierte Hauskaninchen bestätigt und die Impfung von Kaninchen empfohlen.
Ozeanien
Im Jahr 1991 wurde ein Stamm des RHDVa-Virus, das tschechische CAPM 351RHDV, unter strengen Quarantänebedingungen nach Australien importiert, um die Sicherheit und Nützlichkeit des Virus zu untersuchen, wenn es als biologisches Bekämpfungsmittel gegen das Problem von Kaninchenschädlingen in Australien und Neuseeland verwendet würde . Testen des Virus wurde auf unternommen Wardang Insel in Spencer Gulf vor der Küste der Yorke Peninsula , South Australia . 1995 entkam das Virus der Quarantäne und tötete anschließend innerhalb von 8 Wochen nach seiner Freisetzung 10 Millionen Kaninchen. Im März 2017 wurde nach fast einem Jahrzehnt der Forschung eine neue koreanische Sorte namens RHDV K5 auf bewusste Weise erfolgreich auf den Markt gebracht. Dieser Stamm wurde zum Teil ausgewählt, weil er in kühlen, feuchten Regionen besser funktioniert, wo das vorherige Calicivirus weniger wirksam war.
Im Juli 1997 beschloss das neuseeländische Gesundheitsministerium nach Prüfung von über 800 öffentlichen Anträgen, die Einfuhr von RHDVa nach Neuseeland zur Kontrolle der Kaninchenpopulationen nicht zu gestatten. Ende August wurde jedoch bestätigt, dass RHDVa absichtlich und illegal in die Gegend von Cromwell auf der Südinsel eingeführt wurde . Neuseeländische Beamte versuchten erfolglos, die Ausbreitung der Krankheit einzudämmen. Es wurde jedoch absichtlich verbreitet, und mehrere Landwirte (insbesondere im Bereich des Mackenzie-Beckens ) gaben zu, an der Krankheit gestorbene Kaninchen zur weiteren Verbreitung in Küchenmixern verarbeitet zu haben. Wäre die Krankheit zu einem besseren Zeitpunkt eingeführt worden, wäre die Kontrolle der Population effektiver gewesen, aber sie wurde freigegeben, nachdem die Zucht für die Saison begonnen hatte, und Kaninchen, die zum Zeitpunkt der Einführung weniger als 2 Wochen alt waren, waren gegen die Krankheit resistent. Diese jungen Kaninchen waren daher in der Lage zu überleben und die Kaninchenzahlen wieder zu erhöhen. Zehn Jahre später beginnen die Kaninchenpopulationen (insbesondere im Mackenzie-Becken) wieder annähernd das Ausmaß vor der Pest zu erreichen, obwohl sie noch nicht auf das Niveau vor RHD zurückgekehrt sind. Die Resistenz gegenüber RHD bei Neuseeland-Kaninchen hat zur weit verbreiteten Verwendung von Verbindung 1080 (Natriumfluoracetat) geführt . Die Regierung und das Naturschutzministerium müssen ihren Einsatz von 1080 erhöhen, um das Reservatland vor Kaninchen zu schützen und die in den letzten Jahren durch den Einsatz von RHD erzielten Gewinne zu erhalten.
Nord-und Südamerika
Vereinzelte Ausbrüche von RHDVa bei Hauskaninchen sind in den Vereinigten Staaten aufgetreten, der erste in Iowa im Jahr 2000. 2001 kam es in Utah, Illinois und New York zu Ausbrüchen. Neuere Ausbrüche von RHDVa sind 2005 in Indiana und 2018 in Pennsylvania aufgetreten. Jeder dieser Ausbrüche wurde eingedämmt und war das Ergebnis separater, aber unbestimmbarer Einführungen von RHDVa. RHDVa wirkt sich nicht auf die einheimischen Baumwollschwanz- und Jackrabbits in den Vereinigten Staaten aus, sodass das Virus nicht endemisch wurde.
Der erste Bericht über das RHDV2-Virus in Nordamerika wurde 2016 auf einer Farm in Québec gemeldet. Im Jahr 2018 trat ein größerer Ausbruch bei verwilderten europäischen Kaninchen auf Delta und Vancouver Island, British Columbia, auf. Die Krankheit wurde später in diesem Jahr bei einem Hauskaninchen in Ohio bestätigt. Im Juli 2019 wurde der erste Fall von RHDV2 in Washington bei einem Hauskaninchen von Orcas Island bestätigt . RHDV2 wurde bei Hauskaninchen in Washington und New York berichtet.
Im Jahr 2020 wurden in Arizona, New Mexico, Colorado, Texas, Nevada, Kalifornien und Utah Ausbrüche der Krankheit bei Hauskaninchen sowie bei Baumwollschwanzkaninchen und Hasen gemeldet. Zu den betroffenen Wildtieren gehören Berg- Baumwollschwanzkaninchen ( Sylvilagus nutalli ), Wüsten- Baumwollschwanzkaninchen ( S. audubonii ), Antilopenhasen ( L. alleni ) und Schwarzschwanzhasen ( L. californicus ). Das im Südwesten der Vereinigten Staaten zirkulierende Virus unterscheidet sich von dem RHDV2, das aus New York, Washington, Ohio und British Columbia, Kanada, isoliert wurde. Die Quellen dieser Ausbrüche sind unbekannt.
Mexiko erlebte von 1989 bis 1991 einen Ausbruch von RHDVa bei Hauskaninchen, vermutlich nach der Einfuhr von Kaninchenfleisch aus der Volksrepublik China. Strenge Quarantäne- und Entvölkerungsmaßnahmen konnten das Virus ausrotten, und das Land wurde 1993 offiziell als RHD-frei erklärt. Ein zweiter Ausbruch von RHD bei Hauskaninchen begann im April 2020 im Bundesstaat Chihuahua und hat sich seitdem auf Sonora ausgebreitet. Baja California, Baja California Sur, Coahuila und Durango.
Seit 1993 ist RHDVa in Kuba endemisch. In den Jahren 1993, 1997, 2000-2001 und 2004-2005 wurden vier Tierseuchen bei domestizierten Kaninchen gemeldet. Infolgedessen sind jedes Mal Tausende von Kaninchen gestorben oder wurden geschlachtet. Es wird angenommen, dass das Virus auch in Bolivien gedeiht .
Siehe auch
Verweise
- Auf Vancouver Island wurde ein neuer Ausbruch in Kanada gemeldet: „BC warnt Besitzer von Haustierkaninchen, da sich das Virus auf das untere Festland ausbreitet | CBC News“ .