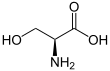
Serin - Serine
|
|||
|
|
|||
| Namen | |||
|---|---|---|---|
|
IUPAC-Name
Serin
|
|||
| Andere Namen
2-Amino-3-hydroxypropansäure
|
|||
| Bezeichner | |||
|
3D-Modell ( JSmol )
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| Arzneimittelbank | |||
| ECHA-Infokarte |
100.000.250 |
||
| EG-Nummer | |||
| KEGG | |||
|
PubChem- CID
|
|||
| UNII | |||
|
CompTox-Dashboard ( EPA )
|
|||
|
|||
|
|||
| Eigenschaften | |||
| C 3 H 7 N O 3 | |||
| Molmasse | 105,093 g·mol -1 | ||
| Aussehen | weiße Kristalle oder Pulver | ||
| Dichte | 1,603 g/cm 3 (22 °C) | ||
| Schmelzpunkt | 246 °C (475 °F; 519 K) zersetzt sich | ||
| löslich | |||
| Säure (p K a ) | 2,21 (Carboxyl), 9,15 (Amino) | ||
| Ergänzende Datenseite | |||
|
Brechungsindex ( n ), Dielektrizitätskonstante (ε r ) usw. |
|||
|
Thermodynamische
Daten |
Phasenverhalten fest-flüssig-gas |
||
| UV , IR , NMR , MS | |||
|
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Infobox-Referenzen | |||
Serin (Symbol Ser oder S ) ist eine α- Aminosäure , die bei der Biosynthese von Proteinen verwendet wird. Es enthält eine α- Aminogruppe (die im protonierten − NH+
3unter biologischen Bedingungen bilden), eine Carboxylgruppe (die sich im deprotonierten − COO−
unter biologischen Bedingungen bilden) und eine Seitenkette bestehend aus einer Hydroxymethylgruppe , die sie als polare Aminosäure klassifiziert . Es kann im menschlichen Körper unter normalen physiologischen Umständen synthetisiert werden, was es zu einer nicht-essentiellen Aminosäure macht. Es wird von den Codons UCU, UCC, UCA, UCG, AGU und AGC kodiert .
Auftreten
Diese Verbindung ist eine der natürlich vorkommenden proteinogenen Aminosäuren . Nur der L - Stereoisomer erscheint natürlich in Proteinen. Es ist für die menschliche Ernährung nicht essentiell , da es im Körper aus anderen Metaboliten , einschließlich Glycin, synthetisiert wird . Serin wurde erstmals 1865 von Emil Cramer aus Seidenprotein , einer besonders reichhaltigen Quelle, gewonnen. Sein Name leitet sich aus dem Lateinischen für Seide, Sericum, ab . Die Struktur von Serin wurde 1902 begründet. Nahrungsquellen mit hohem L- Serin-Gehalt unter ihren Proteinen sind Eier, Edamame, Lamm, Leber, Schweinefleisch, Lachs, Sardinen, Algen, Tofu.
Biosynthese
Die Biosynthese von Serin beginnt mit der Oxidation von 3-Phosphoglycerat (ein Zwischenprodukt der Glykolyse ) zu 3-Phosphohydroxypyruvat und NADH durch Phosphoglycerat-Dehydrogenase ( EC 1.1.1.95 ). Die reduktive Aminierung (Transaminierung) dieses Ketons durch Phosphoserin-Transaminase ( EC 2.6.1.52 ) ergibt 3-Phosphoserin ( O -Phosphoserin ), das durch Phosphoserin-Phosphatase ( EC 3.1.3.3 ) zu Serin hydrolysiert wird .
In Bakterien wie E. coli werden diese Enzyme von den Genen serA (EC 1.1.1.95), serC (EC 2.6.1.52) und serB (EC 3.1.3.3) kodiert.
Glycin-Biosynthese : Serin-Hydroxymethyltransferase (SHMT = Serin-Transhydroxymethylase) katalysiert auch die reversible Umwandlung von L- Serin zu Glycin (Retro-Aldol-Spaltung) und 5,6,7,8-Tetrahydrofolat zu 5,10-Methylentetrahydrofolat (mTHF) (Hydrolyse) . SHMT ist ein von Pyridoxalphosphat (PLP) abhängiges Enzym. Glycin kann auch aus CO 2 , NH 4 + und mTHF in einer durch Glycinsynthase katalysierten Reaktion gebildet werden .
Synthese und industrielle Produktion
Industriell wird L- Serin aus Glycin und Methanol hergestellt, katalysiert durch Hydroxymethyltransferase .
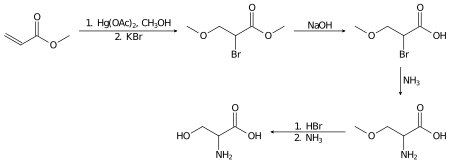
Racemisches Serin kann im Labor aus Methylacrylat in mehreren Schritten hergestellt werden:
Biologische Funktion
Stoffwechsel

Serin ist im Stoffwechsel wichtig , da es an der Biosynthese von Purinen und Pyrimidinen beteiligt ist . Es ist der Vorläufer mehrerer Aminosäuren, einschließlich Glycin und Cystein , sowie Tryptophan in Bakterien. Es ist auch der Vorläufer zahlreicher anderer Metaboliten, einschließlich Sphingolipide und Folat , das der Hauptspender von Ein-Kohlenstoff-Fragmenten in der Biosynthese ist.
Strukturelle Rolle
Serin spielt eine wichtige Rolle bei der katalytischen Funktion vieler Enzyme . Es wurde gezeigt, dass es in den aktiven Zentren von Chymotrypsin , Trypsin und vielen anderen Enzymen vorkommt. Die sogenannten Nervengase und viele in Insektiziden verwendete Substanzen wirken durch Kombination mit einem Serinrest im aktiven Zentrum der Acetylcholinesterase und hemmen das Enzym vollständig.
Serinseitenketten sind oft wasserstoffgebunden; die am häufigsten gebildeten kleinen Motive sind ST-Windungen , ST-Motive (oft am Anfang von Alpha-Helices) und ST-Stapel (normalerweise in der Mitte von Alpha-Helices).
Als Bestandteil (Rest) von Proteinen kann seine Seitenkette eine O- verknüpfte Glykosylierung eingehen , die funktionell mit Diabetes in Zusammenhang stehen kann .
Es ist einer von drei Aminosäureresten, die bei der Zellsignalübertragung in Eukaryoten üblicherweise von Kinasen phosphoryliert werden . Phosphorylierte Serinreste werden oft als Phosphoserin bezeichnet .
Serinproteasen sind eine häufige Art von Proteasen.
Signalisierung
D- Serin, das in Neuronen durch Serin-Racemase aus L- Serin (seinem Enantiomer ) synthetisiert wird , dient als Neuromodulator, indem es NMDA-Rezeptoren koaktiviert , wodurch sie sich öffnen können, wenn sie dann auch Glutamat binden . D- Serin ist ein starker Agonist an der Glycinstelle (NR1) des Glutamatrezeptors vom NMDA-Typ (NMDAR). Damit sich der Rezeptor öffnet, müssen Glutamat und entweder Glycin oder D- Serin daran binden; außerdem darf kein Porenblocker gebunden werden (zB Mg 2+ oder Zn 2+ ). Tatsächlich ist D- Serin ein stärkerer Agonist an der Glycin-Stelle des NMDAR als Glycin selbst.
Bis vor relativ kurzer Zeit wurde angenommen, dass D- Serin nur in Bakterien existiert; es war die zweite D- Aminosäure, von der entdeckt wurde, dass sie beim Menschen natürlich vorkommt und als Signalmolekül im Gehirn vorkommt, kurz nach der Entdeckung von D- Aspartat . Wären D- Aminosäuren beim Menschen früher entdeckt worden, könnte die Glycin-Stelle am NMDA-Rezeptor stattdessen als D- Serin-Stelle bezeichnet werden. Abgesehen vom zentralen Nervensystem spielt D- Serin eine Signalfunktion in peripheren Geweben und Organen wie Knorpel, Niere und Schwellkörper.
Geschmacksempfinden
L- Serin ist süß mit leichtem Umami und saurem Geschmack bei hoher Konzentration.
Pure D- Serin ist ein cremefarbenes kristallines Pulver mit einem sehr schwachen muffigen Aroma. D- Serin ist süß mit einem zusätzlichen leicht säuerlichen Geschmack bei mittleren und hohen Konzentrationen.
Klinische Bedeutung
Serinmangelerkrankungen sind seltene Defekte in der Biosynthese der Aminosäure L- Serin. Derzeit sind drei Erkrankungen bekannt:
- 3-Phosphoglycerat-Dehydrogenase-Mangel
- 3-Phosphoserinphosphatase-Mangel
- Phosphoserin-Aminotransferase-Mangel
Diese Enzymdefekte führen zu schweren neurologischen Symptomen wie angeborener Mikrozephalie und schwerer psychomotorischer Retardierung und zusätzlich bei Patienten mit 3-Phosphoglycerat-Dehydrogenase-Mangel zu hartnäckigen Anfällen. Diese Symptome sprechen unterschiedlich stark auf die Behandlung mit L- Serin an, manchmal in Kombination mit Glycin. Das Ansprechen auf die Behandlung ist variabel und das langfristige und funktionelle Ergebnis ist unbekannt. Um eine Grundlage für ein besseres Verständnis der Epidemiologie, der Genotyp/Phänotyp-Korrelation und des Outcomes dieser Erkrankungen und ihres Einflusses auf die Lebensqualität der Patienten zu schaffen, sowie zur Evaluierung diagnostischer und therapeutischer Strategien, wurde von der nichtkommerziellen International Working ein Patientenregister eingerichtet Gruppe für Neurotransmitter-bezogene Störungen (iNTD).
Forschung für den therapeutischen Einsatz
Die Einstufung von L- Serin als nicht-essentielle Aminosäure gilt mittlerweile als bedingt, da Wirbeltiere wie der Mensch nicht immer über die gesamte Lebensspanne optimale Mengen synthetisieren können. L- Serin befindet sich in einer von der FDA zugelassenen klinischen Humanstudie als mögliche Behandlung für Amyotrophe Lateralsklerose, ALS (ClinicalTrials.gov-Kennung: NCT01835782). Eine Metaanalyse aus dem Jahr 2011 ergab, dass das begleitende Sarkosin eine mittlere Effektstärke für negative und Gesamtsymptome hat. Es gibt auch Hinweise darauf, dass L- Serin eine therapeutische Rolle bei Diabetes einnehmen könnte.
D- Serin wird bei Nagetieren als potenzielle Behandlung von Schizophrenie untersucht. D- Serin wurde aufgrund seiner relativ hohen Konzentration in der Gehirn-Rückenmarks-Flüssigkeit wahrscheinlicher Alzheimer- Patienten auch als potenzieller Biomarker für die frühe Diagnose der Alzheimer-Krankheit (AD) beschrieben .
Siehe auch
- Isoserin
- Homoserin (Isothreonin)
- Serinoctamer-Cluster