Sulfenylchlorid - Sulfenyl chloride
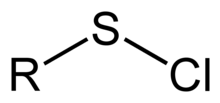
Ein Sulfenylchlorid ist eine funktionelle Gruppe mit der Konnektivität R-S-Cl, wobei R Alkyl oder Aryl ist . Sulfenylchloride sind reaktive Verbindungen, die sich als RS + -Quellen verhalten . Sie werden zur Bildung von RS-N- und RS-O-Bindungen verwendet. Nach der IUPAC- Nomenklatur werden sie als Alkylthiohypochlorite bezeichnet, dh als Ester der Thiohypochlorsäure.
Vorbereitung

Sulfenylchloride werden typischerweise durch Chlorierung von Disulfiden hergestellt :
- R 2 S 2 + Cl 2 → 2 RSCl
Diese Reaktion wird in Anerkennung von Theodor Zincke manchmal als Zincke-Disulfidreaktion bezeichnet . Typischerweise werden Sulfenylhalogenide durch elektronegative Substituenten stabilisiert. Dieser Trend wird durch die Stabilität von CCl 3 SCl veranschaulicht, die durch Chlorierung von Schwefelkohlenstoff erhalten wird .
Reaktionen
Perchlormethylmercaptan (CCl 3 SCl) reagiert mit NH-haltigen Verbindungen in Gegenwart einer Base zu den Sulfenamiden :
- CCl 3 SCl + R 2 NH → CCl 3 SNR 2 + HCl
Diese Methode wird bei der Herstellung der Fungizide Captan und Folpet angewendet .
Sulfenylchloride addieren sich über Alkene:
- CH 2 = CH 2 + RSCl → RSCH 2 CH 2 Cl
Sie werden zu den Trichloriden chloriert :
- CH 3 SCl + Cl 2 → [CH 3 SCl 2 ] Cl
Sulfenylchloride reagieren mit Alkoholen zu Sulfenylestern mit der Formel RSOR ':
- C 6 H 5 SCl + ROH → C 6 H 5 SOR + HCl
Weg zu Sulfinylhalogeniden
Sulfenylchloride können in Sulfinylchloride (RS (O) Cl) umgewandelt werden. In einem Ansatz wird das Sulfinylchlorid in zwei Schritten erzeugt, beginnend mit der Reaktion eines Thiols mit Sulfurylchlorid , SO
2Cl
2 In einigen Fällen entsteht stattdessen das Sulfenylchlorid, wie dies bei 2,2,2-Trifluor-1,1-diphenylethanthiol der Fall ist . Eine Trifluoroperessigsäureoxidation liefert dann einen allgemeinen Ansatz zur Bildung von Sulfinylchloriden aus Sulfenylchloriden:
Verwandte Verbindungen
Es sind auch Sulfenylbromide bekannt. Einfache Sulfenyliodide sind unbekannt, da sie in Bezug auf Disulfid und Jod instabil sind :
- 2 RSI → (RS) 2 + I 2
Sulfenyliodide können als stabile Verbindungen isoliert werden, wenn sie als Teil eines hohlraumförmigen Gerüsts alkylsterische Schutzgruppen tragen, was die Technik der kinetischen Stabilisierung einer reaktiven Funktionalität wie im Fall von Sulfensäuren veranschaulicht .
Eine verwandte Klasse von Verbindungen sind die Alkylschwefeltrichloride, wie beispielsweise Methylschwefeltrichlorid, CH 3 SCl 3 .
Die entsprechenden Selenenylhalogenide, z. B. C 6 H 5 SeCl, sind im Labor häufiger anzutreffen. Sulfenylchloride werden zur Herstellung von Mitteln zur Vulkanisation von Kautschuk verwendet.
Verweise
- ^ Drabowicz, J.; Kiełbasiński, P.; Łyżwa, P.; Zając, A.; Mikołajczyk, M. (2008). Kambe, N. (Hrsg.). Alkansulfenylhalogenide . Wissenschaft der Synthese. 39 . S. 544–550. ISBN 9781588905307.
- ^ Hubacher, Max H. (1943). " o- Nitrophenylschwefelchlorid" . Organische Synthesen .;; Sammelband , 2 , p. 455
- ^ a b Douglass, Irwin B.; Norton, Richard V. (1973). "Methansulfinylchlorid" . Organische Synthesen .;; Collective Volume , 5 , S. 709–715
- ^ Zincke, Th. (1911). "Über eine neue Reihe aromatischer Schwefelverbindungen" . Chemische Berichte . 44 (1): 769–771. doi : 10.1002 / cber.191104401109 .
- ^ Zincke, Th. ;; Farr, Fr. (1912). "Über o- Nitrophenylschwefelchlorid und Umwandlungsprodukte" . Justalen Liebigs Annalen der Chemie . 391 (1): 57–88. doi : 10.1002 / jlac.19123910106 .
- ^ Brintzinger, H.; Langheck, M., "Synthesen mit Alkylschwefelchloriden (X. Mitteil. Über organisches Schwefelchlorid)", Chemische Berichte 1954, Band 87, 325-330. doi : 10.1002 / cber.19540870306
- ^ Petrovic, Goran; Saicic, Radomir N.; Cekovic, Zivorad (2005). "Phenylsulfenylierung von nichtaktiviertem Kohlenstoffatom durch Photolyse von Alkylbenzolsulfenat: Herstellung von 2-Phenylthio-5-heptanol" . Organische Synthesen . 81 : 244. doi : 10.15227 / orgsyn.081.0244 .
- ^ Seite, PCB; Wilkes, RD; Reynolds, D. (1995). "Alkylchalkogenide: funktionelle Gruppen auf Schwefelbasis" . In Ley, Steven V. (Hrsg.). Synthese: Kohlenstoff mit einem durch eine Einfachbindung gebundenen Heteroatom . Umfassende organische funktionelle Gruppentransformationen. Elsevier . S. 113–276 . ISBN 9780080423234.
- ^ Reno, Daniel S.; Pariza, Richard J. (1998). "Phenylvinylsulfid" . Organische Synthesen .;; Sammelband , 9 , p. 662
- ^ Sase, S.; Aoki, Y.; Abe, N.; Goto, K. (2009). "Stabiles Sulfenyliodid mit einer primären sterischen Alkylschutzgruppe mit einem hohlraumförmigen Gerüst". Chemie-Briefe . 38 (12): 1188–1189. doi : 10.1246 / cl.2009.1188 .
- ^ Braverman, S.; Cherkinsky, M.; Levinger, S. (2008). "Alkylschwefeltrihalogenide". Sci. Synth . 39 : 187–188. ISBN 9781588905307.

