Diederwinkel - Dihedral angle
| Arten von Winkeln |
|---|
| 2D-Winkel |
| Außen |
| 2D-Winkelpaare |
|
Angrenzende |
| 3D-Winkel |
| Dieder |
Ein Diederwinkel ist der Winkel zwischen zwei sich schneidenden Ebenen oder Halbebenen . In der Chemie ist es der Winkel im Uhrzeigersinn zwischen Halbebenen durch zwei Sätze von drei Atomen, die zwei Atome gemeinsam haben. In der Volumengeometrie ist es definiert als die Vereinigung einer Linie und zweier Halbebenen, die diese Linie als gemeinsame Kante haben . In höheren Dimensionen repräsentiert ein Diederwinkel den Winkel zwischen zwei Hyperebenen . Die Ebenen einer Flugmaschine werden als positive Diederwinkel bezeichnet, wenn sowohl die Steuerbord- als auch die Backbord-Hauptebene nach oben zur Querachse geneigt sind. Wenn sie nach unten geneigt sind, spricht man von einem negativen Diederwinkel.
Mathematischer Hintergrund
Wenn die beiden sich schneidenden Ebenen in kartesischen Koordinaten durch die beiden Gleichungen beschrieben werden
der Diederwinkel zwischen ihnen ist gegeben durch:
und erfüllt
Alternativ, wenn n A und n B ist Normalenvektor zu den Ebenen, hat man
wobei n A · n B das Skalarprodukt der Vektoren ist und | n A | | n B | ist das Produkt ihrer Längen.
Der Absolutwert ist in den obigen Formeln erforderlich, da die Ebenen nicht geändert werden, wenn alle Koeffizientenvorzeichen in einer Gleichung geändert oder ein Normalenvektor durch seinen entgegengesetzten ersetzt wird.
Die absoluten Werte können und sollten jedoch vermieden werden, wenn der Diederwinkel von zwei Halbebenen betrachtet wird, deren Grenzen dieselbe Linie sind. In diesem Fall können die Halbebenen durch einen Punkt P ihres Schnittpunkts beschrieben werden, und drei Vektoren b 0 , b 1 und b 2 so dass P + b 0 , P + b 1 bzw. P + b 2 zum Schnittpunkt gehören Linie, die erste Halbebene und die zweite Halbebene. Der Diederwinkel dieser beiden Halbebenen ist definiert durch
- ,
und erfüllt In diesem Fall führt das Vertauschen der beiden Halbebenen zum gleichen Ergebnis, ebenso wie das Ersetzen durch In der Chemie (siehe unten) definieren wir einen Diederwinkel, so dass das Ersetzen durch das Vorzeichen des Winkels ändert, der zwischen − . liegen kann π und π .
In der Polymerphysik
In einigen wissenschaftlichen Gebieten wie der Polymerphysik kann man eine Kette von Punkten und Verbindungen zwischen aufeinanderfolgenden Punkten betrachten. Wenn die Punkte fortlaufend nummeriert sind und sich an den Positionen r 1 , r 2 , r 3 usw. befinden, dann sind Bindungsvektoren definiert durch u 1 = r 2 − r 1 , u 2 = r 3 − r 2 und u i = r i+1 − r i , allgemeiner. Dies ist bei kinematischen Ketten oder Aminosäuren in einer Proteinstruktur der Fall . In diesen Fällen interessiert man sich oft für die Halbebenen, die durch drei aufeinanderfolgende Punkte definiert werden, und den Diederwinkel zwischen zwei aufeinanderfolgenden solchen Halbebenen. Wenn u 1 , u 2 und u 3 drei aufeinanderfolgende Bindungsvektoren sind, ist der Schnittpunkt der Halbebenen orientiert, was es erlaubt, einen Diederwinkel zu definieren, der zum Intervall (− π , π ] gehört . Dieser Diederwinkel ist definiert durch
oder mit der Funktion atan2 ,
Dieser Diederwinkel hängt nicht von der Orientierung der Kette ab (Reihenfolge, in der die Punkte betrachtet werden) — die Umkehrung dieser Reihenfolge besteht darin, jeden Vektor durch seinen entgegengesetzten Vektor zu ersetzen und die Indizes 1 und 3 auszutauschen. Beide Operationen ändern den Kosinus nicht , aber ändern Sie das Vorzeichen des Sinus. Somit ändern sie zusammen den Winkel nicht.
Eine einfachere Formel für denselben Diederwinkel ist die folgende (der Beweis wird unten gegeben)
oder gleichwertig,
Dies kann aus früheren Formeln abgeleitet werden, indem die Vektor-Vierfachprodukt- Formel verwendet wird und die Tatsache, dass ein Skalartripelprodukt Null ist, wenn es zweimal denselben Vektor enthält:
Bei der Definition des Kreuzprodukts bedeutet dies, dass der Winkel im Uhrzeigersinn des vierten Atoms im Vergleich zum ersten Atom ist, während man die Achse vom zweiten zum dritten Atom nach unten schaut. Spezialfälle (man kann sagen, die üblichen Fälle) sind , und , die als trans- , gauche + und gauche − -Konformationen bezeichnet werden.
In der Stereochemie

|
|
|
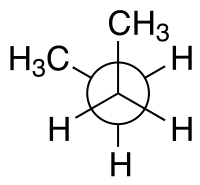
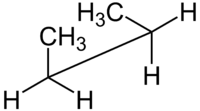
| Konfigurationsnamen nach Diederwinkel |
syn n- Butan in der gauche − Konformation (−60°) Newman-Projektion |
syn n- Butan- Sägebock-Projektion |

In der Stereochemie wird ein Torsionswinkel als ein besonderes Beispiel für einen Diederwinkel definiert, der die geometrische Beziehung zweier Teile eines Moleküls beschreibt, die durch eine chemische Bindung verbunden sind . Jeder Satz von drei nicht-kollinearen Atomen eines Moleküls definiert eine Halbebene. Wie oben erläutert, ist der Winkel zwischen ihnen ein Diederwinkel, wenn sich zwei solche Halbebenen schneiden (dh ein Satz von vier aufeinanderfolgend gebundenen Atomen). Diederwinkel werden verwendet, um die molekulare Konformation anzugeben . Stereochemische Anordnungen, die Winkeln zwischen 0° und ±90° entsprechen, werden syn (s) genannt, solche, die Winkeln zwischen ±90° und 180° entsprechen, anti (a). Ebenso werden Anordnungen, die Winkeln zwischen 30° und 150° oder zwischen –30° und –150° entsprechen, klinal (c) und solche zwischen 0° und ±30° oder ±150° und 180° als periplanar (p) bezeichnet.
Die beiden Arten von Begriffen können kombiniert werden, um vier Winkelbereiche zu definieren; 0° bis ±30° synperiplanar (sp); 30° bis 90° und –30° bis –90° synklinal (sc); 90° bis 150° und –90° bis –150° antiklinal (ac); ±150° bis 180° antiperiplanar (ap). Die synperiplanare Konformation ist auch als syn- oder cis- Konformation bekannt; antiperiplanar als anti oder trans ; und synklinal als gauche oder schief .
Zum Beispiel mit n - Butan zwei Ebenen können in Bezug auf die beiden mittleren Kohlenstoffatomen und entweder der Methylkohlenstoffatomen angegeben werden. Die oben gezeigte syn- Konformation mit einem Diederwinkel von 60° ist weniger stabil als die anti- Konformation mit einem Diederwinkel von 180°.
Für makromolekulare Anwendungen werden die Symbole T, C, G + , G – , A + und A – empfohlen (ap, sp, +sc, –sc, +ac bzw. –ac).
Proteine

Ein Ramachandran-Diagramm (auch bekannt als Ramachandran-Diagramm oder [ φ , ψ ] -Diagramm ), das ursprünglich 1963 von GN Ramachandran , C. Ramakrishnan und V. Sasisekharan entwickelt wurde, ist eine Möglichkeit, energetisch zulässige Regionen für Rückgrat-Diederwinkel ψ . zu visualisieren gegen φ der Aminosäurereste in der Proteinstruktur . In einer Proteinkette sind drei Diederwinkel definiert:
- ω (omega) ist der Winkel in der Kette C α − C' − N − C α ,
- φ (phi) ist der Winkel in der Kette C' − N − C α − C'
- ψ (psi) ist der Winkel in der Kette N − C α − C' − N ( bei Ramachandran φ′ genannt )
Die Abbildung rechts veranschaulicht die Position jedes dieser Winkel (aber sie zeigt nicht richtig, wie sie definiert sind).
Die Planarität der Peptidbindung beschränkt ω normalerweise auf 180° (der typische trans- Fall) oder 0° (der seltene cis- Fall). Der Abstand zwischen den C α -Atomen in den trans- und cis- Isomeren beträgt ca. 3.8 bzw. 2.9 . Die überwiegende Mehrheit der Peptidbindungen in Proteinen ist trans , obwohl die Peptidbindung an den Stickstoff von Prolin im Vergleich zu anderen Aminosäurepaaren eine erhöhte Prävalenz von cis aufweist.
Die Seitenketten-Diederwinkel werden mit χ n (chin- n ) bezeichnet. Sie neigen dazu, sich in der Nähe von 180°, 60° und –60° zu gruppieren, die als trans- , gauche + und gauche – Konformationen bezeichnet werden. Die Stabilität bestimmter Seitenketten-Diederwinkel wird durch die Werte φ und ψ beeinflusst . Zum Beispiel gibt es einen direkten sterische Wechselwirkungen zwischen den C γ der Seitenkette in der gauche + Rotamer und dem Backbone - Stickstoff des nächsten Rests , wenn ψ ist nahe -60 °. Dies ist aus statistischen Verteilungen in Backbone-abhängigen Rotamer-Bibliotheken ersichtlich .
Konvertieren von Diederwinkeln in kartesische Koordinaten in Ketten
Es ist üblich, Polymerrückgrate, insbesondere Proteine, in internen Koordinaten darzustellen ; das heißt, eine Liste aufeinanderfolgender Diederwinkel und Bindungslängen. Einige Arten der Computerchemie verwenden jedoch stattdessen kartesische Koordinaten . Bei der rechnerischen Strukturoptimierung müssen einige Programme während ihrer Iterationen zwischen diesen Darstellungen hin und her springen. Diese Aufgabe kann die Rechenzeit dominieren. Bei Prozessen mit vielen Iterationen oder mit langen Ketten kann es auch zu kumulativer numerischer Ungenauigkeit führen. Obwohl alle Umrechnungsalgorithmen mathematisch identische Ergebnisse liefern, unterscheiden sie sich in Geschwindigkeit und numerischer Genauigkeit.
Geometrie
Jedes Polyeder hat an jeder Kante einen Diederwinkel, der die Beziehung der beiden Flächen beschreibt, die diese Kante teilen. Dieser Diederwinkel, auch die angerufene Flächenwinkel , wird als der gemessene Innenwinkel in Bezug auf den Polyeder. Ein Winkel von 0° bedeutet, dass die Flächennormalenvektoren antiparallel sind und sich die Flächen überlappen, was bedeutet, dass es Teil eines entarteten Polyeders ist. Ein Winkel von 180° bedeutet, dass die Flächen wie bei einem Fliesenbelag parallel sind . An konkaven Abschnitten eines Polyeders existiert ein Winkel von mehr als 180°.
Jeder Diederwinkel in einem kantentransitiven Polyeder hat den gleichen Wert. Dazu gehören die 5 platonischen Körper , die 13 katalanischen Körper , die 4 Kepler-Poinsot-Polyeder , die beiden quasiregulären Körper und zwei quasireguläre duale Körper.
Gegeben 3 Seiten eines Polyeders, die sich an einem gemeinsamen Scheitelpunkt P treffen und die Kanten AP, BP und CP haben, ist der Kosinus des Diederwinkels zwischen den Seiten, die APC und BPC enthalten:
Siehe auch
Verweise
Externe Links
- Der Diederwinkel in der Holzbearbeitung bei Tips.FM
- Die Analyse der 5 regulären Polyeder liefert eine schrittweise Herleitung dieser genauen Werte.

















![{\displaystyle (\mathbf{u}_{1}\times\mathbf{u}_{2})\times (\mathbf{u}_{2}\times\mathbf{u}_{3})= [(\mathbf {u} _{2}\times \mathbf {u} _{3})\cdot \mathbf {u} _{1}]\mathbf {u} _{2}-[(\mathbf { u} _{2}\times \mathbf {u} _{3})\cdot \mathbf {u} _{2}]\mathbf {u} _{1}=[(\mathbf {u} _{2 }\times \mathbf{u}_{3})\cdot\mathbf{u}_{1}]\mathbf{u}_{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/78dfd079ef2f25bdd1f87bcbd9d208c2af4ca75b)



