Vinylogie - Vinylogy
Vinylogie ist die Übertragung elektronischer Effekte durch ein konjugiertes organisches Bindungssystem. Das Konzept wurde 1926 von Ludwig Claisen eingeführt , um die sauren Eigenschaften von Formylaceton und verwandten Ketoaldehyden zu erklären. Seine adjektivische Form, vinylog , wird verwendet, um funktionelle Gruppen zu beschreiben , bei denen die Standardeinheiten der Gruppe durch eine Kohlenstoff-Kohlenstoff-Doppelbindung getrennt sind. Beispielsweise wird eine Carbonsäure mit einer Kohlenstoff-Kohlenstoff-Doppelbindung (-HC = CH-, eine " Vinyl " -Einheit; tatsächlich eine Vinylengruppe) zwischen einer Carbonylgruppe und einer Hydroxylgruppe als vinyloge Carbonsäure bezeichnet .
Aufgrund der Übertragung elektronischer Informationen durch Konjugation besitzen vinyloge funktionelle Gruppen im Vergleich zur funktionellen Stammgruppe häufig eine " analoge " Reaktivität oder chemische Eigenschaften. Daher ist Vinylogie eine nützliche Heuristik zur Vorhersage des Verhaltens von Systemen, die strukturell ähnlich sind, aber dazwischenliegende C = C-Bindungen enthalten, die an die gebundenen funktionellen Gruppen konjugiert sind. Eine Schlüsseleigenschaft von Carbonsäuren ist beispielsweise ihre Brønsted-Säure. Die einfachste Carbonsäure, Ameisensäure (HC (= O) -OH), ist eine mäßig starke organische Säure mit einem ap K a von 3,7. Wir würden erwarten, dass vinyloge Carbonsäuren einen ähnlichen Säuregehalt haben. Tatsächlich hat das Vinylog von Ameisensäure, 2-Formyl-1-ethen-1-ol, HC (= O) -CH = CH-OH eine erhebliche Brønsted-Acidität mit einem geschätzten p K a ~ 5–6. Insbesondere vinyloge Carbonsäuren sind wesentlich stärkere Säuren als typische Enole (p K a ~ 12). Vitamin C ( Ascorbinsäure , siehe unten ) ist ein biologisch wichtiges Beispiel für eine vinyloge Carbonsäure.
Die Insertion eines o- oder p- Phenylens (dh eines Benzolrings in der 1,2- oder 1,4-Orientierung) führt ebenfalls zu einigen Ähnlichkeiten in der Reaktivität (als "Phenylogie" bezeichnet), obwohl der Effekt im Allgemeinen schwächer ist. da die Konjugation durch den Arylring die Berücksichtigung von Resonanzformen oder Zwischenprodukten erfordert, bei denen die Aromatizität gestört ist.

Vinyloge Reaktivität
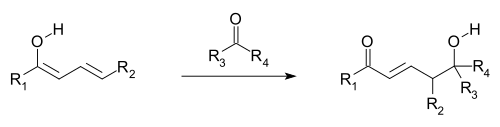
Es wird angenommen, dass vinyloge Reaktionen auftreten, wenn Orbitale der Doppelbindungen der Vinylgruppe und einer gebundenen elektronenziehenden Gruppe (EWG; die π-Orbitale) ausgerichtet sind und sich so überlappen und vermischen können (dh konjugiert sind ). Electron Delokalisierung ermöglicht die EWG erhalten Elektronendichte durch die Teilnahme des konjugierten Systems. Vinyloge Reaktionen umfassen auch konjugierte Additionen , bei denen ein Nucleophil am Vinylterminus reagiert, sowie eine vinyloge Variation der Aldolreaktion , bei der ein Elektrophil von einem nukleophilen vinylogenen Enolat angegriffen wird (siehe erstes und folgendes Bild). Das vinyloge Enolat reagiert an der Endposition des Doppelbindungssystems (dem γ-Kohlenstoff) und nicht an dem unmittelbar an das Carbonyl angrenzenden α-Kohlenstoff, wie dies bei einem einfachen Enolat der Fall wäre. Allylelektrophile reagieren häufig eher durch vinylogischen Angriff eines Nucleophils als durch direkte Addition.
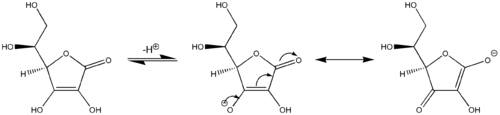
Ein weiteres Beispiel für die vinyloge Reaktivität: Ascorbinsäure (Vitamin C) verhält sich wie eine vinyloge Carbonsäure, indem ihre Carbonylgruppe, eine Vinylgruppe innerhalb des Rings und das einzige Paar an der Hydroxylgruppe, das als konjugiertes System fungiert, beteiligt sind . Acidität der Hydroxyl - Proton bei der Endstation der Vinylgruppe in Ascorbinsäure ist vergleichbar mit einem typischen Carbonsäure als ein Alkohol , weil zwei Hauptresonanzstrukturen , die negativen Ladung auf der Stabilisierung der konjugierten Base von Ascorbinsäure (mittleren und rechten Strukturen im Bild zurück ), analog zu den beiden Resonanzstrukturen, die die negative Ladung des Anions stabilisieren, die sich aus der Entfernung eines Protons aus einer einfachen Carbonsäure ergibt (vgl. erstes Bild). Analog zeigen Sorbinsäurederivate , die um eine andere "Vinyl" -Einheit verlängert sind, ebenfalls ein vinyloges Verhalten.
Weiterführende Literatur
- Lisboa, Marilda P.; Hoang, Tung T.; Dudley, Gregory B. (2011). "Tandem-nukleophile Addition / Fragmentierung von vinylogen Acyltriflaten: 2-Methyl-2- (1-Oxo-5-Heptinyl) -1,3-Dithiane" . Organische Synthesen . 88 : 353. doi : 10.15227 / orgsyn.088.0353 .