Arsentrioxid - Arsenic trioxide
 | |

| |
| Klinische Daten | |
|---|---|
| Aussprache | AR se nik tri OKS id |
| Namen austauschen | Trisenox, andere |
| Andere Namen | Arsen (III) -oxid, Arsen Sesquioxid , Arseneous -oxid, ratsbane, Arseneous Anhydrid-, Weiß Arsen, Aqua Tofanis |
| AHFS / Drugs.com | Monographie |
| MedlinePlus | a608017 |
| Lizenzdaten | |
| Schwangerschaft Kategorie |
|
| Wege Verwaltung |
Intravenös |
| Wirkstoffklasse | Antineoplastisches Mittel |
| ATC-Code | |
| Rechtsstellung | |
| Rechtsstellung | |
| Pharmakokinetische Daten | |
| Proteinbindung | 75% |
| Ausscheidung | Urin |
| Bezeichner | |
| |
| CAS-Nummer | |
| PubChem- CID | |
| Arzneimittelbank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| CompTox-Dashboard ( EPA ) | |
| ECHA-InfoCard |
100.014.075 |
| Chemische und physikalische Daten | |
| Formel | Als 2 O 3 |
| Molmasse | 197,840 g·mol -1 |
| 3D-Modell ( JSmol ) | |
| Dichte | 3,74 g / cm 3 |
| Schmelzpunkt | 312,2 °C (594,0 °F) |
| Siedepunkt | 465 °C (869 °F) |
| Löslichkeit in Wasser | 20 g/L (25 °C) (siehe Text) |
| |
| |
| Datenseite | |
| Arsentrioxid (Datenseite) | |
Arsentrioxid , das unter anderem unter dem Markennamen Trisenox vertrieben wird , ist eine anorganische Verbindung und ein Medikament. Als Industriechemikalie, deren Hauptanwendungsgebiete die Herstellung von Holzschutzmitteln , Pestiziden und Glas sind . Als Medikament wird es zur Behandlung einer Krebsart eingesetzt, die als akute Promyelozytäre Leukämie bekannt ist . Für diese Anwendung wird es in eine Vene injiziert .
Häufige Nebenwirkungen sind Erbrechen, Durchfall, Schwellungen, Kurzatmigkeit und Kopfschmerzen. Schwere Nebenwirkungen können das APL-Differenzierungssyndrom und Herzprobleme sein. Die Anwendung während der Schwangerschaft oder Stillzeit kann dem Baby schaden. Arsentrioxid hat die Formel As
2Ö
3. Sein Mechanismus bei der Behandlung von Krebs ist nicht ganz klar.
Arsentrioxid wurde in den Vereinigten Staaten im Jahr 2000 für medizinische Zwecke zugelassen. Es steht auf der Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation . Pro Jahr werden ca. 50.000 Tonnen produziert. Aufgrund seiner Toxizität gibt es in einer Reihe von Ländern Vorschriften für die Herstellung und den Verkauf.
Verwendet
Medizinisch
Arsentrioxid wird zur Behandlung einer Krebsart eingesetzt, die als akute Promyelozytäre Leukämie (APL) bekannt ist. Es kann sowohl in Fällen angewendet werden, in denen andere Wirkstoffe wie All-trans-Retinsäure (ATRA) nicht ansprechen, oder als Teil der Erstbehandlung neu diagnostizierter Fälle. Diese anfängliche Behandlung kann eine Kombinationstherapie von Arsentrioxid mit all-trans-Retinsäure (ATRA) umfassen.
Die Wirksamkeit scheint der von Realgar/Indigo naturalis ähnlich zu sein, das oral eingenommen werden kann und weniger teuer, aber weniger erhältlich ist.
In den 1970er Jahren entdeckten der chinesische Forscher Zhang Tingdong und Kollegen diese Verwendung. Es wurde in den Vereinigten Staaten im Jahr 2000 zur Behandlung von Leukämie zugelassen. Die Universität von Hongkong hat eine flüssige Form von Arsentrioxid entwickelt, die oral verabreicht werden kann. Arsenorganische Verbindungen wie Futtermittelzusatzstoffe ( Roxarson ) und Medikamente ( Neosalvarsan ) werden aus Arsentrioxid gewonnen.
Herstellung
Industrielle Verwendungen umfassen die Verwendung als Vorprodukt für Forstprodukte, in der farblosen Glasproduktion und in der Elektronik. Wobei die Hauptverbindung von Arsen ist das Trioxid der Vorläufer zu elementarem Arsen, Arsen - Legierungen und Arsenid - Halbleitern . Aus dem Trioxid werden Massenverbindungen auf Arsenbasis Natriumarsenit und Natriumcacodylat abgeleitet.
Eine Vielzahl von Anwendungen nutzt die Toxizität von Arsen, einschließlich der Verwendung des Oxids als Holzschutzmittel . Kupferarsenate , die aus Arsentrioxid gewonnen werden, werden in den USA und Malaysia in großem Umfang als Holzschutzmittel verwendet, aber solche Materialien sind in vielen Teilen der Welt verboten. Diese Praxis bleibt umstritten. In Verbindung mit Kupfer (II) -acetat , gibt Arsentrioxid das pulsierende Pigment bekannt als grünes Paris in Farben und als Rodentizid. Diese Anwendung wurde eingestellt.
Alternative Medizin
Trotz der bekannten Giftigkeit von Arsen wurde Arsentrioxid in der traditionellen chinesischen Medizin verwendet , wo es als pi-shuang ( chinesisch :砒霜; pinyin : pīshuāng ; wörtlich ' Arsenfrost ') bekannt ist. In der Homöopathie wird es Arsenicum album genannt . Einige in Verruf geratene Patentarzneimittel , zB Fowlers Lösung , enthielten Derivate von Arsenoxid.
Toxikologie
Arsentrioxid wird vom Verdauungssystem leicht aufgenommen: toxische Wirkungen sind auch beim Einatmen oder bei Hautkontakt bekannt. Die Elimination erfolgt zunächst rasch (Halbwertszeit 1–2 Tage), durch Methylierung zu Monomethylarsonsäure und Dimethylarsonsäure und Ausscheidung im Urin, jedoch wird eine gewisse Menge (30–40 % bei wiederholter Exposition) in Knochen, Muskeln, Haut, Haare und Nägel (alles keratinreiche Gewebe ) und über einen Zeitraum von Wochen oder Monaten ausgeschieden.
Die ersten Symptome einer akuten Arsenvergiftung durch Verschlucken sind Verdauungsprobleme: Erbrechen, Bauchschmerzen, Durchfall, oft begleitet von Blutungen. Subletale Dosen können zu Krämpfen , Herz-Kreislauf-Problemen, Leber- und Nierenentzündungen sowie zu Störungen der Blutgerinnung führen. Es folgen das Auftreten von charakteristischen weißen Linien ( Mees-Linien ) auf den Nägeln und Haarausfall. Niedrigere Dosen führen zu Leber- und Nierenproblemen und zu Veränderungen der Pigmentierung der Haut. Auch verdünnte Arsentrioxidlösungen sind bei Augenkontakt gefährlich.
Die giftigen Eigenschaften sind bekannt und Gegenstand einer umfangreichen Literatur.
Eine chronische Arsenvergiftung wird als Arsenikose bezeichnet. Diese Störung betrifft Arbeiter in Schmelzhütten , in Bevölkerungsgruppen, deren Trinkwasser hohe Mengen an Arsen (0,3–0,4 ppm) enthält, und bei Patienten, die über längere Zeit mit Arsen-basierten Arzneimitteln behandelt werden. In ähnlicher Weise zeigen Studien an exponierten Arbeitern in Kupfergießereien in den USA, Japan und Schweden ein 6- bis 10-fach höheres Lungenkrebsrisiko für die am stärksten exponierten Arbeiter im Vergleich zur Allgemeinbevölkerung. Die langfristige Einnahme von Arsentrioxid entweder über das Trinkwasser oder als medizinische Behandlung kann zu Hautkrebs führen. Reproduktionsprobleme (hohe Häufigkeit von Fehlgeburten, niedriges Geburtsgewicht, angeborene Deformationen) wurden auch in einer Studie mit Arsentrioxidstaub exponierten Frauen als Angestellte oder Nachbarn einer Kupfergießerei angezeigt.
In Österreich lebten die sogenannten „Arsenfresser der Steiermark “, die ohne erkennbaren Schaden weit über die tödliche Dosis von Arsentrioxid hinausgingen. Arsen soll anstrengende Arbeiten in großen Höhen, zB in den Alpen, ermöglichen.
In den USA haben die OSHA 1910.1018 Beruf zulässige Expositionsgrenze für anorganische Arsenverbindungen in Atemzone Luft 0,010 mg / m 3 .
Produktion und Vorkommen

Arsentrioxid kann durch routinemäßige Verarbeitung von Arsenverbindungen einschließlich der Oxidation (Verbrennung) von Arsen und arsenhaltigen Mineralien in Luft erzeugt werden . Anschaulich ist das Rösten von Orpiment , einem typischen Arsensulfiderz.
- 2 As
2S
3+ 9 O
2→ 2 As
2Ö
3+ 6 SO
2
Das meiste Arsenoxid fällt jedoch als flüchtiges Nebenprodukt bei der Verarbeitung anderer Erze an. Zum Beispiel setzt Arsenopyrit , eine übliche Verunreinigung in gold- und kupferhaltigen Erzen, beim Erhitzen an der Luft Arsentrioxid frei. Die Verarbeitung solcher Mineralien hat zu zahlreichen Vergiftungsfällen geführt. Nur in China werden absichtlich Arsenerze abgebaut.
Im Labor wird es durch Hydrolyse von Arsentrichlorid hergestellt :
- 2 AsCl 3 + 3 H 2 O → As 2 O 3 + 6 HCl
Wie
2Ö
3kommt in der Natur als zwei Mineralien vor, Arsenolith ( kubisch ) und Claudetit ( monoklin ). Beides sind relativ seltene Sekundärmineralien, die in Oxidationszonen von As-reichen Erzlagerstätten gefunden werden. As 2 O 3 -Schichten stehen für einen Teil der Strukturen der kürzlich entdeckten Minerale Lucabindiit, (K,NH 4 )As 4 O 6 (Cl,Br) und seines natriumanalogen Torrecillasits.
Eigenschaften und Reaktionen
Arsentrioxid ist ein amphoteres Oxid und seine wässrigen Lösungen sind schwach sauer . So löst es sich leicht in alkalischen Lösungen zu Arseniten . Es ist in Säuren weniger löslich, löst sich jedoch in Salzsäure auf .
Mit wasserfreiem HF und HCl erhält man AsF 3 und das Trichlorid:
- As 2 O 3 + 6 HX → 2 AsX 3 + 3 H 2 O (X = F, Cl)
Nur mit starken Oxidationsmitteln wie Ozon , Wasserstoffperoxid und Salpetersäure ist es ergibt Arsenpentoxid , Wie
2Ö
5 oder seine entsprechende Säure:
- 2 HNO 3 + As 2 O 3 + 2 H 2 O → 2 H 3 AsO 4 + N 2 O 3
In seiner Oxidationsbeständigkeit unterscheidet sich Arsentrioxid von Phosphortrioxid , das leicht zu Phosphorpentoxid verbrennt .
Reduktion ergibt elementares Arsen oder Arsin ( AsH
3) je nach Bedingungen:
- As 2 O 3 + 6 Zn + 12 HNO 3 → 2 AsH 3 + 6 Zn(NO 3 ) 2 + 3 H 2 O
Diese Reaktion wird im Marsh-Test verwendet .
Struktur
In der Flüssig- und Gasphase unter 800 °C hat Arsentrioxid die Formel As
4Ö
6und isostrukturell mit P
4Ö
6. Über 800 °C As
4Ö
6dissoziiert signifikant in molekulares As
2Ö
3, das die gleiche Struktur wie N . annimmt
2Ö
3. Im Festkörper sind drei Formen ( Polymorphe ) bekannt: ein Hochtemperatur- ( > 110 °C) kubisches As
4Ö
6, enthaltend molekulares As
4Ö
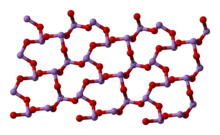
6, und zwei verwandte Polymerformen. Die Polymere, die beide als monokline Kristalle kristallisieren, weisen Schichten aus pyramidalem AsO . auf
3 Einheiten, die O-Atome teilen.
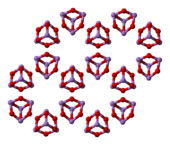
|

|
|
(kubisch) |
(monoklin) |
(monoklin) |
Gesellschaft und Kultur
Auswirkungen auf die Umwelt
Beim Schmelzen und der damit verbundenen Erzverarbeitung entsteht oft Arsentrioxid, das ein Risiko für die Umwelt darstellt . Beispielsweise verarbeitete die Giant Mine in Kanada erhebliche Mengen an Arsenopyrit- kontaminierten Golderzen.
Verweise
Externe Links
- "Arsentrioxid" . Informationsportal für Arzneimittel . US-amerikanische Nationalbibliothek für Medizin.
- Fallstudien in der Umweltmedizin: Arsentoxizität
- "Arsen und Arsenverbindungen" . Zusammenfassungen & Auswertungen . Internationale Agentur für Krebsforschung (IARC). Februar 1998.
- Internationale Chemikaliensicherheitskarte 0378
- NIOSH Pocket Guide zu chemischen Gefahren
- NTP-Bericht zu Karzinogenen – Anorganische Arsenverbindungen
- Institut national de recherche et de sécurité (1989). " Trioxyde d'arsenic. " Fiche toxicologique n° 89 . Paris: INRS. (auf Französisch)
