Antimontrisulfid - Antimony trisulfide
|
|

|
|
| Namen | |
|---|---|
|
IUPAC-Name
Diantimontrisulfid, Antimon(III)-sulfid
|
|
| Andere Namen
Antimonsulfid, Antimonsulfid, Antimonsesquisulfid, Antimonzinnoberrot, schwarzes Antimon, Antimonschwefel
|
|
| Bezeichner | |
|
3D-Modell ( JSmol )
|
|
| ChemSpider | |
| ECHA-Infokarte |
100.014.285 |
|
PubChem- CID
|
|
| UNII | |
|
CompTox-Dashboard ( EPA )
|
|
|
|
|
|
| Eigenschaften | |
| Sb 2 S 3 | |
| Molmasse | 339.715 |
| Aussehen | grauer / schwarzer orthorhombischer Kristall (Stibnit) |
| Dichte | 4,562 g cm -3 (Stibnit) |
| Schmelzpunkt | 550 °C (1.022 °F; 823 K) (Stibnit) |
| Siedepunkt | 1.150 °C (2.100 °F; 1.420 K) |
| 0,00017 g/100 ml (18 °C) | |
| -86,0·10 -6 cm 3 /mol | |
|
Brechungsindex ( n D )
|
4.046 |
| Thermochemie | |
|
Wärmekapazität ( C )
|
123,32 J/K mol |
|
Std
Bildungsenthalpie (Δ f H ⦵ 298 ) |
-157,8 kJ/mol |
| Gefahren | |
| NFPA 704 (Feuerdiamant) | |
| Letale Dosis oder Konzentration (LD, LC): | |
|
LD 50 ( mediane Dosis )
|
> 2000 mg/kg (Ratte, oral) |
| NIOSH (US-Grenzwerte für die Gesundheitsbelastung): | |
|
PEL (zulässig)
|
TWA 0,5 mg/m 3 (als Sb) |
|
REL (empfohlen)
|
TWA 0,5 mg/m 3 (als Sb) |
| Verwandte Verbindungen | |
|
Andere Anionen
|
Antimontrioxid Antimon- Triselenid Antimontellurid |
|
Andere Kationen
|
Arsentrisulfid Wismut(III)-sulfid |
|
Verwandte Verbindungen
|
Antimonpentasulfid |
|
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa). |
|
| Infobox-Referenzen | |
Antimontrisulfid (Sb 2 S 3 ) kommt in der Natur als kristallines Mineral Stibnit und als amorphes rotes Mineral (eigentlich ein Mineraloid) Metastibnit vor . Es wird für den Einsatz in Sicherheitsstreichhölzern , militärischer Munition, Sprengstoffen und Feuerwerkskörpern hergestellt. Es wird auch bei der Herstellung von rubinfarbenem Glas und in Kunststoffen als Flammschutzmittel verwendet. Historisch wurde die Stibnitform als graues Pigment in Gemälden des 16. Jahrhunderts verwendet. Antimontrisulfid wurde auch als bildempfindlicher Photoleiter in Vidicon-Kameraröhren verwendet. Es ist ein Halbleiter mit einer direkten Bandlücke von 1,8–2,5 eV. Bei geeigneter Dotierung können p- und n-Typ- Materialien hergestellt werden.
Vorbereitung und Reaktionen
Sb 2 S 3 kann aus den Elementen bei einer Temperatur von 500–900 °C hergestellt werden:
- 2 Sb + 3 S → Sb 2 S 3
Sb 2 S 3 wird ausgefällt, wenn H 2 S durch eine angesäuerte Lösung von Sb(III) geleitet wird. Diese Reaktion wurde als gravimetrisches Verfahren zur Bestimmung von Antimon verwendet, wobei das Blasen von H 2 S durch eine Lösung von Sb(III)-Verbindung in heißer HCl eine orangefarbene Form von Sb 2 S 3 abscheidet, die unter den Reaktionsbedingungen schwarz wird.
Sb 2 S 3 wird leicht oxidiert und reagiert heftig mit Oxidationsmitteln. Es brennt an der Luft mit einer blauen Flamme. Es reagiert unter Glühen mit Cadmium-, Magnesium- und Zinkchloraten. Gemische aus Sb 2 S 3 und Chloraten können explodieren.
Bei der Gewinnung von Antimon aus Antimonerzen wird das alkalische Sulfidverfahren angewendet, bei dem Sb 2 S 3 zu Thioantimonat(III)-Salzen (auch Thioantimonit genannt) reagiert:
- 3 Na 2 S + Sb 2 S 3 → 2 Na 3 SbS 3
Aus Sb 2 S 3 können eine Reihe von Salzen mit verschiedenen Thioantimonat(III)-Ionen hergestellt werden, darunter:
- [SbS 3 ] 3− , [SbS 2 ] − , [Sb 2 S 5 ] 4− , [Sb 4 S 9 ] 6− , [Sb 4 S 7 ] 2− und [Sb 8 S 17 ] 10−
" Schlippe-Salz ", Na 3 SbS 4 ·9H 2 O, ein Thioantimonat(V)-Salz wird gebildet, wenn Sb 2 S 3 mit Schwefel und Natriumhydroxid gekocht wird. Die Reaktion kann wie folgt dargestellt werden:
- Sb 2 S 3 + 3 S 2− + 2 S → 2 [SbS 4 ] 3−
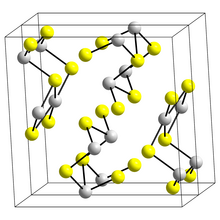
Struktur
Die Struktur der schwarzen nadelartigen Form von Sb 2 S 3 , Stibnit , besteht aus verbundenen Bändern, in denen sich Antimonatome in zwei verschiedenen Koordinationsumgebungen befinden, trigonal-pyramidal und quadratisch-pyramidal. Ähnliche Bänder treten in Bi 2 S 3 und Sb 2 Se 3 auf . Die rote Form, Metastibnit, ist amorph. Neuere Arbeiten legen nahe, dass es eine Reihe von eng verwandten temperaturabhängigen Strukturen von Stibnit gibt, die als Stibnit (I) bezeichnet wurden, die Hochtemperaturform, die zuvor als Stibnit (II) und Stibnit (III) identifiziert wurde. Andere Arbeiten zeigen, dass die eigentlichen Koordinationspolyeder von Antimon tatsächlich SbS 7 sind , mit (3+4)-Koordination an der M1-Stelle und (5+2) an der M2-Stelle. Diese Koordinationen berücksichtigen das Vorhandensein von Sekundärbindungen. Einige der Sekundärbindungen verleihen Kohäsion und sind mit Packungen verbunden.

