Arsenat - Arsenate
|
|
|||
| Namen | |||
|---|---|---|---|
|
IUPAC-Name
arsorate
|
|||
| Identifikatoren | |||
|
3D-Modell ( JSmol )
|
|||
| ChemSpider | |||
|
PubChem- CID
|
|||
|
CompTox-Dashboard ( EPA )
|
|||
|
|||
|
|||
| Eigenschaften | |||
|
AsO3− 4 |
|||
| Molmasse | 138.919 | ||
| Korrespondierende Säure | Arsensäure | ||
|
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Infobox-Referenzen | |||
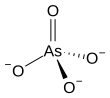
Das Arsenat- Ion ist As O3−
4. Ein Arsenat (Verbindung) ist jede Verbindung , die dieses Ion enthält. Arsenate sind Salze oder Ester der Arsensäure . Das Arsenatom in Arsenat hat eine Wertigkeit von 5 und wird auch als fünfwertiges Arsen oder As(V) bezeichnet . Arsenat ähnelt in vielerlei Hinsicht Phosphat , da Arsen und Phosphor in derselben Gruppe (Spalte) des Periodensystems vorkommen . Arsenate sind mäßige Oxidationsmittel mit einem Elektrodenpotential von +0,56 V zur Reduktion zu Arseniten .
Auftreten
Arsenate kommen natürlicherweise in einer Vielzahl von Mineralien vor . Diese Mineralien können hydratisierte oder wasserfreie Arsenate enthalten. Im Gegensatz zu Phosphaten gehen Arsenate bei der Verwitterung nicht aus einem Mineral verloren . Beispiele für arsenathaltige Mineralien umfassen Adamit , Alarsit , Annabergit , Erythrit und Legrandit . Wenn zwei Arsenat-Ionen zum Ladungsausgleich in einer Formel erforderlich sind, wird dies als Diarsenat bezeichnet, beispielsweise Trizink-Diarsenat, Zn 3 (AsO 4 ) 2 .
Ionen
Das Wort Arsenat leitet sich von Arsensäure , H 3 AsO 4 ab . Diese mittelstarke Säure wandelt sich in Dihydrogenarsenat ( H
2AsO−
4), Wasserstoffarsenat ( HAsO2−
4) und Arsenat ( AsO3−
4), abhängig vom pH-Wert. Die quantitative Beziehung zwischen diesen Spezies wird durch die Säuredissoziationskonstanten definiert:
- H 3 AsO 4 + H 2 O ⇌ H
2AsO−
4 + H 3 O + (log K 1 = −2,19) -
h
2AsO−
4 + H 2 O ⇌ HAsO2−
4 + H 3 O + (log K 2 = −6,94) -
HAsO2−
4 + H 2 O ⇌ AsO3−
4 + H 3 O + (log K 3 = −11,5)
Diese Werte ähneln denen der Hydrogenphosphate. Wasserstoffarsenat und Dihydrogenarsenat überwiegen in wässriger Lösung nahe dem neutralen pH-Wert.
Arsenatvergiftung
Arsenat kann anorganisches Phosphat im Schritt der Glykolyse ersetzen , der 1,3-Bisphosphoglycerat aus Glycerinaldehyd-3-phosphat erzeugt . Dies ergibt stattdessen 1-Arseno-3-phosphoglycerat , das instabil ist und schnell hydrolysiert und das nächste Zwischenprodukt im Stoffwechselweg bildet, 3-Phosphoglycerat . Daher schreitet die Glykolyse voran, aber das ATP- Molekül, das aus 1,3-Bisphosphoglycerat erzeugt würde, geht verloren – Arsenat ist ein Entkoppler der Glykolyse, was seine Toxizität erklärt.
Wie andere Arsenverbindungen bindet Arsenit an Liponsäure , hemmt die Umwandlung von Pyruvat in Acetyl-CoA , blockiert den Krebs-Zyklus und führt daher zu einem weiteren Verlust von ATP.