Aspartatcarbamoyltransferase - Aspartate carbamoyltransferase
| Aspartat-Carbamoyltransferase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Aspartatcarbamoyltransferase aus Escherichia coli . PDB 2ATC.
| |||||||||
| Identifikatoren | |||||||||
| EG-Nr. | 2.1.3.2 | ||||||||
| CAS-Nr. | 9012-49-1 | ||||||||
| Datenbanken | |||||||||
| IntEnz | IntEnz-Ansicht | ||||||||
| BRENDA | BRENDA-Eintrag | ||||||||
| ExPASy | NiceZyme-Ansicht | ||||||||
| KEGG | KEGG-Eintrag | ||||||||
| MetaCyc | Stoffwechselweg | ||||||||
| PRIAM | Profil | ||||||||
| PDB- Strukturen | RCSB PDB PDBe PDBsum | ||||||||
| Gen-Ontologie | AmiGO / QuickGO | ||||||||
| |||||||||
| Humane Carbamoyl-Phosphat-Synthetase 2, Aspartat-Transcarbamoylase, Dihydroorotase | |||||||
|---|---|---|---|---|---|---|---|
| Identifikatoren | |||||||
| Symbol | CAD | ||||||
| NCBI-Gen | 790 | ||||||
| HGNC | 1424 | ||||||
| OMIM | 114010 | ||||||
| RefSeq | NM_004341 | ||||||
| UniProt | P27708 | ||||||
| Andere Daten | |||||||
| EG-Nummer | 2.1.3.2 | ||||||
| Ort | Chr. 2 p22-p21 | ||||||
| |||||||
Aspartat-Carbamoyltransferase (auch bekannt als Aspartat-Transcarbamoylase oder ATCase ) katalysiert den ersten Schritt im Pyrimidin-Biosyntheseweg ( EC 2.1.3.2 ).
In E. coli ist das Enzym ein Proteinkomplex mit mehreren Untereinheiten , der aus 12 Untereinheiten (insgesamt 300 kDa) besteht. Die Zusammensetzung der Untereinheiten ist C 6 R 6 und bildet 2 Trimere der katalytischen Untereinheiten (34 kDa) und 3 Dimere der regulatorischen Untereinheiten (17 kDa). Die besondere Anordnung von katalytischen und regulatorischen Untereinheiten in diesem Enzym verleiht dem Komplex ein stark allosterisches Verhalten gegenüber seinen Substraten. Das Enzym ist ein archetypisches Beispiel für die allosterische Modulation der Feinsteuerung metabolischer Enzymreaktionen.
ATCase folgt nicht der Michaelis-Menten-Kinetik . Stattdessen liegt es zwischen seinem "angespannten" Zustand mit geringer Aktivität und geringer Affinität und seinen "entspannten" Zuständen mit hoher Aktivität und hoher Affinität. Die Bindung des Substrats an die katalytischen Untereinheiten führt zu einer Gleichgewichtsverschiebung in Richtung R-Zustand, während die Bindung von CTP an die regulatorischen Untereinheiten zu einer Gleichgewichtsverschiebung in Richtung T-Zustand führt. Die Bindung von ATP an die regulatorischen Untereinheiten führt zu einer Gleichgewichtsverschiebung in Richtung R-Zustand.
Reaktion
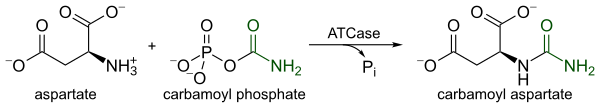
ATCase ist ein stark reguliertes Enzym, das den ersten engagierten Schritt in der Pyrimidin-Biosynthese katalysiert, die Kondensation von L-Aspartat und Carbamoylphosphat zu N-Carbamyl-L-Aspartat und anorganischem Phosphat . Die Katalyse durch ATCase dient als geschwindigkeitsbestimmender Schritt in der Pyrimidinbiosynthese, da sie ihre katalytische Geschwindigkeit als Reaktion auf die zellulären Spiegel von sowohl Pyrimidinen als auch Purinen ändert . Das Endprodukt des Pyrimidinweges, CTP , verringert die katalytische Geschwindigkeit, während ATP , das Endprodukt des parallelen Purinweges, die katalytische Geschwindigkeit erhöht.
Struktur
Die Diskussion über die Struktur, katalytischen Zentrum und allosterische Stelle , die auf der prokaryotischen Version von ATCase wird folgt basiert, insbesondere E. coli ' s.
Frühe Studien zeigten, dass ATCase aus zwei verschiedenen Arten von Polypeptidketten besteht, die unterschiedliche Rollen haben. Die katalytischen Untereinheiten katalysieren die Carbamylierung der Aminogruppe von Aspartat , besitzen jedoch keine regulatorischen Eigenschaften, während die regulatorischen Untereinheiten keine katalytische Aktivität aufweisen, jedoch die regulatorischen Stellen für die Effektorbindung enthalten. Der ATCase Holoenzym aus zwei katalytischen Trimere hergestellt , die in Kontakt sind und zusammen durch drei regulatorische Dimere gehalten, so dass die nativen Form des Enzyms enthält sechs Ketten jeder Art, mit einem Gesamtmolekulargewicht von 310 kDa .
Jede der katalytischen Domänen besteht aus zwei strukturellen Domänen, der Aspartatdomäne, die die meisten Reste enthält, die für die Aspartatbindung verantwortlich sind , und der Carbamoylphosphatdomäne, die die meisten Reste enthält, die an Carbamoylphosphat binden . Jede regulatorische Domäne ist ebenfalls aus zwei Domänen zusammengesetzt, die allosterische Domäne, die die Bindungsstelle für die Nukleotid - Effektoren und die Zink - Domäne, die aus vier Cystein - Resten in seiner C-terminalen Region geclustert. Diese Reste koordinieren ein Zinkatom , das an keiner katalytischen Eigenschaft beteiligt ist, sich aber als essentiell für die Assoziation von regulatorischen und katalytischen Untereinheiten erwiesen hat.
Die dreidimensionale Anordnung der katalytischen und regulatorischen Untereinheiten beinhaltet mehrere ionische und hydrophobe stabilisierende Kontakte zwischen Aminosäureresten. Jede katalytische Kette steht in Kontakt mit drei anderen katalytischen Ketten und zwei regulatorischen Ketten. Jedes regulatorische Monomer steht in Kontakt mit einer anderen regulatorischen Kette und zwei katalytischen Ketten. Im Enzym ohne Liganden stehen die beiden katalytischen Trimeren ebenfalls in Kontakt.
Katalytisches Zentrum
Das katalytische Zentrum der ATCase befindet sich an der Grenzfläche zwischen zwei benachbarten katalytischen Ketten im gleichen Trimer und enthält Aminosäureseitenketten von diesen beiden Untereinheiten. Einblicke in den Bindungsmodus von Substraten an das katalytische Zentrum der ATCase wurden erstmals durch die Bindung eines Bisubstrat-Analogons, N-(Phosphonoacetyl)-L-Aspartat (PALA), ermöglicht. Diese Verbindung ist ein starker Inhibitor der ATCase und weist eine Struktur auf, von der angenommen wird, dass sie der des Übergangszustands der Substrate sehr ähnlich ist . Außerdem wurden Kristallstrukturen von an Carbamoylphosphat und Succinat gebundener ATCase erhalten. Diese Studien haben neben Untersuchungen mit ortsgerichteter Mutagenese bestimmter Aminosäuren mehrere für die Katalyse entscheidende Reste identifiziert, wie Ser52, Thr53, Arg54, Thr55, Arg105, His134, Gln137, Arg167, Arg229, Glu231 und Ser80 und Lys84 von einer benachbarten katalytischen Kette. Das aktive Zentrum ist eine stark positiv geladene Tasche. Eine der kritischsten Seitenketten stammt von Arg54, das mit einem terminalen Sauerstoff und dem Anhydrid-Sauerstoff von Carbamoylphosphat wechselwirkt und die negative Ladung der abgehenden Phosphatgruppe stabilisiert. Arg105, His134 und Thr55 tragen durch Wechselwirkung mit dem Carbonylsauerstoff zur Erhöhung der Elektrophilie des Carbonylkohlenstoffs bei. Im Allgemeinen wird die Geschwindigkeitserhöhung der ATCase durch Orientierung und Stabilisierung von Substraten, Zwischenprodukten und Produkten erreicht, anstatt durch die direkte Beteiligung von Aminosäureresten am katalytischen Mechanismus.
Allosterische Seite
Die allosterische Stelle in der allosterischen Domäne der R-Ketten des ATCase-Komplexes bindet an die Nukleotide ATP, CTP und/oder UTP. In jedem regulatorischen Dimer gibt es eine Stelle mit hoher Affinität für ATP und CTP und eine mit 10- bis 20-fach niedrigerer Affinität für diese Nukleotide. ATP bindet überwiegend an die hochaffinen Stellen und aktiviert anschließend das Enzym, während die UTP- und CTP-Bindung zu einer Hemmung der Aktivität führt. UTP kann an die allosterische Stelle binden, aber die Hemmung der ATCase durch UTP ist nur in Kombination mit CTP möglich. Wenn CTP vorhanden ist, wird die UTP-Bindung verstärkt und vorzugsweise auf die Stellen mit niedriger Affinität gerichtet. Umgekehrt führt die UTP-Bindung zu einer erhöhten Affinität für CTP an den hochaffinen Stellen, und zusammen hemmen sie die Enzymaktivität um bis zu 95 %, während die CTP-Bindung allein die Aktivität auf 50 bis 70 % hemmt. Ein Vergleich der Kristallstrukturen der T- und R-Formen der ATCase zeigt, dass ihre Größe während des allosterischen Übergangs anschwillt und dass die katalytischen Untereinheiten während dieses Prozesses kondensieren. Die beiden katalytischen Trimeren bewegen sich entlang der dreizähligen Achse um 12 Å auseinander und rotieren jeweils um 5° um diese Achse, was letztendlich zu einer Umorientierung der regulatorischen Untereinheiten um ihre zweizählige Achse um 15° führt. Diese quaternäre Strukturänderung ist mit Veränderungen in den Wechselwirkungen zwischen Untereinheiten und zwischen Domänen verbunden. Die Wechselwirkung zwischen den Untereinheiten C1-C4 und R1 wird während dieser Umwandlung umfassend modifiziert. Insbesondere gibt es eine große Bewegung der Aminosäurereste 230-254, die zusammen als 240s-Schleife bekannt sind. Diese Reste befinden sich an der Spalte zwischen den Carbamoylphosphat- und Aspartatdomänen an der C1-C4-Grenzfläche. Das Gesamtergebnis dieser Strukturänderungen ist, dass die beiden Domänen jeder katalytischen Kette näher zusammenrücken, was einen besseren Kontakt mit den Substraten oder ihren Analoga gewährleistet .
Während dieses Strukturübergangs gehen einige Wechselwirkungen zwischen den Seitenketten verloren und andere werden aufgebaut. Studien haben bestätigt, dass die Position der 240s-Schleife die Substratbindung im entsprechenden aktiven Zentrum direkt beeinflusst. Frühere Studien mit ortsgerichteter Mutagenese der 240s-Schleife zeigten, dass Wechselwirkungen zwischen Asp271 und Tyr240 sowie zwischen Glu239 von C1 und Tyr165 von C4 den T-Zustand stabilisieren würden, während Wechselwirkungen zwischen Glu239 von C1 und sowohl Lys164 als auch Tyr165 von C4 stabilisieren würden der R-Zustand.
In der Nähe der 240s-Schleife und des aktiven Zentrums gelegen, spielt die Schleifenregion, die die Reste 160–166 umfasst, eine Rolle sowohl für die interne Architektur des Enzyms als auch für seine regulatorischen Eigenschaften. Insbesondere interagiert der Rest Asp162 mit Gln231 (von dem bekannt ist, dass er an der Aspartatbindung beteiligt ist) und bindet die gleichen Reste sowohl im T- als auch im R-Zustand. Eine Mutante, bei der dieser Rest zu Alanin mutiert war, zeigte eine enorme Verringerung der spezifischen Aktivität, eine zweifache Abnahme der Affinität für Aspartat , einen Verlust der homotropen Kooperativität und eine verringerte Aktivierung durch ATP . Es wurde vorgeschlagen, dass die durch die Einführung dieses Rests verursachte Änderung der Gesamtstruktur andere Reste in den R1-C1-, R1-C4- und C1-C4-Grenzflächen beeinflusst, die am quaternären Strukturübergang beteiligt sind .
Montage des Komplexes
Die regulatorischen und katalytischen Untereinheiten liegen als fusionierte Proteinhomologe vor, was einen starken Beweis dafür liefert, dass sie miteinander interagieren würden. Zwei katalytische Trimere und zwei regulatorische Dimere bilden ein Zwischenprodukt der Aspartatcarbamoyltransferase, bestehend aus 6 katalytischen Untereinheiten und 4 regulatorischen Untereinheiten.
Verweise
Externe Links
- Aspartat+Carbamoyltransferase in der US National Library of Medicine Medical Subject Headings (MeSH)