Bioorthogonale Chemie -Bioorthogonal chemistry
Der Begriff bioorthogonale Chemie bezieht sich auf jede chemische Reaktion , die innerhalb von lebenden Systemen ablaufen kann, ohne native biochemische Prozesse zu stören. Der Begriff wurde 2003 von Carolyn R. Bertozzi geprägt . Seit seiner Einführung hat das Konzept der bioorthogonalen Reaktion die Untersuchung von Biomolekülen wie Glykanen , Proteinen und Lipiden in Echtzeit in lebenden Systemen ohne zelluläre Toxizität ermöglicht. Eine Reihe chemischer Ligationsstrategien wurde entwickelt, die die Anforderungen der Bioorthogonalität erfüllen, einschließlich der 1,3-dipolaren Cycloaddition zwischen Aziden und Cyclooctinen(auch kupferfreie Klick-Chemie genannt ), zwischen Nitronen und Cyclooctinen, Oxim- / Hydrazon - Bildung aus Aldehyden und Ketonen , die Tetrazin - Ligation, die Isocyanid - basierte Klick-Reaktion und zuletzt die Quadricyclan-Ligation.
Die Anwendung der bioorthogonalen Chemie erfolgt typischerweise in zwei Schritten. Zuerst wird ein zelluläres Substrat mit einer bioorthogonalen funktionellen Gruppe (chemischer Reporter) modifiziert und in die Zelle eingeführt; Substrate schließen Metaboliten, Enzyminhibitoren usw. ein. Der chemische Reporter darf die Struktur des Substrats nicht dramatisch verändern, um eine Beeinflussung seiner Bioaktivität zu vermeiden. Zweitens wird eine Sonde, die die komplementäre funktionelle Gruppe enthält, eingeführt, um mit dem Substrat zu reagieren und es zu markieren.
Obwohl wirksame bioorthogonale Reaktionen wie die kupferfreie Klick-Chemie entwickelt wurden, führt die Entwicklung neuer Reaktionen weiterhin zu orthogonalen Markierungsmethoden, um die Verwendung mehrerer Markierungsmethoden in denselben Biosystemen zu ermöglichen. Bertozzi wurde 2022 für ihre Entwicklung der Klick-Chemie und der bioorthogonalen Chemie mit dem Nobelpreis für Chemie ausgezeichnet.
Etymologie
Das Wort bioorthogonal kommt aus dem Griechischen bio- „lebendig“ und orthogōnios „rechtwinklig“. Also buchstäblich eine Reaktion, die senkrecht zu einem lebenden System geht, es also nicht stört.
Anforderungen an die Bioorthogonalität
Um als bioorthogonal zu gelten, muss eine Reaktion eine Reihe von Anforderungen erfüllen:
- Selektivität: Die Reaktion muss zwischen endogenen funktionellen Gruppen selektiv sein, um Nebenreaktionen mit biologischen Verbindungen zu vermeiden
- Biologische Inertheit: Reaktive Partner und resultierende Verknüpfungen sollten keine Reaktivitätsart aufweisen, die die native chemische Funktionalität des untersuchten Organismus stören könnte.
- Chemische Inertheit: Die kovalente Bindung sollte stark und inert gegenüber biologischen Reaktionen sein.
- Kinetik: Die Reaktion muss schnell sein, damit eine kovalente Ligation vor dem Metabolismus und der Clearance der Sonde erreicht wird. Die Reaktion muss schnell sein, auf der Zeitskala zellulärer Prozesse (Minuten), um eine Konkurrenz bei Reaktionen zu verhindern, die die kleinen Signale von weniger häufig vorkommenden Arten verringern können. Schnelle Reaktionen bieten auch eine schnelle Reaktion, die notwendig ist, um dynamische Prozesse genau zu verfolgen.
- Reaktionsbiokompatibilität: Reaktionen müssen nicht toxisch sein und müssen unter biologischen Bedingungen unter Berücksichtigung des pH-Werts, der wässrigen Umgebung und der Temperatur funktionieren. Die Pharmakokinetik ist ein wachsendes Anliegen, da die bioorthogonale Chemie auf lebende Tiermodelle ausgeweitet wird.
- Zugängliches Engineering: Der chemische Reporter muss in der Lage sein, über irgendeine Form von Stoffwechsel- oder Protein-Engineering in Biomoleküle eingebaut zu werden. Optimalerweise ist auch eine der funktionellen Gruppen sehr klein, damit sie das native Verhalten nicht stört.
Staudinger-Ligatur
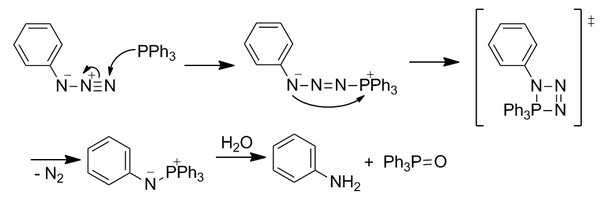
Die Staudinger-Ligation ist eine von der Bertozzi-Gruppe im Jahr 2000 entwickelte Reaktion, die auf der klassischen Staudinger-Reaktion von Aziden mit Triarylphosphinen basiert. Als erste Reaktion mit vollständig abiotischen funktionellen Gruppen eröffnete sie das Gebiet der bioorthogonalen Chemie, obwohl sie nicht mehr so weit verbreitet ist. Die Staudinger-Ligation wurde sowohl in lebenden Zellen als auch in lebenden Mäusen verwendet.
Bioorthogonalität
Das Azid kann als weiches Elektrophil wirken , das weiche Nucleophile wie Phosphine bevorzugt . Dies steht im Gegensatz zu den meisten biologischen Nukleophilen, die typischerweise harte Nukleophile sind. Die Reaktion läuft selektiv unter wassertoleranten Bedingungen ab, um ein stabiles Produkt zu erzeugen.
Phosphine kommen in lebenden Systemen vollständig nicht vor und reduzieren Disulfidbindungen trotz eines geringen Reduktionspotentials nicht. Es wurde gezeigt, dass Azide in von der FDA zugelassenen Arzneimitteln wie Azidothymidin und durch andere Verwendungen als Quervernetzer biokompatibel sind. Darüber hinaus können sie aufgrund ihrer geringen Größe über zelluläre Stoffwechselwege leicht in Biomoleküle eingebaut werden.
Mechanismus
Klassische Staudinger-Reaktion
Das nucleophile Phosphin greift das Azid am elektrophilen endständigen Stickstoff an. Durch einen viergliedrigen Übergangszustand geht N 2 unter Bildung eines Aza-Ylids verloren. Das instabile Ylid wird hydrolysiert, um Phosphinoxid und ein primäres Amin zu bilden. Diese Reaktion ist jedoch nicht unmittelbar bioorthogonal, da die Hydrolyse die kovalente Bindung im Aza-Ylid aufbricht.
Staudinger-Ligatur
Die Reaktion wurde modifiziert, um eine Estergruppe in ortho-Stellung zum Phosphoratom an einem der Arylringe einzuschließen, um das Aza-Ylid durch einen neuen Reaktivitätsweg zu dirigieren, um die sofortige Hydrolyse zu übertreffen, indem der Ester positioniert wird, um die lokale Konzentration zu erhöhen. Der anfängliche nukleophile Angriff auf das Azid ist der geschwindigkeitsbestimmende Schritt. Das Ylid reagiert mit der elektrophilen Esterfalle durch intramolekulare Cyclisierung unter Bildung eines fünfgliedrigen Rings. Dieser Ring wird hydrolysiert, um eine stabile Amidbindung zu bilden .
Einschränkungen
Die Phosphinreagenzien unterliegen in lebenden Systemen einer langsamen Luftoxidation. Darüber hinaus ist es wahrscheinlich, dass sie in vitro durch Cytochrom-P450- Enzyme metabolisiert werden.
Die Kinetik der Reaktionen ist langsam mit Geschwindigkeitskonstanten zweiter Ordnung um 0,0020 M –1 •s –1 . Versuche, die nukleophilen Angriffsgeschwindigkeiten durch Zugabe elektronenspendender Gruppen zu den Phosphinen zu erhöhen, verbesserten die Kinetik, erhöhten aber auch die Geschwindigkeit der Luftoxidation.
Die schlechte Kinetik erfordert, dass hohe Konzentrationen des Phosphins verwendet werden, was zu Problemen mit einem hohen Hintergrundsignal bei Abbildungsanwendungen führt. Es wurden Versuche unternommen, das Problem des hohen Hintergrunds durch die Entwicklung eines fluorogenen Phosphin-Reagens auf der Basis von Fluorescein und Luciferin zu bekämpfen , aber die intrinsische Kinetik bleibt eine Einschränkung.
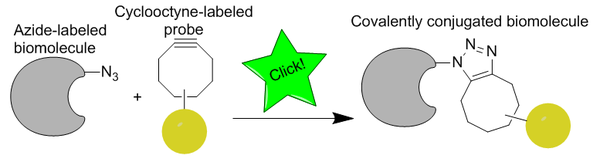
Kupferfreie Click-Chemie
Die kupferfreie Klick-Chemie ist eine bioorthogonale Reaktion, die zuerst von Carolyn Bertozzi als aktivierte Variante einer Azid-Alkin-Huisgen-Cycloaddition entwickelt wurde, basierend auf der Arbeit von Karl Barry Sharpless et al. Im Gegensatz zu CuAAC wurde die Cu-freie Click-Chemie so modifiziert, dass sie bioorthogonal ist, indem ein zytotoxischer Kupferkatalysator eliminiert wurde, wodurch die Reaktion schnell und ohne Lebendzelltoxizität ablaufen kann. Anstelle von Kupfer ist die Reaktion eine spannungsgeförderte Alkin-Azid-Cycloaddition ( SPAAC ). Sie wurde als schnellere Alternative zur Staudinger-Ligation entwickelt, wobei die ersten Generationen über sechzigmal schneller reagierten. Die Bioorthogonalität der Reaktion hat es ermöglicht, die Cu-freie Klickreaktion in kultivierten Zellen, lebenden Zebrafischen und Mäusen anzuwenden.
Kupfertoxizität
Die klassische Kupfer-katalysierte Azid-Alkin-Cycloaddition war eine extrem schnelle und effektive Klick-Reaktion für die Biokonjugation, aber sie ist aufgrund der Toxizität von Cu(I)-Ionen nicht für die Verwendung in lebenden Zellen geeignet. Die Toxizität beruht auf oxidativen Schäden durch reaktive Sauerstoffspezies, die von den Kupferkatalysatoren gebildet werden. Es wurde auch festgestellt, dass Kupferkomplexe Veränderungen im Zellstoffwechsel hervorrufen und von Zellen aufgenommen werden.
Es wurden einige Liganden entwickelt, um eine Schädigung von Biomolekülen zu verhindern und die Entfernung bei In-vitro- Anwendungen zu erleichtern. Es wurde jedoch festgestellt, dass unterschiedliche Ligandenumgebungen von Komplexen immer noch den Metabolismus und die Aufnahme beeinflussen können, wodurch eine unerwünschte Störung der Zellfunktion eingeführt wird.
Bioorthogonalität
Die Azidgruppe ist besonders bioorthogonal, weil sie extrem klein ist (günstig für die Zellpermeabilität und Störungen vermeidet), metabolisch stabil ist und nicht natürlicherweise in Zellen vorkommt und daher keine konkurrierenden biologischen Nebenreaktionen hat. Obwohl Azide nicht die reaktivsten 1,3-Dipole sind, die für eine Reaktion verfügbar sind, werden sie wegen ihres relativen Fehlens von Nebenreaktionen und ihrer Stabilität unter typischen Synthesebedingungen bevorzugt. Das Alkin ist nicht so klein, hat aber immer noch die Stabilität und Orthogonalität, die für die In-vivo- Markierung erforderlich sind. Cyclooctine sind traditionell die am häufigsten verwendeten Cycloalkine für Markierungsstudien, da sie den kleinsten stabilen Alkinring darstellen.
Mechanismus
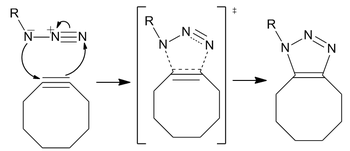
Die Reaktion verläuft als standardmäßige 1,3-dipolare Cycloaddition, eine Art asynchrone, konzertierte pericyclische Verschiebung. Die ambivalente Natur des 1,3-Dipols sollte die Identifizierung eines elektrophilen oder nukleophilen Zentrums am Azid unmöglich machen, so dass die Richtung des zyklischen Elektronenflusses bedeutungslos ist. [p] Berechnungen haben jedoch gezeigt, dass die Elektronenverteilung unter den Stickstoffatomen dazu führt, dass das innerste Stickstoffatom die größte negative Ladung trägt.
Regioselektivität
Obwohl die Reaktion ein regioisomeres Gemisch von Triazolen erzeugt, ist der Mangel an Regioselektivität bei der Reaktion kein Hauptanliegen für die meisten aktuellen Anwendungen. Regiospezifischere und weniger bioorthogonale Anforderungen werden am besten durch die kupferkatalysierte Huisgen-Cycloaddition erfüllt, insbesondere angesichts der synthetischen Schwierigkeit (im Vergleich zur Addition eines terminalen Alkins), ein gespanntes Cyclooctin zu synthetisieren.
Entwicklung von Cyclooctinen
| Cyclooctin | Geschwindigkeitskonstante zweiter Ordnung (M −1 s −1 ) |
|---|---|
| OKT | 0,0024 |
| ALO | 0,0013 |
| MOFO | 0,0043 |
| DIFO | 0,076 |
| DIBO | 0,057 |
| BARAC | 0,96 |
| DIBAC (ADIBO) | 0,31 |
| DIMAC | 0,0030 |
OCT war das erste Cyclooctin, das für die Cu-freie Klick-Chemie entwickelt wurde. Während lineare Alkine bei physiologischen Temperaturen nicht reagieren, konnte OCT unter biologischen Bedingungen leicht mit Aziden reagieren, ohne Toxizität zu zeigen. Es war jedoch schlecht wasserlöslich, und die Kinetik wurde gegenüber der Staudinger-Ligation kaum verbessert. ALO (arylless octyne) wurde entwickelt, um die Wasserlöslichkeit zu verbessern, hatte aber immer noch eine schlechte Kinetik.
Monofluorierte ( MOFO ) und difluorierte ( DIFO ) Cyclooctine wurden geschaffen, um die Geschwindigkeit durch die Addition von elektronenziehenden Fluorsubstituenten an der Propargylposition zu erhöhen . Fluor ist eine gute elektronenziehende Gruppe im Hinblick auf synthetische Zugänglichkeit und biologische Inertheit. Insbesondere kann es keinen elektrophilen Michael -Akzeptor bilden, der mit biologischen Nukleophilen nebenreagieren könnte. DIBO (Dibenzocyclooctin) wurde als Fusion an zwei Arylringe entwickelt, was zu einer sehr hohen Dehnung und einer Abnahme der Verzerrungsenergien führt. Es wurde vorgeschlagen, dass eine Biarylsubstitution die Ringspannung erhöht und eine Konjugation mit dem Alkin bereitstellt, um die Reaktivität zu verbessern. Obwohl Berechnungen vorausgesagt haben, dass eine Monoaryl-Substitution ein optimales Gleichgewicht zwischen sterischem Zusammenprall (mit Azidmolekül) und Spannung liefern würde, haben sich monoarylierte Produkte als instabil erwiesen.
BARAC (Biarylazacyclooctynon) folgte mit der Addition einer Amidbindung, die ein sp 2 -ähnliches Zentrum hinzufügt, um die Geschwindigkeit durch Verzerrung zu erhöhen. Die Amidresonanz trägt zu einer zusätzlichen Belastung bei, ohne eine zusätzliche Ungesättigtheit zu erzeugen, die zu einem instabilen Molekül führen würde. Zusätzlich verbessert die Addition eines Heteroatoms in den Cyclooctinring sowohl die Löslichkeit als auch die Pharmakokinetik des Moleküls. BARAC hat eine ausreichende Rate (und Empfindlichkeit) in dem Ausmaß, dass das Wegwaschen überschüssiger Sonde unnötig ist, um den Hintergrund zu reduzieren. Dies macht es äußerst nützlich in Situationen, in denen ein Waschen nicht möglich ist, wie bei der Echtzeit-Bildgebung oder der Bildgebung ganzer Tiere. Obwohl BARAC äußerst nützlich ist, erfordert seine geringe Stabilität, dass es bei 0 °C gelagert werden muss, vor Licht und Sauerstoff geschützt.
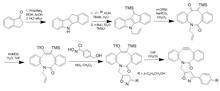
Weitere Anpassungsvariationen an BARAC zur Herstellung von DIBAC/ADIBO wurden durchgeführt, um die distale Ringspannung hinzuzufügen und die Sterik um das Alkin herum zu reduzieren, um die Reaktivität weiter zu erhöhen. Keto-DIBO, bei dem die Hydroxylgruppe in ein Keton umgewandelt wurde, weist aufgrund einer Änderung der Ringkonformation eine dreifache Erhöhung der Geschwindigkeit auf. Versuche, ein Difluorbenzocyclooctin ( DIFBO ) herzustellen, waren aufgrund der Instabilität erfolglos.
Probleme mit DIFO bei In-vivo -Mausstudien veranschaulichen die Schwierigkeit, bioorthogonale Reaktionen hervorzurufen. Obwohl DIFO bei der Markierung von Zellen äußerst reaktiv war, schnitt es in Mausstudien aufgrund der Bindung an Serumalbumin schlecht ab . Die Hydrophobie des Cyclooctins fördert die Sequestrierung durch Membranen und Serumproteine, wodurch die bioverfügbaren Konzentrationen reduziert werden. Als Reaktion darauf wurde DIMAC (Dimethoxyazacyclooctin) entwickelt, um die Wasserlöslichkeit, Polarität und Pharmakokinetik zu verbessern, obwohl die Bemühungen zur bioorthogonalen Markierung von Mausmodellen noch in der Entwicklung sind.
Reaktivität
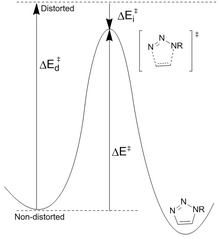
Rechnerische Bemühungen waren entscheidend für die Erklärung der Thermodynamik und Kinetik dieser Cycloadditionsreaktionen, die eine entscheidende Rolle bei der weiteren Verbesserung der Reaktion gespielt haben. Es gibt zwei Methoden zur Aktivierung von Alkinen ohne Stabilitätsverlust: Verringern der Übergangszustandsenergie oder Verringern der Reaktandenstabilität.

Abnehmende Stabilität der Reaktanten: Houk schlug vor, dass Unterschiede in der Energie (E d ‡ ), die erforderlich ist, um das Azid und das Alkin in die Übergangszustandsgeometrien zu verzerren, die Barrierenhöhen für die Reaktion steuern. Die Aktivierungsenergie (E ‡ ) ist die Summe aus destabilisierenden Verzerrungen und stabilisierenden Wechselwirkungen (E i ‡ ). Die signifikanteste Verzerrung liegt in der funktionellen Azidgruppe mit einem geringeren Beitrag der Alkinverzerrung. Es ist jedoch nur das Cyclooctin, das leicht für eine höhere Reaktivität modifiziert werden kann. Berechnete Reaktionsbarrieren für Phenylazid und Acetylen (16,2 kcal/mol) gegenüber Cyclooctin (8,0 kcal/mol) führen zu einem vorhergesagten Geschwindigkeitsanstieg von 10 6 . Das Cyclooctin benötigt weniger Verzerrungsenergie (1,4 kcal/mol gegenüber 4,6 kcal/mol), was trotz geringerer Wechselwirkungsenergie zu einer niedrigeren Aktivierungsenergie führt.
Verringerte Übergangszustandsenergie: Elektronenziehende Gruppen wie Fluor erhöhen die Geschwindigkeit durch Verringern der LUMO -Energie und der HOMO-LUMO-Lücke. Dies führt zu einem größeren Ladungstransfer vom Azid zum fluorierten Cyclooctin im Übergangszustand, einer Erhöhung der Wechselwirkungsenergie (niedriger negativer Wert) und der Gesamtaktivierungsenergie. Die Verringerung des LUMO ist das Ergebnis einer Hyperkonjugation zwischen Alkin-π-Donororbitalen und CF-σ*-Akzeptoren. Diese Wechselwirkungen sorgen hauptsächlich im Übergangszustand für eine Stabilisierung als Ergebnis erhöhter Donor/Akzeptor-Fähigkeiten der Bindungen, wenn sie sich verzerren. NBO-Rechnungen haben gezeigt, dass die Verzerrung des Übergangszustands die Wechselwirkungsenergie um 2,8 kcal/mol erhöht.
Die Hyperkonjugation zwischen π-Bindungen außerhalb der Ebene ist größer, da die π-Bindungen in der Ebene schlecht ausgerichtet sind. Die Biegung des Übergangszustands ermöglicht jedoch eine stärker antiperiplanare Anordnung der π-Bindungen in der Ebene, die die Wechselwirkung erleichtert. Eine zusätzliche Stabilisierung der hyperkonjugativen Wechselwirkungsenergie wird durch eine Zunahme der elektronischen Population des σ* aufgrund der sich bildenden CN-Bindung erreicht. Negative Hyperkonjugation mit den σ* CF-Bindungen verstärkt diese stabilisierende Wechselwirkung.
Regioselektivität
Obwohl die Regioselektivität kein großes Problem in den aktuellen bildgebenden Anwendungen der kupferfreien Klick-Chemie darstellt, ist es ein Problem, das zukünftige Anwendungen in Bereichen wie dem Wirkstoffdesign oder der Peptidomimetik verhindert.
Gegenwärtig reagieren die meisten Cyclooctine unter Bildung von Regioisomerengemischen. [m] Berechnungsanalysen haben ergeben, dass die Regioselektivität in der Gasphase zwar die 1,5-Addition gegenüber der 1,4-Addition um bis zu 2,9 kcal/mol an Aktivierungsenergie begünstigt, Solvatationskorrekturen jedoch zu denselben Energiebarrieren für beide Regioisomere führen. Während das 1,4-Isomer in der Cycloaddition von DIFO durch sein größeres Dipolmoment benachteiligt wird, wird es durch Solvatisierung stärker stabilisiert als das 1,5-Isomer, wodurch die Regioselektivität untergraben wird.
Symmetrische Cyclooctine wie BCN (Bicyclo[6.1.0]nonin) bilden bei der Cycloaddition ein einziges Regioisomer und könnten dazu beitragen, dieses Problem in Zukunft anzugehen.
Anwendungen
Die am weitesten verbreitete Anwendung der kupferfreien Klick-Chemie ist die biologische Bildgebung in lebenden Zellen oder Tieren unter Verwendung eines Azid-markierten Biomoleküls und eines Cyclooctins, das ein Bildgebungsmittel trägt.
Fluoreszierende Keto- und Oximvarianten von DIBO werden in Fluorschalter-Klickreaktionen verwendet, bei denen die Fluoreszenz des Cyclooctins durch das bei der Reaktion entstehende Triazol gequencht wird. Andererseits wurden Cumarin-konjugierte Cyclooctine wie coumBARAC so entwickelt, dass das Alkin die Fluoreszenz unterdrückt, während die Triazolbildung die Fluoreszenzquantenausbeute um das Zehnfache erhöht.
Die räumliche und zeitliche Kontrolle der Substratmarkierung wurde mit photoaktivierbaren Cyclooctinen untersucht. Dies ermöglicht eine Äquilibrierung des Alkins vor der Reaktion, um Artefakte infolge von Konzentrationsgradienten zu reduzieren. Maskierte Cyclooctine können im Dunkeln nicht mit Aziden reagieren, werden aber bei Bestrahlung mit Licht zu reaktiven Alkinen.
Die kupferfreie Click-Chemie wird zur Verwendung bei der Synthese von PET-Bildgebungsmitteln erforscht , die schnell mit hoher Reinheit und Ausbeute hergestellt werden müssen, um den Isotopenzerfall zu minimieren, bevor die Verbindungen verabreicht werden können. Sowohl die hohen Geschwindigkeitskonstanten als auch die Bioorthogonalität von SPAAC sind für die PET-Chemie zugänglich.
Andere bioorthogonale Reaktionen
Nitron-Dipol-Cycloaddition
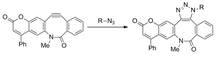
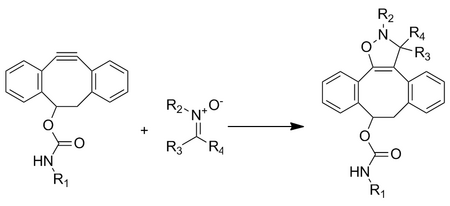
Die kupferfreie Click-Chemie wurde angepasst, um Nitrone als 1,3-Dipol anstelle von Aziden zu verwenden, und wurde zur Modifikation von Peptiden verwendet.
Diese Cycloaddition zwischen einem Nitron und einem Cyclooctin bildet N-alkylierte Isoxazoline. Die Reaktionsgeschwindigkeit wird durch Wasser erhöht und ist extrem schnell mit Geschwindigkeitskonstanten zweiter Ordnung im Bereich von 12 bis 32 M −1 •s −1 , abhängig von der Substitution des Nitrons. Obwohl die Reaktion extrem schnell ist, gibt es Probleme beim Einbau des Nitrons in Biomoleküle durch metabolische Markierung. Die Markierung wurde nur durch posttranslationale Peptidmodifikation erreicht.
Norbornen-Cycloaddition
Dipolare 1,3-Cycloadditionen wurden als bioorthogonale Reaktion unter Verwendung eines Nitriloxids als 1,3-Dipol und eines Norbornens als Dipolarophil entwickelt. Seine hauptsächliche Verwendung war die Markierung von DNA und RNA in automatisierten Oligonukleotid-Synthesizern und die Polymervernetzung in Gegenwart von lebenden Zellen.
Norbornene wurden aufgrund ihrer Ausgewogenheit zwischen durch Belastung geförderter Reaktivität und Stabilität als Dipolarophile ausgewählt. Zu den Nachteilen dieser Reaktion gehört die Kreuzreaktivität des Nitriloxids aufgrund starker Elektrophilie und langsamer Reaktionskinetik.
Oxanorbornadien-Cycloaddition
Die Oxanorbornadien -Cycloaddition ist eine 1,3-dipolare Cycloaddition, gefolgt von einer Retro- Diels-Alder -Reaktion zur Erzeugung eines triazolverknüpften Konjugats unter Eliminierung eines Furanmoleküls . Vorarbeiten haben seine Nützlichkeit in Peptidmarkierungsexperimenten nachgewiesen, und es wurde auch bei der Erzeugung von SPECT -Bildgebungsverbindungen verwendet. Vor kurzem wurde die Verwendung eines Oxanorbornadiens in einer katalysatorfreien „iClick“-Reaktion bei Raumtemperatur beschrieben, bei der eine Modellaminosäure mit der Metalleinheit in einem neuartigen Ansatz für bioorthogonale Reaktionen verknüpft wird.
Ringspannung und Elektronenmangel im Oxanorbornadien erhöhen die Reaktivität gegenüber dem geschwindigkeitsbestimmenden Schritt der Cycloaddition. Die Retro-Diels-Alder-Reaktion findet schnell danach statt, um das stabile 1,2,3-Triazol zu bilden. Zu den Problemen gehören eine schlechte Toleranz für Substituenten, die die Elektronik des Oxanorbornadiens verändern können, und niedrige Geschwindigkeiten (Geschwindigkeitskonstanten zweiter Ordnung in der Größenordnung von 10 –4 ).
Tetrazin-Ligation
Die Tetrazinligation ist die Reaktion eines trans-Cyclooctens und eines s - Tetrazins in einer Diels-Alder-Reaktion mit inversem Bedarf, gefolgt von einer Retro-Diels-Alder-Reaktion, um Stickstoffgas zu eliminieren. Die Reaktion ist extrem schnell mit einer Geschwindigkeitskonstante zweiter Ordnung von 2000 M −1 –s −1 (in 9:1 Methanol/Wasser), was Modifikationen von Biomolekülen bei extrem niedrigen Konzentrationen ermöglicht.
Basierend auf Berechnungen von Bach beträgt die Spannungsenergie für Z-Cyclooctene 7,0 kcal/mol im Vergleich zu 12,4 kcal/mol für Cyclooctan aufgrund des Verlusts von zwei transannularen Wechselwirkungen. E-Cycloocten hat eine stark verdrillte Doppelbindung, was zu einer Spannungsenergie von 17,9 kcal/mol führt. Als solches wird das hochgespannte trans-Cycloocten als reaktives Dienophil verwendet . Das Dien ist ein 3,6-Diaryl-s-tetrazin, das substituiert wurde, um einer sofortigen Reaktion mit Wasser zu widerstehen. Die Reaktion verläuft über eine anfängliche Cycloaddition, gefolgt von einer umgekehrten Diels-Alder, um N 2 zu eliminieren und die Reversibilität der Reaktion zu verhindern.
Die Reaktion ist nicht nur wassertolerant, sondern es wurde festgestellt, dass die Geschwindigkeit in wässrigen Medien zunimmt. Reaktionen wurden auch unter Verwendung von Norbornenen als Dienophilen mit Geschwindigkeiten zweiter Ordnung in der Größenordnung von 1 M −1 •s −1 in wässrigen Medien durchgeführt. Die Reaktion wurde bei der Markierung von lebenden Zellen und der Polymerkupplung angewendet.
[4+1]-Cycloaddition
Diese Isocyanid-Klick-Reaktion ist eine [4+1]-Cycloaddition, gefolgt von einer Retro-Diels-Alder-Eliminierung von N 2 .
Die Reaktion verläuft mit einer anfänglichen [4+1]-Cycloaddition, gefolgt von einer Umkehrung, um eine thermodynamische Senke zu eliminieren und eine Reversibilität zu verhindern. Dieses Produkt ist stabil, wenn ein tertiäres Amin oder Isocyanopropanoat verwendet wird. Wenn ein sekundäres oder primäres Isocyanid verwendet wird, bildet das Produkt ein Imin , das schnell hydrolysiert wird.
Isocyanid ist aufgrund seiner geringen Größe, Stabilität, Ungiftigkeit und Abwesenheit in Säugersystemen ein bevorzugter chemischer Reporter. Die Reaktion ist jedoch langsam, mit Geschwindigkeitskonstanten zweiter Ordnung in der Größenordnung von 10 –2 M –1 •s –1 .
Tetrazol-Photoclick-Chemie
Die Photoclick-Chemie nutzt eine photoinduzierte Cycloeliminierung zur Freisetzung von N 2 . Dies erzeugt über den Verlust von Stickstoffgas ein kurzlebiges 1,3-Nitrilimin-Zwischenprodukt, das eine 1,3-dipolare Cycloaddition mit einem Alken eingeht, um Pyrazolin-Cycloaddukte zu erzeugen.
Die Photoinduktion erfolgt durch kurze Lichteinwirkung (Wellenlänge ist tetrazolabhängig), um die Photoschädigung der Zellen zu minimieren. Die Reaktion wird unter wässrigen Bedingungen verstärkt und erzeugt ein einzelnes Regioisomer.
Das transiente Nitrilimin ist aufgrund einer gebogenen Struktur, die die Verzerrungsenergie reduziert, hoch reaktiv für die 1,3-dipolare Cycloaddition. Die Substitution mit elektronenspendenden Gruppen an Phenylringen erhöht die HOMO-Energie, wenn sie auf dem 1,3-Nitrilimin platziert wird, und erhöht die Reaktionsgeschwindigkeit.
Zu den Vorteilen dieses Ansatzes gehören die Fähigkeit, die Reaktion räumlich oder zeitlich zu steuern und die Fähigkeit, sowohl Alkene als auch Tetrazole unter Verwendung einfacher biologischer Methoden wie genetischer Kodierung in Biomoleküle einzubauen. Zusätzlich kann das Tetrazol fluorogen gestaltet werden, um den Fortschritt der Reaktion zu überwachen.
Quadricyclan-Ligation
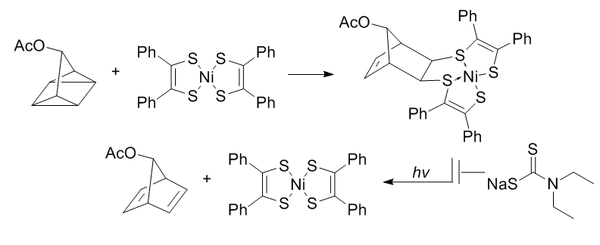
Die Quadricyclan-Ligation nutzt ein hochgespanntes Quadricyclan, um eine [2+2+2]-Cycloaddition mit π-Systemen einzugehen.
Quadricyclan ist abiotisch, reagiert nicht mit Biomolekülen (aufgrund vollständiger Sättigung), ist relativ klein und stark belastet (~80 kcal/mol). Es ist jedoch bei Raumtemperatur und unter wässrigen Bedingungen bei physiologischem pH-Wert sehr stabil. Es kann selektiv mit elektronenarmen π-Systemen reagieren, nicht aber mit einfachen Alkenen, Alkinen oder Cyclooctinen.
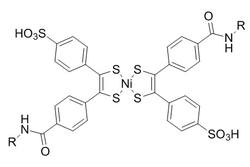
Bis(dithiobenzil)nickel(II) wurde als Reaktionspartner aus einem Kandidatenscreening basierend auf Reaktivität ausgewählt. Um eine lichtinduzierte Umwandlung in Norbornadien zu verhindern, wird Diethyldithiocarbamat hinzugefügt, um das Nickel im Produkt zu chelatisieren.
Diese Reaktionen werden durch wässrige Bedingungen mit einer Geschwindigkeitskonstante zweiter Ordnung von 0,25 M –1 •s –1 verstärkt . Von besonderem Interesse ist, dass es sich als bioorthogonal sowohl zur Oximbildung als auch zur kupferfreien Klick-Chemie erwiesen hat.
Verwendet
Bioorthogonale Chemie ist ein attraktives Werkzeug für Pretargeting - Experimente in der nuklearen Bildgebung und Strahlentherapie .