Kombinatorische Chemie - Combinatorial chemistry
Die kombinatorische Chemie umfasst chemische Synthesemethoden , die es ermöglichen, eine große Anzahl (Zehntausende oder sogar Millionen) von Verbindungen in einem einzigen Prozess herzustellen. Diese Verbindungsbibliotheken können als Mischungen, Sätze einzelner Verbindungen oder durch Computersoftware erzeugte chemische Strukturen erstellt werden. Die kombinatorische Chemie kann für die Synthese kleiner Moleküle und für Peptide verwendet werden.
Strategien zur Identifizierung nützlicher Komponenten der Bibliotheken sind ebenfalls Teil der kombinatorischen Chemie. Die Methoden der kombinatorischen Chemie werden auch außerhalb der Chemie angewendet.
Geschichte
Die kombinatorische Chemie wurde von Furka Á (Eötvös Loránd Universität Budapest Ungarn) erfunden, der ihr Prinzip, die kombinatorische Synthese und ein Dekonvolutionsverfahren in einem 1982 notariell beglaubigten Dokument beschrieb. Komponenten-Verbindungsmischung (kombinatorische Bibliothek) in einem einzigen schrittweisen Verfahren und durchmustern sie, um Arzneimittelkandidaten oder andere Arten von nützlichen Verbindungen auch in einem einzigen Verfahren zu finden. Die wichtigste Neuerung der kombinatorischen Methode ist der Einsatz von Mischungen in Synthese und Screening, die eine hohe Produktivität des Verfahrens gewährleisten. Beweggründe, die zur Erfindung führten, wurden 2002 veröffentlicht.
Einführung
Die kombinatorische Synthese von Molekülen kann schnell zu einer großen Anzahl von Molekülen führen. Zum Beispiel kann ein Molekül mit drei Diversitätspunkten ( R 1 , R 2 und R 3 ) mögliche Strukturen erzeugen , wobei , , und die Anzahl der verschiedenen verwendeten Substituenten sind.
Das Grundprinzip der kombinatorischen Chemie besteht darin, Bibliotheken einer sehr großen Anzahl von Verbindungen herzustellen und dann die nützlichen Komponenten der Bibliotheken zu identifizieren.
Obwohl die kombinatorische Chemie erst seit den 1990er Jahren von der Industrie wirklich aufgegriffen wurde, reichen ihre Wurzeln bis in die 1960er zurück, als ein Forscher der Rockefeller University , Bruce Merrifield , mit der Untersuchung der Festphasensynthese von Peptiden begann .
In ihrer modernen Form hat die kombinatorische Chemie wahrscheinlich ihren größten Einfluss in der pharmazeutischen Industrie gehabt . Forscher, die versuchen, das Aktivitätsprofil einer Verbindung zu optimieren, erstellen eine „ Bibliothek “ mit vielen verschiedenen, aber verwandten Verbindungen. Fortschritte in der Robotik haben zu einem industriellen Ansatz für die kombinatorische Synthese geführt, der es Unternehmen ermöglicht, routinemäßig über 100.000 neue und einzigartige Verbindungen pro Jahr herzustellen.
Um die große Zahl struktureller Möglichkeiten zu bewältigen, erstellen Forscher oft eine „virtuelle Bibliothek“, eine rechnerische Aufzählung aller möglichen Strukturen eines bestimmten Pharmakophors mit allen verfügbaren Reaktanten . Eine solche Bibliothek kann aus Tausenden bis Millionen von „virtuellen“ Verbindungen bestehen. Der Forscher wählt eine Teilmenge der "virtuellen Bibliothek" für die eigentliche Synthese aus, basierend auf verschiedenen Berechnungen und Kriterien (siehe ADME , Computational Chemistry und QSAR ).
Polymere (Peptide und Oligonukleotide)
Kombinatorische Split-Mix (Split und Pool) Synthese
Die kombinatorische Split-Mix-Synthese (Split und Pool) basiert auf der von Merrifield entwickelten Festphasensynthese . Wenn eine kombinatorische Peptidbibliothek unter Verwendung von 20 Aminosäuren (oder anderen Arten von Bausteinen) synthetisiert wird, wird der feste Träger in Perlenform in 20 gleiche Portionen geteilt. Darauf folgt die Kopplung einer anderen Aminosäure an jeden Teil. Der dritte Schritt ist das Mischen aller Portionen. Diese drei Schritte umfassen einen Zyklus. Eine Verlängerung der Peptidketten kann durch einfaches Wiederholen der Schritte des Zyklus realisiert werden.
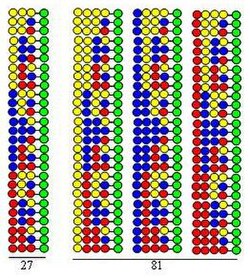
Das Verfahren wird durch die Synthese einer Dipeptidbibliothek unter Verwendung der gleichen drei Aminosäuren als Bausteine in beiden Zyklen veranschaulicht . Jede Komponente dieser Bibliothek enthält zwei Aminosäuren, die in unterschiedlicher Reihenfolge angeordnet sind. Die bei Kupplungen verwendeten Aminosäuren sind in der Abbildung durch gelbe, blaue und rote Kreise dargestellt. Abweichende Pfeile zeigen die Aufteilung des festen Trägerharzes (grüne Kreise) in gleiche Teile, vertikale Pfeile bedeuten Kopplung und konvergente Pfeile repräsentieren das Mischen und Homogenisieren der Teile des Trägers.
Die Abbildung zeigt, dass in den beiden Synthesezyklen 9 Dipeptide gebildet werden. Im dritten und vierten Zyklus würden sich 27 Tripeptide bzw. 81 Tetrapeptide bilden.
Die „Split-Mix-Synthese“ hat mehrere herausragende Eigenschaften:
- Es ist hocheffizient. Wie die Abbildung zeigt, steigt die Zahl der im Syntheseprozess gebildeten Peptide (3, 9, 27, 81) exponentiell mit der Zahl der ausgeführten Zyklen. Unter Verwendung von 20 Aminosäuren in jedem Synthesezyklus beträgt die Anzahl der gebildeten Peptide: 400, 8.000, 160.000 bzw. 3.200.000. Das bedeutet, dass die Anzahl der Peptide exponentiell mit der Anzahl der ausgeführten Zyklen ansteigt.
- Dabei entstehen alle Peptidsequenzen, die aus einer Kombination der in den Zyklen verwendeten Aminosäuren abgeleitet werden können.
- Das Portionieren des Trägers in gleiche Proben gewährleistet die Bildung der Komponenten der Bibliothek in nahezu gleichen molaren Mengen.
- Auf jedem Kügelchen des Trägers bildet sich nur ein einzelnes Peptid. Dies ist die Folge der Verwendung von nur einer Aminosäure in den Kupplungsschritten. Es ist jedoch völlig unbekannt, welches Peptid ein ausgewähltes Kügelchen besetzt.
- Das Split-Mix-Verfahren kann für die Synthese organischer oder jeder anderen Art von Bibliothek verwendet werden, die in einem schrittweisen Verfahren aus ihren Bausteinen hergestellt werden kann.
1990 beschrieben drei Gruppen Methoden zur Herstellung von Peptidbibliotheken durch biologische Methoden und ein Jahr später Fodor et al. veröffentlichten eine bemerkenswerte Methode zur Synthese von Peptidarrays auf kleinen Glasobjektträgern.
Zur Herstellung von Peptidarrays wurde von Mario Geysen und seinen Kollegen eine Methode der "Parallelsynthese" entwickelt. Sie synthetisierten 96 Peptide auf Kunststoffstäben (Pins), die an ihren Enden mit dem festen Träger beschichtet waren. Die Stifte wurden in die Lösung von Reagenzien eingetaucht, die in die Vertiefungen einer Mikrotiterplatte eingebracht wurden . Das Verfahren wird insbesondere bei der Verwendung von automatischen Parallelsynthesizern weit verbreitet angewendet. Obwohl die parallele Methode viel langsamer ist als die echte kombinatorische Methode, hat sie den Vorteil, dass genau bekannt ist, welches Peptid oder welche andere Verbindung sich auf jedem Pin bildet.
Weitere Verfahren wurden entwickelt, um die Vorteile von Split-Mix und Parallelsynthese zu kombinieren. Bei dem von zwei Gruppen beschriebenen Verfahren wurde der feste Träger zusammen mit einem Radiofrequenzetikett, das den Code der zu bildenden Verbindung in der Kapsel trug, in durchlässige Plastikkapseln eingeschlossen. Das Verfahren wurde ähnlich dem Split-Mix-Verfahren durchgeführt. Im Split-Schritt wurden die Kapseln jedoch entsprechend den aus den Radiofrequenz-Tags der Kapseln gelesenen Codes auf die Reaktionsgefäße verteilt.
Eine andere Methode zum gleichen Zweck wurde von Furka et al. heißt "String-Synthese". Bei dieser Methode trugen die Kapseln keinen Code. Sie werden wie die Perlen eines Colliers aufgereiht und in aufgereihter Form in die Reaktionsgefäße gelegt. Die Identität der Kapseln sowie ihr Inhalt werden durch ihre eingenommene Position auf den Schnüren gespeichert. Nach jedem Kupplungsschritt werden die Kapseln nach bestimmten Regeln auf neue Strings umverteilt.
Kleine Moleküle
Bei der Wirkstoffforschung war die Synthese und biologische Bewertung von interessierenden kleinen Molekülen typischerweise ein langer und mühsamer Prozess. Die kombinatorische Chemie hat sich in den letzten Jahrzehnten als ein Ansatz zur schnellen und effizienten Synthese einer großen Anzahl potenzieller niedermolekularer Wirkstoffkandidaten entwickelt. Bei einer typischen Synthese wird am Ende eines Syntheseschemas nur ein einziges Zielmolekül produziert, wobei jeder Schritt in einer Synthese nur ein einzelnes Produkt produziert. Bei einer kombinatorischen Synthese ist es bei Verwendung nur eines einzigen Ausgangsmaterials möglich, eine große Bibliothek von Molekülen unter identischen Reaktionsbedingungen zu synthetisieren, die dann auf ihre biologische Aktivität untersucht werden können . Dieser Produktpool wird dann in drei gleiche Portionen aufgeteilt, die jedes der drei Produkte enthalten, und dann wird jeder der drei einzelnen Pools dann mit einer anderen Einheit von Reagenz B, C oder D umgesetzt, wodurch 9 einzigartige Verbindungen aus den vorherigen 3 hergestellt werden. Dieser Vorgang wird dann wiederholt, bis die gewünschte Anzahl von Bausteinen hinzugefügt ist, wodurch viele Verbindungen erzeugt werden. Wenn eine Bibliothek von Verbindungen durch eine mehrstufige Synthese synthetisiert wird, müssen effiziente Reaktionsverfahren verwendet werden, und wenn herkömmliche Reinigungsverfahren nach jedem Reaktionsschritt verwendet werden, werden Ausbeute und Effizienz darunter leiden.
Die Festphasensynthese bietet potenzielle Lösungen, um typische Quenching- und Reinigungsschritte zu vermeiden, die häufig in der Synthesechemie verwendet werden. Im Allgemeinen wird ein Ausgangsmolekül an einen festen Träger (typischerweise ein unlösliches Polymer ) angeheftet , dann werden zusätzliche Reaktionen durchgeführt und das Endprodukt wird gereinigt und dann vom festen Träger abgespalten. Da die interessierenden Moleküle an einen festen Träger gebunden sind, ist es möglich, die Reinigung nach jeder Reaktion auf einen einzigen Filtrations-/Waschschritt zu reduzieren, wodurch die langwierige Flüssig-Flüssig-Extraktion und Lösungsmittelverdampfungsschritte, die die meisten synthetischen Chemien beinhalten, entfallen. Darüber hinaus können durch die Verwendung heterogener Reaktanten überschüssige Reagenzien verwendet werden, um träge Reaktionen zum Abschluss zu bringen, was die Ausbeuten weiter verbessern kann. Überschüssige Reagenzien können ohne zusätzliche Reinigungsschritte wie Chromatographie einfach weggewaschen werden .
Im Laufe der Jahre wurde eine Vielzahl von Methoden entwickelt, um den Einsatz der organischen Festphasensynthese in der kombinatorischen Chemie zu verfeinern, einschließlich Bemühungen, die Synthese und Reinigung zu vereinfachen, sowie nicht-traditionelle Methoden zur Charakterisierung von Zwischenprodukten. Obwohl die meisten der hier beschriebenen Beispiele heterogene Reaktionsmedien in jedem Reaktionsschritt verwenden, liefern Booth und Hodges ein frühes Beispiel für die Verwendung von feststoffgestützten Reagenzien nur während des Reinigungsschrittes traditioneller Lösungsphasensynthesen. Ihrer Ansicht nach bietet die Chemie in Lösung die Vorteile der Vermeidung von Bindungs- und Spaltungsreaktionen, die zum Verankern und Entfernen von Molekülen an Harzen erforderlich sind, sowie die Notwendigkeit, Festphasenanaloga etablierter Reaktionen in der Lösungsphase nachzubilden.
Der einzige Reinigungsschritt am Ende einer Synthese ermöglicht die Entfernung einer oder mehrerer Verunreinigungen, vorausgesetzt, die chemische Struktur der störenden Verunreinigungen ist bekannt. Während die Verwendung von Reagenzien auf Feststoffträgern die Synthese von Verbindungen stark vereinfacht, erfordern viele kombinatorische Synthesen mehrere Schritte, von denen jeder noch eine gewisse Form der Reinigung erfordert. Armstrong et al. beschreiben eine Eintopfmethode zur Erzeugung kombinatorischer Bibliotheken, die als Multikomponentenkondensationen (MCCs) bezeichnet werden. In diesem Schema reagieren drei oder mehr Reagenzien so, dass jedes Reagenz in einem einzigen Schritt in das Endprodukt eingebaut wird, wodurch die Notwendigkeit einer mehrstufigen Synthese entfällt, die viele Reinigungsschritte umfasst. In MCCs ist keine Dekonvolution erforderlich, um zu bestimmen, welche Verbindungen biologisch aktiv sind, da jede Synthese in einem Array nur ein einzelnes Produkt enthält, daher sollte die Identität der Verbindung eindeutig bekannt sein.
In einer anderen Array-Synthese erzeugte Still eine große Bibliothek von Oligopeptiden durch Split-Synthese. Der Nachteil bei der Herstellung von vielen Tausend Verbindungen besteht darin, dass es schwierig ist, die Struktur der gebildeten Verbindungen zu bestimmen. Ihre Lösung besteht darin, molekulare Tags zu verwenden, bei denen eine winzige Menge (1 pmol/Bead) eines Farbstoffs an die Kügelchen gebunden wird und die Identität eines bestimmten Kügelchens bestimmt werden kann, indem analysiert wird, welche Tags auf dem Kügelchen vorhanden sind. Obwohl das Anbringen von Tags die Identifizierung von Rezeptoren erleichtert, wäre es ziemlich unmöglich, jede Verbindung einzeln auf ihre Rezeptorbindungsfähigkeit zu untersuchen.
Wenn viele Reaktionen in einem Array durchgeführt werden müssen (wie die 96 Reaktionen, die in einem der MCC-Arrays von Armstrong beschrieben sind), können einige der mühsameren Aspekte der Synthese automatisiert werden, um die Effizienz zu verbessern. DeWitt und Czarnik beschreiben detailliert eine Methode namens " DIVERSOMER-Methode ", bei der viele miniaturisierte Versionen chemischer Reaktionen gleichzeitig ausgeführt werden. Dieses Verfahren verwendet eine Vorrichtung , die automatisiert die Harzbeladung und Waschzyklen, sowie die Reaktionszyklus Überwachung und Reinigung, und demonstrieren die Durchführbarkeit ihrer Verfahren und die Vorrichtung , indem sie es mit einer Vielzahl von Molekülklassen, wie beispielsweise zur Synthese von Hydantoinen und Benzodiazepinen , in den meisten Fällen 40 Einzelreaktionen laufen.
Oftmals ist es nicht möglich, teure Geräte zu verwenden, und Schwabacher et al. beschreiben ein einfaches Verfahren zum Kombinieren der parallelen Synthese von Bibliotheksmitgliedern und der Bewertung ganzer Bibliotheken von Verbindungen. Bei ihrem Verfahren wird ein Faden, der in verschiedene Bereiche unterteilt ist, um einen Zylinder gewickelt, wobei dann ein anderes Reagenz an jeden Bereich gekoppelt wird, der nur eine einzige Spezies trägt. Anschließend wird der Faden neu geteilt und um einen Zylinder anderer Größe gewickelt und dieser Vorgang wiederholt. Das Schöne an dieser Methode ist, dass die Identität jedes Produkts einfach durch seine Position entlang des Fadens erkannt werden kann und die entsprechende biologische Aktivität durch Fourier-Transformation von Fluoreszenzsignalen identifiziert wird .
Bei den meisten der hier beschriebenen Synthesen ist es erforderlich, das Ausgangsreagenz an/von einem festen Träger anzubringen und zu entfernen. Dies kann zur Bildung einer Hydroxylgruppe führen, die möglicherweise die biologische Aktivität einer Zielverbindung beeinträchtigen kann. Ellman verwendet Festphasenträger in einem mehrstufigen Syntheseschema, um 192 einzelne 1,4-Benzodiazepine-Derivate zu erhalten, die wohlbekannte Therapeutika sind. Um die Möglichkeit einer potentiellen Hydroxylgruppeninterferenz auszuschließen, wird ein neues Verfahren unter Verwendung der Silyl-Aryl-Chemie verwendet, um die Moleküle an den festen Träger zu binden, der sich vom Träger abspaltet und keine Spur des Linkers hinterlässt.
Bei der Verankerung eines Moleküls an einem festen Träger können Zwischenprodukte nicht voneinander isoliert werden, ohne das Molekül vom Harz abzuspalten. Da viele der traditionellen Charakterisierungstechniken, die verwendet werden, um den Reaktionsverlauf zu verfolgen und die Produktstruktur zu bestätigen, lösungsbasiert sind, müssen unterschiedliche Techniken verwendet werden. Gel-Phase 13 C-NMR-Spektroskopie, MALDI-Massenspektrometrie und IR-Spektroskopie wurden verwendet, um die Struktur zu bestätigen und den Fortschritt von Festphasenreaktionen zu überwachen. Gordon et al. beschreiben mehrere Fallstudien, die Imine und Peptidylphosphonate verwenden, um kombinatorische Bibliotheken kleiner Moleküle zu erzeugen. Um die Iminbibliothek zu erzeugen, wird eine an ein Harz gebundene Aminosäure in Gegenwart eines Aldehyds umgesetzt. Die Autoren demonstrieren die Verwendung der schnellen 13 C-Gelphasen-NMR-Spektroskopie und der magischen Winkeldrehung 1 H-NMR-Spektroskopie zur Überwachung des Reaktionsfortschritts und zeigten, dass die meisten Imine bei Raumtemperatur in nur 10 Minuten gebildet werden konnten, wenn Trimethylorthoformiat als das Lösungsmittel. Die gebildeten Imine wurden dann derivatisiert, um 4-Thiazolidinone, B-Lactame und Pyrrolidine zu erzeugen.
Die Verwendung von Festphasenträgern vereinfacht die Synthese großer kombinatorischer Bibliotheken von Verbindungen erheblich. Dies erfolgt durch Verankerung eines Ausgangsmaterials an einem festen Träger und anschließender Durchführung von Folgereaktionen, bis eine ausreichend große Bibliothek aufgebaut ist, wonach die Produkte vom Träger abgespalten werden. Die Verwendung der Festphasenreinigung wurde auch für die Verwendung in Lösungsphasen-Syntheseschemata in Verbindung mit Standard-Flüssig-Flüssig-Extraktionsreinigungstechniken demonstriert.
Dekonvolution und Screening
Kombinatorische Bibliotheken
Kombinatorische Bibliotheken sind spezielle Mehrkomponentenmischungen niedermolekularer chemischer Verbindungen, die in einem einstufigen Prozess synthetisiert werden. Sie unterscheiden sich sowohl von der Sammlung einzelner Verbindungen als auch von Serien von Verbindungen, die durch Parallelsynthese hergestellt wurden. Es ist ein wichtiges Merkmal, dass bei ihrer Synthese Mischungen verwendet werden. Der Einsatz von Mischungen gewährleistet die sehr hohe Effizienz des Verfahrens. Beide Reaktanten können Mischungen sein und in diesem Fall wäre das Verfahren noch effizienter. Aus praktischen Gründen empfiehlt sich jedoch die Split-Mix-Methode, bei der eine von zwei Mischungen durch Single Building Blocks (BBs) ersetzt wird. Die Mischungen sind so wichtig, dass es ohne Verwendung von Mischungen in der Synthese keine kombinatorischen Bibliotheken gibt, und wenn eine Mischung in einem Verfahren verwendet wird, bildet sich unweigerlich eine kombinatorische Bibliothek. Die Split-Mix-Synthese wird normalerweise mit einem festen Träger realisiert, kann aber auch in Lösung angewendet werden. Da die Komponenten unbekannt sind, müssen beim Screening Entfaltungsmethoden verwendet werden. Eines der wichtigsten Merkmale kombinatorischer Bibliotheken ist, dass die gesamte Mischung in einem einzigen Prozess gescreent werden kann. Dies macht diese Bibliotheken für die pharmazeutische Forschung sehr nützlich. Teilbibliotheken von vollständigen kombinatorischen Bibliotheken können ebenfalls synthetisiert werden. Einige von ihnen können in der Dekonvolution verwendet werden
Dekonvolution von Bibliotheken, die vom festen Träger abgespalten wurden
Werden die synthetisierten Moleküle einer kombinatorischen Bibliothek vom festen Träger abgespalten, entsteht ein lösliches Gemisch. In einer solchen Lösung können Millionen verschiedener Verbindungen gefunden werden. Als diese Synthesemethode entwickelt wurde, schien es zunächst unmöglich, die Moleküle zu identifizieren und Moleküle mit nützlichen Eigenschaften zu finden. Zur Lösung des Problems wurden jedoch Strategien zur Identifizierung der nützlichen Komponenten entwickelt. Alle diese Strategien basieren auf der Synthese und dem Testen von Teilbibliotheken. Die früheste iterative Strategie ist in dem oben erwähnten Dokument von Furka beschrieben, das 1982 notariell beglaubigt wurde und. Die Methode wurde später unabhängig von Erb et al. veröffentlicht. unter dem Namen „Rekursive Dekonvolution“
Rekursive Dekonvolution
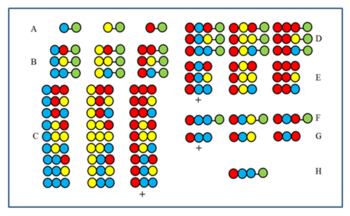
Das Verfahren wird durch die Abbildung verständlich gemacht. Eine 27-gliedrige Peptidbibliothek wird aus drei Aminosäuren synthetisiert. Nach dem ersten (A) und zweiten (B) Zyklus wurden die Proben vor dem Mischen beiseite gestellt. Die Produkte des dritten Zyklus (C) werden vor dem Mischen abgespalten und dann auf Aktivität getestet. Angenommen, die mit + gekennzeichnete Gruppe ist aktiv. Alle Mitglieder haben die rote Aminosäure an der letzten Kupplungsposition (CP). Folglich hat das aktive Mitglied auch die rote Aminosäure am letzten CP. Dann wird die rote Aminosäure an die drei nach dem zweiten Zyklus (B) beiseite gelegten Proben gekoppelt, um die Proben D zu erhalten. Nach der Spaltung werden die drei E-Proben gebildet. Wenn nach dem Testen die mit + markierte Probe die aktive ist, zeigt dies, dass die blaue Aminosäure den zweiten CP in der aktiven Komponente einnimmt. Dann wird an die drei A-Proben zuerst die blaue dann die rote Aminosäure gekoppelt (F) und dann nach der Spaltung erneut getestet (G). Erweist sich die +-Komponente als aktiv, wird die Reihenfolge der aktiven Komponente ermittelt und in H angezeigt.
Positionsabtastung
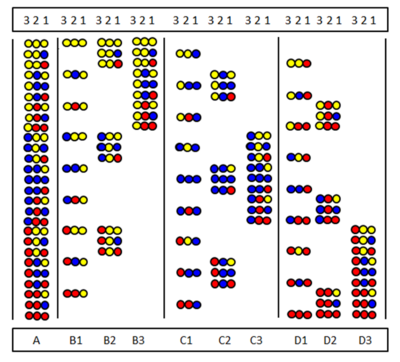
Positional Scanning wurde unabhängig von Furka et al. und Pinillaet al. Die Methode basiert auf der Synthese und dem Testen einer Reihe von Zweigstellen. bei denen eine bestimmte Sequenzposition von derselben Aminosäure besetzt ist. Die Abbildung zeigt die neun Unterbibliotheken (B1-D3) einer vollständigen Peptidtrimerbibliothek (A), die aus drei Aminosäuren besteht. In Teilbibliotheken gibt es eine Position, die in allen Komponenten von der gleichen Aminosäure eingenommen wird. Bei der Synthese einer Unterbibliothek wird der Träger nicht geteilt und nur eine Aminosäure an die gesamte Probe gekoppelt. Dadurch wird in allen Komponenten tatsächlich eine Position von der gleichen Aminosäure besetzt. In der B2-Sublibrary ist beispielsweise Position 2 in allen neun Komponenten von der „gelben“ Aminosäure besetzt. Wenn diese Zweigstelle bei einem Screening-Test positiv antwortet, bedeutet dies, dass auch Position 2 im aktiven Peptid von der „gelben“ Aminosäure besetzt ist. Die Aminosäuresequenz kann durch Testen aller neun (oder manchmal weniger) Unterbibliotheken bestimmt werden.
Auslassungsbibliotheken
In Weglassungsbibliotheken fehlt in allen Peptiden der Mischung eine bestimmte Aminosäure. Die Abbildung zeigt die vollständige Bibliothek und die drei Auslassungsbibliotheken. Oben werden die weggelassenen Aminosäuren angezeigt. Wenn die Auslassungsbibliothek einen negativen Test ergibt, ist die weggelassene Aminosäure in der aktiven Komponente vorhanden.
Dekonvolution von angebundenen kombinatorischen Bibliotheken
Wenn die Peptide nicht vom festen Träger abgespalten werden, haben wir es mit einer Mischung von Kügelchen zu tun, wobei jedes Kügelchen ein einzelnes Peptid enthält. Smith und seine Kollegen zeigten früher, dass Peptide auch in gebundener Form getestet werden können. Dieser Ansatz wurde auch beim Screening von Peptidbibliotheken verwendet. Die angebundene Peptidbibliothek wurde mit einem gelösten Zielprotein getestet. Die Kügelchen, an die das Protein gebunden war, wurden herausgesucht, das Protein von den Kügelchen entfernt, dann wurde das angebundene Peptid durch Sequenzierung identifiziert. Einen etwas anderen Ansatz verfolgten Taylor und Morken. Sie verwendeten Infrarotthermografie, um Katalysatoren in nicht-peptidgebundenen Bibliotheken zu identifizieren. Das Verfahren basiert auf der Wärme, die in den Kügelchen entwickelt wird, die einen Katalysator enthalten, wenn die angebundene Bibliothek in eine Lösung eines Substrats eingetaucht wird. Wenn die Kügelchen durch ein Infrarotmikroskop untersucht werden, erscheinen die den Katalysator enthaltenden Kügelchen als helle Flecken und können herausgegriffen werden.
Kodierte kombinatorische Bibliotheken
Wenn wir uns mit einer Bibliothek von Nicht-Peptid-organischen Bibliotheken befassen, ist es nicht so einfach, die Identität des Inhalts eines Beads zu bestimmen wie im Fall eines Peptids. Um diese Schwierigkeit zu umgehen, wurden Verfahren entwickelt, um parallel zur Synthese der Bibliothek Moleküle an die Kügelchen zu binden, die die Struktur der in den Kügelchen gebildeten Verbindung kodieren. Ohlmeyer und seine Kollegen veröffentlichten eine binäre Kodierungsmethode Sie verwendeten Mischungen von 18 Markierungsmolekülen, die nach Abspaltung von den Kügelchen durch Elektroneneinfang-Gaschromatographie identifiziert werden konnten. Sarkaret al. beschrieben chirale Oligomere von Pentensäureamiden (COPAs), die verwendet werden können, um massenkodierte OBOC-Bibliotheken zu konstruieren. Kerr et al. stellten eine innovative Kodierungsmethode vor Ein orthogonal geschützter entfernbarer bifunktioneller Linker wurde an die Kügelchen angebracht. Ein Ende des Linkers wurde verwendet, um die nicht-natürlichen Bausteine der Bibliothek zu binden, während an das andere Ende kodierende Aminosäuretripletts gebunden wurden. Die Bausteine waren nicht-natürliche Aminosäuren und die Reihe ihrer kodierenden Aminosäuretripletts konnte durch Edman-Abbau bestimmt werden. Der wichtige Aspekt dieser Art der Kodierung war die Möglichkeit, die Bibliotheksmitglieder zusammen mit ihren angehängten kodierenden Tags von den Kügelchen abzuspalten, um eine lösliche Bibliothek zu bilden. Der gleiche Ansatz wurde von Nikolajev et al. zur Codierung mit Peptiden. 1992 führten Brenner und Lerner DNA-Sequenzen ein, um die Kügelchen des festen Trägers zu kodieren, was sich als das erfolgreichste Kodierungsverfahren erwies. Auch Nielsen, Brenner und Janda nutzten den Kerr-Ansatz zur Umsetzung der DNA-Kodierung. In jüngster Zeit gab es wichtige Fortschritte bei der DNA-Sequenzierung. Die Techniken der nächsten Generation ermöglichen die parallele Sequenzierung einer großen Anzahl von Proben, was für das Screening von DNA-kodierten Bibliotheken sehr wichtig ist. Es gab eine weitere Innovation, die zum Erfolg der DNA-Kodierung beitrug. Im Jahr 2000 haben Halpin und Harbury den festen Träger bei der Split-Mix-Synthese der DNA-kodierten kombinatorischen Bibliotheken weggelassen und durch die kodierenden DNA-Oligomere ersetzt. Bei der Festphasen-Split- und Pool-Synthese darf die Anzahl der Komponenten von Bibliotheken die Anzahl der Kügelchen des Trägers nicht überschreiten. Durch den neuartigen Ansatz der Autoren wurde diese Einschränkung vollständig beseitigt und ermöglichte die Herstellung neuer Verbindungen in praktisch unbegrenzter Zahl. Die dänische Firma Nuevolution zum Beispiel synthetisierte eine DNA-kodierte Bibliothek mit 40 Billionen! Komponenten Die DNA-kodierten Bibliotheken sind löslich, was es ermöglicht, die effiziente Affinitätsbindung beim Screening anzuwenden. Einige Autoren wenden die DEL für Akromim von DNA-kodierten kombinatorischen Bibliotheken an, andere verwenden DECL. Letzteres scheint besser, da in diesem Namen der kombinatorische Charakter dieser Bibliotheken deutlich zum Ausdruck kommt. Mehrere Arten von DNA-kodierten kombinatorischen Bibliotheken wurden im ersten Jahrzehnt des gegenwärtigen Jahrtausends eingeführt und beschrieben. Diese Bibliotheken werden sehr erfolgreich in der Arzneimittelforschung eingesetzt.
- DNA-Templat-gesteuerte Synthese kombinatorischer Bibliotheken, die 2001 von Gartner et al.
- Doppelte Pharmakophor-DNA-kodierte kombinatorische Bibliotheken, die 2004 von Mlecco et al.
- Sequenzkodiertes Routing, veröffentlicht von Harbury Halpin und Harbury im Jahr 2004.
- Einzelne pharmakophore DNA kodierte kombinatorische Bibliotheken, die 2008 von Manocci et al.
- DNA-kodierte kombinatorische Bibliotheken, die unter Verwendung eines Reaktors im Yoktoliter-Maßstab gebildet wurden, veröffentlicht von Hansen et al. in 2009
Details zu ihrer Synthese und Anwendung finden Sie auf der Seite DNA-kodierte chemische Bibliothek . Die DNA-kodierten löslichen kombinatorischen Bibliotheken haben auch Nachteile. Zunächst einmal geht der Vorteil, der sich aus der Verwendung einer soliden Unterstützung ergibt, vollständig verloren. Außerdem begrenzt der polyionische Charakter von DNA-codierenden Ketten die Nützlichkeit nichtwässriger Lösungsmittel bei der Synthese. Aus diesem Grund entscheiden sich viele Laboratorien dafür, DNA-kompatible Reaktionen zur Verwendung bei der Synthese von DECLs zu entwickeln. Einige der verfügbaren sind bereits beschrieben
Materialwissenschaften
Die Materialwissenschaft hat die Techniken der kombinatorischen Chemie auf die Entdeckung neuer Materialien angewendet. Diese Arbeit wurde von PG Schultz et al. Mitte der neunziger Jahre im Zusammenhang mit lumineszierenden Materialien, die durch gemeinsame Abscheidung von Elementen auf einem Siliziumsubstrat erhalten werden. Seiner Arbeit ging 1970 JJ Hanak voraus, aber die Computer- und Robotik-Tools standen zu dieser Zeit nicht zur Verfügung, um die Methode zu verbreiten. Die Arbeit wurde von mehreren akademischen Gruppen sowie von Unternehmen mit großen Forschungs- und Entwicklungsprogrammen ( Symyx Technologies , GE , Dow Chemical usw.) fortgesetzt . Die Technik wurde in großem Umfang für Katalyse, Beschichtungen, Elektronik und viele andere Bereiche verwendet. Der Einsatz geeigneter Informatiktools ist entscheidend für die Handhabung, Verwaltung und Speicherung der enormen Datenmengen. Es wurden auch neue Arten von Versuchsplanungsmethoden entwickelt, um die großen Versuchsräume, die mit kombinatorischen Methoden angegangen werden können, effizient zu adressieren.
Diversity-orientierte Bibliotheken
Obwohl die kombinatorische Chemie seit mehr als zwei Jahrzehnten ein wesentlicher Bestandteil der frühen Wirkstoffforschung ist, wurde bisher nur eine de novo-synthetisierte Chemikalie aus der kombinatorischen Chemie von der FDA für die klinische Anwendung zugelassen ( Sorafenib , ein Multikinase-Inhibitor, der bei fortgeschrittenem Nierenkrebs indiziert ist). . Die Analyse der geringen Erfolgsrate des Ansatzes wurde in Verbindung mit dem eher begrenzten chemischen Raum vorgeschlagen, der von Produkten der kombinatorischen Chemie abgedeckt wird. Beim Vergleich der Eigenschaften von Verbindungen in Bibliotheken der kombinatorischen Chemie mit denen zugelassener Wirkstoffe und Naturstoffe stellten Feher und Schmidt fest, dass Bibliotheken der kombinatorischen Chemie besonders unter dem Mangel an Chiralität und Struktursteifigkeit leiden , die beide weithin als Wirkstoffe angesehen werden. wie Eigenschaften. Auch wenn die Entdeckung von Naturstoffen in der pharmazeutischen Industrie in letzter Zeit wahrscheinlich nicht gerade der modischste Trend war, handelt es sich bei einem Großteil der neuen chemischen Substanzen immer noch um aus der Natur gewonnene Verbindungen, und daher wurde vorgeschlagen, dass die Wirksamkeit der kombinatorischen Chemie verbessert, indem die chemische Vielfalt von Screening-Bibliotheken erhöht wird. Da Chiralität und Rigidität die beiden wichtigsten Merkmale sind, die zugelassene Wirkstoffe und Naturstoffe von Verbindungen in Bibliotheken der kombinatorischen Chemie unterscheiden, werden diese beiden Aspekte stattdessen in sogenannten diversitätsorientierten Bibliotheken betont, dh Verbindungssammlungen, die auf die Abdeckung des chemischen Raums abzielen von nur einer großen Anzahl von Verbindungen.
Unterklasse der Patentklassifizierung
In der 8. Ausgabe der Internationalen Patentklassifikation (IPC), die am 1. Januar 2006 in Kraft getreten ist, wurde für Patentanmeldungen und Patente im Zusammenhang mit Erfindungen im Bereich der kombinatorischen Chemie eine spezielle Unterklasse geschaffen : "C40B".
Siehe auch
- Kombinatorik
- Cheminformatik
- Kombinatorische Biologie
- Wirkstoffforschung
- Dynamische kombinatorische Chemie
- Hochdurchsatz-Screening
- Mathematische Chemie
- Molekulare Modellierung
Verweise
Externe Links
- Englische Version des Dokuments von 1982
- "Die verborgene Seite der Geschichte der kombinatorischen Chemie"
- "Glossar der in der kombinatorischen Chemie verwendeten Begriffe" der IUPAC
- ACS Combinatorial Science (ehemals Journal of Combinatorial Chemistry )
- Übersicht über die kombinatorische Chemie
- Molekulare Vielfalt
- Kombinatorische Chemie und Hochdurchsatz-Screening
- Kombinatorische Chemie: ein Online-Journal
- SmiLib - Eine kostenlose Open-Source-Software für die kombinatorische Bibliotheksaufzählung
- GLARE - Eine kostenlose Open-Source-Software für kombinatorisches Bibliotheksdesign