Hemidesmosom - Hemidesmosome
| Hemidesmosom | |
|---|---|
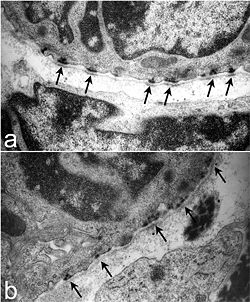 Ultrastruktur trachealer Hemidesmosomen bei Mäusen. Bei einer normalen Maus (a) gibt es gut definierte, organisierte Hemidesmosomen mit dunklen Bereichen in der Lamina densa, die an das Hemidesmosom angrenzen (Pfeile). Im Gegensatz dazu sind Hemidesmosomen in Lamc2 -/- Tracheas (b) weniger organisiert, die intrazelluläre Komponente ist diffuser und der Lamina densa direkt unter den hemidesmosomalen Bereichen fehlt die in der Wurfgeschwisterkontrolle beobachtete Elektronendichte (Pfeile). Von Nguyen et al., 2006.
| |
| Einzelheiten | |
| Bezeichner | |
| Latein | Hemidesmosom |
| Gittergewebe | D022002 |
| NS | H1.00.01.1.02029 |
| FMA | 67415 |
| Anatomische Terminologie | |
Hemidesmosomen sind sehr kleine bolzenartige Strukturen, die in Keratinozyten der Epidermis der Haut vorkommen und an der extrazellulären Matrix anhaften . Sie ähneln in ihrer Form den Desmosomen, wenn sie durch Elektronenmikroskopie sichtbar gemacht werden , jedoch heften sich Desmosomen an benachbarte Zellen. Hemidesmosomen sind auch mit fokalen Adhäsionen vergleichbar , da sie beide Zellen an die extrazelluläre Matrix binden. Anstelle von Desmogleinen und Desmocollinen im extrazellulären Raum verwenden Hemidesmosomen Integrine . Hemidesmosomen werden in Epithelzellen gefunden, die die Basalepithelzellen mit der Lamina lucida verbinden , die Teil der Basallamina ist . Hemidesmosomen sind auch an Signalwegen wie der Keratinozytenmigration oder dem Eindringen von Karzinomzellen beteiligt .
Struktur
Hemidesmosomen können aufgrund ihrer Proteinbestandteile in zwei Typen eingeteilt werden. Hemidesmosomen vom Typ 1 werden in geschichtetem und pseudo-geschichtetem Epithel gefunden . Typ-1-Hemidesmosomen haben fünf Hauptelemente: Integrin α6β4, Plectin in seiner Isoform 1a, dh P1a, Tetraspanin- Protein CD151, BPAG1e oder bullöses Pemphigoid-Antigen-Isoform e und BPAG2 (auch bekannt als BP180 oder Typ 17-Kollagen). Hemidesmosomen vom Typ 1 werden in geschichtetem und pseudostratifiziertem Epithelgewebe gefunden. Typ-2-Hemidesmosomen enthalten Integrin α6β4 und Plectin ohne die BP-Antigene.
Hemidesmosomen haben zwei membranüberspannende Komponenten: Integrin α6β4 und Plectin 1a. Integrin α6β4 arbeitet als Laminin-332- Rezeptor. Integrin α6β4 besteht aus zwei α- und β-Untereinheitsdimeren. Die größere β4-Untereinheit weist Domänen auf, die an Fibronectin III und Calcium binden . Die α6-Untereinheit bindet an extrazelluläres BP180, CD151 und Laminin-322. Wenn Integrin α6β4 an Plectin 1a und BPAG1 bindet, assoziiert es mit den Keratin- Zwischenfilamenten im Zytoskelett.
Hemidesmosomen sind durch Plectin-Isoform 1a aus der Familie der Plakin- Proteine mit Keratin verbunden . Plectin ist ein 500 kDa-Protein mit einer langen, stäbchenförmigen Domäne und einer Domäne am Ende, die eine intermediäre Filamentbindungsstelle enthält. BPAG2 oder (bullöses Pemphigoid-Antigen 2) ist ein Transmembranprotein, das neben Integrinen existiert. BPAG2 hat Domänen, die an Plectin, die Integrin-β4-Untereinheit im Zytoplasma und Integrin α6 und Laminin-332 im extrazellulären Raum binden. CD151, ein Protein der Tetraspanin- Superfamilie, befindet sich auf der Zelloberfläche von Keratinozyten und vaskulärem Endothel . CD151 unterstützt die Hemidesmosomenbildung. BPAG1e ist ein Antigen mit mehreren Isoformen , das an Integrin α6β4, BPAG2 und Keratin 5 und 14 bindet . Die Hauptaufgabe von BPAG1e ist die Stabilität der Hemidesmosomen.
Krankheiten
Die Bindung der basalen epidermalen Keratinozyten an die Basallamina ist für die Hauthomöostase von entscheidender Bedeutung . Genetische oder erworbene Krankheiten, die eine Störung der Hemidesmosom-Komponenten verursachen, können zu Hautblasenbildungsstörungen zwischen verschiedenen Hautschichten führen. Diese werden zusammenfassend als Epidermolysis bullosa oder EB bezeichnet. Typische Symptome sind empfindliche Haut, Blasenbildung und Erosion durch leichte körperliche Belastung. Die Krankheit kann sich jedoch auch als Erosionen an Hornhaut, Luftröhre, Magen-Darm-Trakt, Speiseröhre, Muskeldystrophie und Muskeldeformität manifestieren .
Mutationen in 12 verschiedenen Genen, die für Teile des Hemidesmosoms kodieren, haben zur Epidermolysis bullosa geführt. Es gibt drei Arten von EB: EB simplex (EBS), dystrophische EB (DEB) und junktionale EB (JEB). Bei der Epidermolysis bullosa simplex trennen sich Schichten der Epidermis. EBS wird durch Mutationen verursacht, die für Keratin, Plectin und BPAG1e kodieren. Bei der junktionalen Epidermolysis bullosa trennen sich Schichten der Lamina lucida (Teil der Basallamina). Dies wird durch Mutationen in Integrin α6β4, Laminin 322 und BPAG2 verursacht. Bei der dystrophischen Epidermolysis bullosa trennen sich die Schichten der papillären Dermis von den Verankerungsfibrillen . Dies wird durch Mutationen im Kollagen-7- Gen verursacht.
