Linamarin - Linamarin
|
|

|
|

|
|
| Namen | |
|---|---|
|
IUPAC-Name
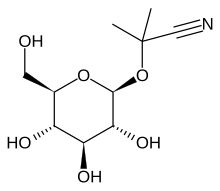
2-(β- D- Glucopyranosyloxy)-2-methylpropannitril
|
|
|
Bevorzugter IUPAC-Name
2-Methyl-2 - {[(2 S , 3 R , 4 S , 5 S , 6 R ) -3,4,5-Trihydroxy-6- (hydroxymethyl) oxan-2-yl] oxy} propannitril |
|
| Andere Namen
Phaseolunatin
|
|
| Identifikatoren | |
|
3D-Modell ( JSmol )
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA-Infokarte |
100.164.971 |
| KEGG | |
|
PubChem- CID
|
|
| UNII | |
|
CompTox-Dashboard ( EPA )
|
|
|
|
|
|
| Eigenschaften | |
| C 10 H 17 N O 6 | |
| Molmasse | 247,248 g/mol |
| Aussehen | farblose Nadeln |
| Dichte | 1,41 g·cm -3 |
| Schmelzpunkt | 143 bis 144 °C (289 bis 291 °F; 416 bis 417 K) |
| gut | |
|
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Infobox-Referenzen | |
Linamarin ist ein cyanogenes Glukosid, das in den Blättern und Wurzeln von Pflanzen wie Maniok , Limabohnen und Flachs vorkommt . Es ist ein Glucosid von Acetoncyanhydrin . Bei Exposition gegenüber Enzymen und der Darmflora im menschlichen Darm können sich Linamarin und sein methylierter Verwandter Lotaustralin in die giftige Chemikalie Blausäure zersetzen ; Daher erfordert die Verwendung von Pflanzen, die erhebliche Mengen an Linamarin enthalten, als Nahrungsmittel eine umfangreiche Vorbereitung und Entgiftung. Verschlucktes und resorbiertes Linamarin wird schnell mit dem Urin ausgeschieden und das Glucosid selbst scheint nicht akut toxisch zu sein. Der Konsum von Maniokprodukten mit niedrigem Linamarin-Gehalt ist in den Tropen des Flachlandes weit verbreitet. Die Einnahme von Nahrungsmitteln, die aus unzureichend verarbeiteten Maniokwurzeln mit hohem Linamaringehalt zubereitet wurden, wurde mit einer ernährungsbedingten Toxizität in Verbindung gebracht, insbesondere mit der als Konzo bekannten Erkrankung des oberen Motoneurons bei der afrikanischen Bevölkerung, in der sie zuerst von Trolli und später durch das von Hans Rösling . Es wird jedoch angenommen, dass die Toxizität durch die Einnahme von Acetoncyanhydrin , dem Abbauprodukt von Linamarin , induziert wird . Die ernährungsbedingte Exposition gegenüber Linamarin wurde auch als Risikofaktor für die Entwicklung von Glukoseintoleranz und Diabetes berichtet , obwohl Studien an Versuchstieren diese Wirkung widersprüchlich reproduzierten und darauf hinweisen könnten, dass die primäre Wirkung in der Verschlimmerung bestehender Erkrankungen besteht und nicht in der alleinigen Herbeiführung von Diabetes .
Die Bildung von Cyanid aus Linamarin ist normalerweise enzymatisch und erfolgt, wenn Linamarin Linamarase ausgesetzt wird , einem Enzym, das normalerweise in den Zellwänden von Maniokpflanzen exprimiert wird. Da die resultierenden Cyanid-Derivate flüchtig sind, sind Verarbeitungsmethoden, die eine solche Exposition auslösen, übliche traditionelle Methoden der Maniok-Zubereitung; Lebensmittel werden normalerweise nach längerem Blanchieren , Kochen oder Fermentieren aus Maniok hergestellt . Lebensmittel aus Maniok Pflanzen umfassen garri (getoastete Maniok Knollen ), breiigen Fufu , der Teig agbelima und Maniok Mehl .
Forschungsbemühungen haben eine transgene Maniokpflanze entwickelt , die die Linamarinproduktion durch RNA - Interferenz stabil herunterreguliert .
Verweise
- ^ a b c Shmuel Yannai: Dictionary of Food Compounds mit CD-ROM: Additives, Flavours, and Ingredients. CRC Press, 2003, ISBN 978-1-58488-416-3 , S. 695
- ^ Banea-Mayambu JP, Tylleskar T, Gitebo N, Matadi N, Gebre-Medhin M, Rosling H. (1997). Geografischer und saisonaler Zusammenhang zwischen Linamarin- und Zyanid-Exposition aus Maniok und der oberen Motoneuron-Krankheit Konzo im ehemaligen Zaire. Trop Med Int. Gesundheit 2(12):1143-51. PMID 9438470
- ^ Soto-Blanco B, Marioka PC, Gorniak SL. (2002). Auswirkungen einer langfristigen Verabreichung von niedrig dosiertem Cyanid an Ratten. Ecotoxicol Environ Saf 53(1):37-41. PMID 12481854
- ^ a b Soto-Blanco B, Sousa AB, Manzano H, Guerra JL, Gorniak SL. 2001. Hat eine längere Zyanid-Exposition eine diabetogene Wirkung?. Tierarzt Hum Toxicol. 43(2):106-8.
- ^ Yessoufou A, Ategbo JM, Girard A, Prost J, Dramane KL, Moutairou K, Hichami A, Khan NA. (2002). Eine mit Maniok angereicherte Ernährung ist nicht diabetogen, sondern verschlimmert den Diabetes bei Ratten. Fundam Clin Pharmacol 20(6):579-86. PMID 17109651
- ^ Padmaja G. (1995). Cyanid-Entgiftung in Maniok für Lebens- und Futtermittelzwecke. Crit Rev Food Sci Nutr 35(4):299-339. PMID 7576161
- ^ Siritunga D, Sayre R (2003). „Generation von cyanogenfreiem transgenem Maniok“. Planta 217 (3): 367-73. doi : 10.1007/s00425-003-1005-8 PMID 14520563
