METAP2 - METAP2
Methionin-Aminopeptidase 2 ist ein Enzym , das beim Menschen vom METAP2- Gen kodiert wird .
Methioninaminopeptidase 2, ein Mitglied der Dimetallohydrolase-Familie, ist ein zytosolisches Metalloenzym, das die hydrolytische Entfernung von N-terminalen Methioninresten aus naszierenden Proteinen katalysiert .
- Peptid-Methionin- Peptid + Methionin
MetAP2 kommt in allen Organismen vor und ist wegen seiner kritischen Rolle bei der Gewebereparatur und beim Proteinabbau besonders wichtig. Darüber hinaus ist MetAP2 von besonderem Interesse, da das Enzym eine Schlüsselrolle bei der Angiogenese spielt , dem Wachstum neuer Blutgefäße, das für das Fortschreiten von Krankheiten wie soliden Tumorkarzinomen und rheumatoider Arthritis notwendig ist . MetAP2 ist auch das Ziel von zwei Gruppen von antiangiogenen Naturstoffen, Ovalicin und Fumagillin , und ihren Analoga wie Beloranib .
Struktur
In lebende Organismen, der Start - Codon , dass Initiierte Proteinsynthese kodiert für entweder Methionin ( Eukaryoten ) oder Formylmethionin ( Prokaryoten ). In E. coli (Prokaryoten) kann ein Enzym namens Formylmethionin-Deformylase die Formylgruppe abspalten, sodass nur der N-terminale Methioninrest übrig bleibt. Bei Proteinen mit kleinen, ungeladenen vorletzten N-terminalen Resten kann eine Methioninaminopeptidase den Methioninrest spalten. Die Anzahl der Gene , die für eine Methionin-Aminopeptidase kodieren, variiert zwischen den Organismen. In E. coli gibt es nur ein bekanntes MetAP, ein monomeres Enzym mit 29.333 Da, das von einem Gen kodiert wird, das aus 264 Codons besteht . Der Knockout dieses Gens in E. coli führt zur Unlebensfähigkeit der Zelle. Beim Menschen gibt es zwei Gene, die MetAP kodieren, MetAP1 und MetAP2. MetAP1 kodiert für ein 42 kDa Enzym, während MetAP2 für ein 67 kDa Enzym kodiert. Hefe- MetAP1 ist zu 40 Prozent homolog zu E. coli MetAP; innerhalb von S. cerevisiae ist MetAP2 zu 22 Prozent homolog mit der Sequenz von MetAP1; MetAP2 ist zwischen S. cerevisiae und dem Menschen hochkonserviert . Im Gegensatz zu Prokaryonten sind eukaryotische S. cerevisiae-Stämme, denen das Gen für entweder MetAP1 oder MetAP2 fehlt, lebensfähig, zeigen jedoch eine langsamere Wachstumsrate als ein Kontrollstamm, der beide Gene exprimiert.
Aktive Seite
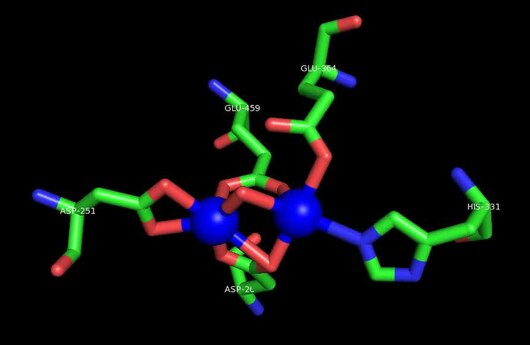
Das aktive Zentrum von MetAP2 hat ein Strukturmotiv, das für viele Metalloenzyme charakteristisch ist – einschließlich des Sauerstoffträgerproteins Hemerythrin ; das zweikernige Nicht-Häm-Eisenprotein, Ribonukleotidreduktase ; Leucin-Aminopeptidase ; Urease ; Arginase ; mehrere Phosphatasen und Phosphoesterasen -Das zwei verbrückenden umfasst Carboxylat - Liganden und einem verbrückenden Wasser oder Hydroxid - Liganden . Speziell in menschlichem MetAP2 (PDB: 1BOA) ist eines der katalytischen Metallionen an His331, Glu364, Glu459, Asp263 und ein verbrückendes Wasser oder Hydroxid gebunden, während das andere Metallion an Asp251 ( zweizähnig ), App262 (zweizähnig ), Glu459, und das gleiche Brückenwasser oder Hydroxid. Hier sind die beiden verbrückenden Carboxylate Asp262 und Glu459.
Dimetallzentrum
Die Identität der aktiven Stelle Metallionen unter physiologischen Bedingungen nicht erfolgreich etabliert und bleibt umstritten. MetAP2 zeigt Aktivität in Gegenwart von Zn(II), Co(II), Mn(II) und Fe(II)-Ionen, und verschiedene Autoren haben argumentiert, dass jedes gegebene Metallion das physiologische ist: einige in Gegenwart von Eisen , andere in Kobalt , andere in Mangan und noch andere in Gegenwart von Zink . Dennoch haben die meisten Kristallographen MetAP2 entweder in Gegenwart von Zn(II) oder Co(II) kristallisiert (siehe PDB-Datenbank).
Mechanismus
Der verbrückende Wasser- oder Hydroxidligand wirkt während der Hydrolysereaktion als Nukleophil, aber der genaue Mechanismus der Katalyse ist noch nicht bekannt. Die katalytischen Mechanismen von Hydrolase-Enzymen hängen stark von der Identität des verbrückenden Liganden ab, deren Bestimmung aufgrund der Schwierigkeit, Wasserstoffatome mittels Röntgenkristallographie zu untersuchen, schwierig sein kann .
Die im Mechanismus rechts gezeigten Histidinreste H178 und H79 sind in allen bisher sequenzierten MetAPs (MetAP1s und MetAP2s) konserviert, was darauf hindeutet, dass ihre Anwesenheit für die katalytische Aktivität wichtig ist. Basierend auf röntgenkristallographischen Daten wurde vorgeschlagen, dass Histidin 79 (H79) dabei hilft, den Methioninrest im aktiven Zentrum zu positionieren und ein Proton auf das neu exponierte N-terminale Amin zu übertragen. Lowther und Kollegen haben zwei mögliche Mechanismen für MetAP2 in E. coli vorgeschlagen, wie rechts gezeigt.
Funktion
Während frühere Studien gezeigt haben, dass MetAP2 die Entfernung von N-terminalen Methioninresten in vitro katalysiert, kann die Funktion dieses Enzyms in vivo komplexer sein. Zum Beispiel besteht eine signifikante Korrelation zwischen der Inhibierung der enzymatischen Aktivität von MetAP2 und Hemmung des Zellwachstums, wodurch das Enzyms in Verwicklung Endothelzellenproliferation . Aus diesem Grund haben Wissenschaftler MetAP2 als potenzielles Ziel für die Hemmung der Angiogenese herausgegriffen. Darüber hinaus haben Studien gezeigt, dass MetAP2 mit der α-Untereinheit des eukaryotischen Initiationsfaktors 2 ( eIF2 ), einem Protein, das für die Proteinsynthese in vivo notwendig ist , mitgereinigt und mit ihr interagiert . Insbesondere schützt MetAP2 eIF-2α vor der inhibitorischen Phosphorylierung durch das Enzym eIF-2α- Kinase , hemmt die RNA-abhängige Proteinkinase (PKR)-katalysierte eIF-2 R-Untereinheit-Phosphorylierung und kehrt auch die PKR-vermittelte Hemmung der Proteinsynthese in intakten Zellen um .
Klinische Bedeutung
Zahlreiche Studien implizieren MetAP2 in der Angiogenese. Insbesondere wird die kovalente Bindungs entweder der Ovalicin oder Fumagillin Epoxid hat Einheit an die aktive Stelle von Histidinrest MetAP2 gezeigt worden , um das Enzym zu inaktivieren, wodurch die Angiogenese gehemmt wird . Die Art und Weise, in der MetAP2 die Angiogenese reguliert, muss jedoch noch festgestellt werden, sodass weitere Studien erforderlich sind, um zu bestätigen, dass die antiangiogene Aktivität direkt aus der Hemmung von MetAP2 resultiert. Da jedoch sowohl das Wachstum als auch die Metastasierung solider Tumoren stark von der Angiogenese abhängen, stellen Fumagillin und seine Analoga – einschließlich TNP-470 , Caplostatin und Beloranib – sowie Ovalicin potenzielle Antikrebsmittel dar. Darüber hinaus hat die Fähigkeit von MetAP2, die Lebensfähigkeit von Zellen in prokaryontischen und kleinen eukaryontischen Organismen zu verringern, es zu einem Ziel für antibakterielle Mittel gemacht. Bisher wurde gezeigt, dass sowohl Fumagillin als auch TNP-470 sowohl in vitro als auch in vivo eine Antimalariaaktivität besitzen, und Fumaranol , ein weiteres Fumagillin-Analogon, stellt eine vielversprechende Leitlinie dar .
Der METAP2-Inhibitor Beloranib (ZGN-433) hat sich bei der Gewichtsreduktion bei stark adipösen Patienten als wirksam erwiesen. MetAP2-Hemmer wirken, indem sie das Gleichgewicht der Fettverstoffwechselung im Körper wiederherstellen, was zu einem erheblichen Gewichtsverlust führt. Die Entwicklung von Beloranib wurde 2016 nach Todesfällen während klinischer Studien gestoppt.
Interaktionen
Es wurde gezeigt, dass METAP2 mit Proteinkinase R interagiert .
Verweise
Weiterlesen
- Prigmore E, Ahmed S., Best A, Kozma R, Manser E, Segal AW, Lim L (Mai 1995). "Eine 68-kDa-Kinase- und NADPH-Oxidase-Komponente p67phox sind Ziele für Cdc42Hs und Rac1 in Neutrophilen" . J. Biol. Chem . 270 (18): 10717–22. doi : 10.1074/jbc.270.18.10717 . PMID 7738010 .
- Li X, Chang YH (Februar 1995). „Molekulare Klonierung einer menschlichen komplementären DNA, die ein Initiationsfaktor 2-assoziiertes Protein (p67) kodiert“. Biochim. Biophys. Akta . 1260 (3): 333–6. doi : 10.1016/0167-4781(94)00227-t . PMID 7873610 .
- Ray MK, Chakraborty A, Datta B, Chattopadhyay A, Saha D, Bose A, Kinzy TG, Wu S, Hileman RE, Merrick WC (Mai 1993). „Eigenschaften des eukaryotischen Initiationsfaktor 2 assoziierten 67-kDa-Polypeptids“. Biochemie . 32 (19): 5151-9. doi : 10.1021/bi00070a026 . PMID 8098621 .
- Liu S, Widom J, Kemp CW, Crews CM, Clardy J (November 1998). „Struktur der menschlichen Methionin-Aminopeptidase-2 mit Fumagillin komplexiert“. Wissenschaft . 282 (5392): 1324–7. Bibcode : 1998Sci...282.1324L . doi : 10.1126/science.282.5392.1324 . PMID 9812898 .
- Griffith EC, Su Z, Niwayama S, Ramsay CA, Chang YH, Liu JO (Dezember 1998). "Molekulare Erkennung von Angiogenese-Inhibitoren Fumagillin und Ovalicin durch Methionin-Aminopeptidase 2" . Proz. Nat. Akad. Wissenschaft USA . 95 (26): 15183–8. Bibcode : 1998PNAS...9515183G . doi : 10.1073/pnas.95.26.15183 . PMC 28017 . PMID 9860943 .
- Datta B, Datta R, Mukherjee S, Zhang Z (1999). „Erhöhte Phosphorylierung des eukaryotischen Initiationsfaktors 2alpha an der G2/M-Grenze in menschlichen Osteosarkomzellen korreliert mit der Deglykosylierung von p67 und einer verringerten Proteinsyntheserate“. Erw. Zellres . 250 (1): 223–30. doi : 10.1006/excr.1999.4508 . PMID 10388536 .
- Gil J, Esteban M, Roth D (2001). „In-vivo-Regulierung der dsRNA-abhängigen Proteinkinase PKR durch das zelluläre Glykoprotein p67“. Biochemie . 39 (51): 16016–25. doi : 10.1021/bi001754t . PMID 11123929 .
- Catalano A, Romano M, Robuffo I, Strizzi L, Procopio A (August 2001). "Methionin-Aminopeptidase-2 reguliert das Überleben von menschlichen Mesotheliomzellen: Rolle der Bcl-2-Expression und der Telomerase-Aktivität" . Bin. J. Pathol . 159 (2): 721–31. doi : 10.1016/S0002-9440(10)61743-9 . PMC 1850571 . PMID 11485930 .
- H. Endo, K. Takenaga, T. Kanno et al. (2002). „Methionin-Aminopeptidase 2 ist ein neues Ziel für das Metastasen-assoziierte Protein S100A4“ . J. Biol. Chem . 277 (29): 26396–402. doi : 10.1074/jbc.M202244200 . PMID 11994292 .
- T. Kanno, H. Endo, K. Takeuchi et al. (2002). "Hohe Expression von Methionin-Aminopeptidase Typ 2 in Keimzentrum B-Zellen und ihren neoplastischen Gegenstücken" . Labor. Investieren . 82 (7): 893–901. doi : 10.1097/01.LAB.0000020419.25365.C4 . PMID 12118091 .
- Datta R, Tammali R, Datta B (2003). „Negative Regulierung des Schutzes der eIF2alpha-Phosphorylierungsaktivität durch eine einzigartige saure Domäne am N-Terminus von p67“. Erw. Zellres . 283 (2): 237–46. doi : 10.1016/S0014-4827(02)00042-3 . PMID 12581743 .
- Serero A, Giglione C, Sardini A, Martinez-Sanz J, Meinnel T (Dezember 2003). „Eine ungewöhnliche Peptid-Deformylase weist im menschlichen mitochondrialen N-terminalen Methionin-Exzisionsweg auf“ . J. Biol. Chem . 278 (52): 52953–63. doi : 10.1074/jbc.M309770200 . PMID 14532271 .
- Selvakumar P, Lakshmikuttyamma A, Kanthan R, Kanthan SC, Dimmock JR, Sharma RK (April 2004). "Hohe Expression von Methionin-Aminopeptidase 2 in humanen kolorektalen Adenokarzinomen" . Klin. Krebsres . 10 (8): 2771–5. doi : 10.1158/1078-0432.CCR-03-0218 . PMID 15102683 .
- Kim S, LaMontagne K, Sabio M, Sharma S, Versace RW, Yusuff N, Phillips PE (Mai 2004). „Der Abbau von Methionin-Aminopeptidase 2 verändert die Zellreaktion auf Fumagillin oder Bengamide nicht“ . Krebsres . 64 (9): 2984–7. doi : 10.1158/0008-5472.CAN-04-0019 . PMID 15126329 .