Quecksilber(II)-cyanid - Mercury(II) cyanide
|
|
|
|
|
| Namen | |
|---|---|
|
IUPAC-Name
Dicyanquecksilber
|
|
| Andere Namen
Quecksilbercyanid; Cyanquecksilber; Quecksilbercyanid; Quecksilberdicyanid; hydrargyri cyanidum
|
|
| Identifikatoren | |
|
3D-Modell ( JSmol )
|
|
| ChemSpider | |
| ECHA-Infokarte |
100.008.857 |
|
PubChem- CID
|
|
| UNII | |
|
CompTox-Dashboard ( EPA )
|
|
|
|
|
|
| Eigenschaften | |
| Hg(CN) 2 | |
| Molmasse | 252,63 g/mol |
| Aussehen | farblose Kristalle oder weißes Pulver |
| Geruch | geruchlos |
| Dichte | 3,996 g / cm 3 |
| Schmelzpunkt | 320 °C (608 °F; 593 K) (zersetzt) |
| 9,3 g/100 ml (14 °C) 53,9 g/100 ml (100 °C) |
|
| Löslichkeit | 25 g/100 mL (Methanol, 19,5 °C) löslich in Ethanol , Ammoniak , Glycerin schwach löslich in Ether unlöslich in Benzol |
| −67,0·10 −6 cm 3 /mol | |
|
Brechungsindex ( n D )
|
1,645 |
| Gefahren | |
|
EU-Klassifizierung (DSD) (veraltet)
|
|
| NFPA 704 (Feuerdiamant) | |
| Letale Dosis oder Konzentration (LD, LC): | |
|
LD 50 ( mediane Dosis )
|
26 mg/kg |
|
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Infobox-Referenzen | |
Quecksilber (II) -cyanid , auch bekannt als Quecksilbercyanid , ist eine Verbindung von Quecksilber . Es ist ein geruchloses, giftiges weißes Pulver. Es ist in polaren Lösungsmitteln wie Wasser , Alkohol und Ammoniak gut löslich ; wenig löslich in Äther ; und unlöslich in Benzol und anderen hydrophoben Lösungsmitteln.
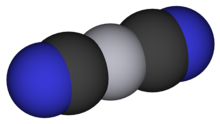
Molekül- und Kristallstruktur
Bei Umgebungstemperatur und Umgebungsdruck nimmt Hg(CN) 2 die Form von tetragonalen Kristallen an . Diese Kristalle bestehen aus nahezu linearen Hg(CN) 2 -Molekülen mit einem C-Hg-C- Bindungswinkel von 175,0° und einem Hg-CN-Bindungswinkel von 177,0° (Aylett gibt leicht unterschiedliche Werte von 189° bzw. 175° an) . Raman-Spektren zeigen, dass sich die Moleküle bei höheren Drücken verzerren. Zwischen 16-20 kbar durchläuft die Struktur einen Phasenübergang, wenn sich das Hg(II)-Zentrum von 2- auf 4- koordiniert ändert, da die CN- Gruppen über Hg-N-Bindungen an benachbarte Hg-Zentren binden. Die Koordinationsgeometrie ändert sich somit von tetragonal zu tetraedrisch und bildet eine kubische Kristallstruktur , analog der Struktur von Cd(CN) 2 . Aufgrund der ambidenten Natur der CN- Liganden ist diese tetraedrische Struktur verzerrt, aber die Verzerrung nimmt mit steigendem Druck ab, bis die Struktur bei >40 kbar nahezu perfekt tetraedrisch wird.
Wie im Festkörper sind die Hg(CN) 2 -Moleküle in wässriger Lösung linear.
Synthese
Quecksilbercyanid kann durch Mischen von gelbem Quecksilberoxid mit Blausäure in der folgenden chemischen Reaktion hergestellt werden, die im Allgemeinen durch Einleiten von HCN-Gas in HgO in Wasser durchgeführt wird. Wenn lösliches Hg(CN) 2 gebildet wird, wird die Lösung verdampft, um das Produkt zu kristallisieren .
- HgO + 2 HCN → Hg(CN) 2 + H 2 O
Hg(CN) 2 kann auch durch Mischen von HgO mit fein gepulvertem Preußischblau hergestellt werden . Darüber hinaus kann es durch Reaktion von Quecksilbersulfat mit Kaliumferrocyanid in Wasser hergestellt werden:
- K 4 Fe(CN) 6 + 3 HgSO 4 → 3 Hg(CN) 2 + 2 K 2 SO 4 + FeSO 4
Ein weiteres Verfahren zur Herstellung von Quecksilbercyanid ist die Disproportionierung von Quecksilber(I)-Derivaten. Bei diesen Reaktionen metallisches Quecksilber Ausfällungen und Hg (CN) 2 in Lösung bleibt:
- Hg 2 (NO 3 ) 2 + 2 KCN → Hg + Hg(CN) 2 + 2 KNO 3
Reaktionen
Es zersetzt sich in Säure schnell unter Bildung von Blausäure . Es ist lichtempfindlich und wird dunkler.
Quecksilbercyanid katalysiert die Koenigs-Knorr-Reaktion zur Synthese von Glycosiden . Cyanogen , (CN) 2 , bildet sich beim Erhitzen von trockenem Quecksilbercyanid, aber die Methode ist anderen Wegen unterlegen:
- Hg(CN) 2 → (CN) 2 + Hg
Koordinationspolymere können aus Hg(CN) 2 -Bausteinen synthetisiert werden. Große Einkristalle von [(tmeda)Cu-[Hg(CN) 2 ] 2 ][HgCl 4 ] bilden sich bei der Behandlung von CuCl 2 , der weichen Lewis-Säure Hg(CN) 2 und N,N,N',N'- Tetramethylethylendiamin (TMEDA) . Die Migration zweier labiler Chloridliganden vom härteren Cu(II) zum weicheren Hg(II) treibt die Kristallbildung an.
Vergangene Bewerbungen
Die Verwendung von Quecksilbercyanid als Antiseptikum wurde aufgrund seiner Toxizität eingestellt. Hg(CN) 2 wird auch in der Fotografie verwendet . In der Homöopathie wird es noch immer unter dem lateinischen Namen Hydrargyrum bicyanatum verwendet .
Toxikologie
Quecksilber(II)cyanid ist ein Gift der Gesundheitsgefährdungsklasse 3 mit einer oralen LD50 von 33 Milligramm pro Kilogramm bei Mäusen und einer subkutanen LD50 von 2,7 Milligramm pro Kilogramm bei Hunden.
Verweise
- ^ a b "Hydrargyrum. Merkur. Teil 5." http://chestofbooks.com/health/materia-medica-drugs/Manual-Pharmacology/Hydrargyrum-Mercury-Part-5.html (Zugriff am 1. April 2009).
- ^ a b c d e Aylett, BJ "Quecksilber (II) Pseudohalogenide: Cyanid, Thiocyanat, Selenocyanat, Azid, Fulminat." Umfassende anorganische Chemie 3:304-306. JC Bailar, Harry Julius Emeléus , Sir Ronald Nyholm und AF Trotman-Dickenson, hrsg. Oxford: Pergamon-Presse, 1973 ; verteilt von Compendium Publishers (Elmsford, NY), p. 304.
- ^ a b c d Kocovsky, P., G. Wang und V. Sharma. "Quecksilber (II) Cyanid." e-EROS Enzyklopädie der Reagenzien für die organische Synthese. Chichester, Großbritannien: John Wiley & Sons, Ltd., 2001 . http://www.mrw.interscience.wiley.com/eros/articles/rm034/sect0-fs.html
- ^ "Quecksilbercyanid | CAMEO Chemikalien | NOAA" .
- ^ Wong, PTT J.Chem. Phys. 1984 , 80(12), 5937–41.
- ^ a b c Miller, WL Elemente der Chemie: Organische Chemie, 5. Aufl. New York: John Wiley & Sons, 1880 , p. 100.
- ^ Brunton, LT Ein Lehrbuch für Pharmakologie, Therapeutika und Materia Medica. London: MacMillan & Co., 1885 .
- ^ Brotherton, TK; Lynn, JW Chemical Reviews 1959 , 59(5), 841-883, 844-846.
- ^ Tuchmacher, Neil D.; Batchelor, Raymond J.; Sih, Bryan C.; Ja, Zuo-Guang; Leznoff, Daniel B. (2003). „Synthese, Struktur und Eigenschaften von [(tmeda)Cu[Hg(CN)2]2][HgCl4]: Ein nicht zentrosymmetrisches 2-D-Schichtsystem, das starke optische Anisotropie zeigt“. Chemie der Materialien . 15 (8): 1612–1616. doi : 10.1021/cm021716r .
- ^ Benaissa, ML; Hantson, P.; Wismut, C.; Baud, FJ Intensivmedizin Med. 1995 , 21 (12), 1051–1053.
- ^ "Zyanide, Cyanidoxide und komplexe Cyanide." http://www.dncustoms.gov.vn/web_eglish/bieu_thue/E_HTM/E2837.HTM (Zugriff am 30. April 2009).
- ^ Pubchem. "Quecksilbercyanid" . pubchem.ncbi.nlm.nih.gov . Abgerufen 2018-03-22 .

