Zinn(II)-oxid - Tin(II) oxide
|
|

|
|

|
|
| Namen | |
|---|---|
|
IUPAC-Name
Zinn(II)-oxid
|
|
| Andere Namen
Zinn(II)-oxid, Zinnmonoxid
|
|
| Identifikatoren | |
|
3D-Modell ( JSmol )
|
|
| ECHA-Infokarte |
100.040.439 |
| EG-Nummer | |
|
PubChem- CID
|
|
| RTECS-Nummer | |
| UNII | |
|
CompTox-Dashboard ( EPA )
|
|
|
|
|
|
| Eigenschaften | |
| SnO | |
| Molmasse | 134,709 g/mol |
| Aussehen | schwarzes oder rotes Pulver, wenn es wasserfrei ist, weißes, wenn es hydratisiert ist |
| Dichte | 6,45 g / cm 3 |
| Schmelzpunkt | 1.080 °C (1.980 °F; 1.350 K) |
| unlöslich | |
| −19,0·10 −6 cm 3 /mol | |
| Struktur | |
| tetragonal | |
| Thermochemie | |
|
Std molare
Entropie ( S |
56 J·mol −1 ·K −1 |
|
Std
Bildungsenthalpie (Δ f H ⦵ 298 ) |
−285 kJ·mol −1 |
| Gefahren | |
| Sicherheitsdatenblatt | ICSC 0956 |
| Flammpunkt | Nicht brennbar |
| NIOSH (US-Grenzwerte für die Gesundheitsbelastung): | |
|
PEL (zulässig)
|
keiner |
|
REL (empfohlen)
|
TWA 2 mg/m 3 |
|
IDLH (unmittelbare Gefahr)
|
ND |
| Verwandte Verbindungen | |
|
Andere Anionen
|
Zinnsulfid Zinn - Selenid Zinntellurid |
|
Andere Kationen
|
Kohlenmonoxid Siliziummonoxid Germanium(II)-oxid Blei(II)-oxid |
| Zinndioxid | |
|
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Infobox-Referenzen | |
Zinn(II)-oxid ( Zinn (II)-oxid ) ist eine Verbindung mit der Formel SnO. Es besteht aus Zinn und Sauerstoff, wobei Zinn die Oxidationsstufe +2 hat. Es gibt zwei Formen, eine stabile blau-schwarze Form und eine metastabile rote Form.
Vorbereitung und Reaktionen
Blauschwarzes SnO kann durch Erhitzen des Zinn(II)-Oxidhydrats erzeugt werden, SnO·xH 2 O (x < 1) wird ausgefällt, wenn ein Zinn(II)-Salz mit einem Alkalihydroxid wie NaOH umgesetzt wird.
Metastabiles, rotes SnO kann durch leichtes Erhitzen des durch die Einwirkung von wässrigem Ammoniak auf ein Zinn(II)-Salz entstandenen Niederschlags hergestellt werden.
SnO kann als Reinsubstanz im Labor durch kontrolliertes Erhitzen von Zinn(II)-oxalat ( Zinnoxalat ) unter Luftabschluss oder unter CO 2 -Atmosphäre hergestellt werden. Dieses Verfahren wird auch bei der Herstellung von Eisenoxid und Manganoxid angewendet .
- SnC 2 O 4 ·2H 2 O → SnO + CO 2 + CO + 2 H 2 O
Zinn(II)-oxid verbrennt an Luft mit schwach grüner Flamme zu SnO 2 .
- 2 SnO + O 2 → 2 SnO 2
Beim Erhitzen in einer inerten Atmosphäre tritt zunächst eine Disproportionierung auf, die Sn-Metall und Sn 3 O 4 ergibt, das weiter reagiert, um SnO 2 und Sn-Metall zu ergeben.
- 4SnO → Sn 3 O 4 + Sn
- Sn 3 O 4 → 2SnO 2 + Sn
SnO ist amphoter , löst sich in starker Säure zu Zinn(II)-Salzen und in starker Base zu Stanniten mit Sn(OH) 3 − . Es kann in starken Säurelösungen aufgelöst werden , um den ionischen Komplexe Sn (OH ergeben 2 ) 3 2+ und Sn (OH) (OH 2 ) 2 + , und in weniger sauren Lösungen geben Sn 3 (OH) 4 2+ . Beachten Sie, dass auch wasserfreie Stannite, zB K 2 Sn 2 O 3 , K 2 SnO 2 bekannt sind. SnO ist ein Reduktionsmittel und soll Kupfer(I) bei der Herstellung von sogenanntem "Kupfer-Rubin-Glas" zu metallischen Clustern reduzieren.
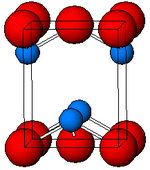
Struktur
Schwarz, α-SnO nimmt die tetragonale PbO- Schichtstruktur an, die vier koordinierte quadratisch-pyramidale Zinnatome enthält. Diese Form kommt in der Natur als seltenes Mineral Romarchit vor . Die Asymmetrie wird normalerweise einfach einem sterisch aktiven einsamen Paar zugeschrieben; Berechnungen der Elektronendichte zeigen jedoch, dass die Asymmetrie durch eine antibindende Wechselwirkung der Sn(5s)- und der O(2p)-Orbitale verursacht wird. Die elektronische Struktur und Chemie des freien Elektronenpaares bestimmt die meisten Eigenschaften des Materials.
Bei SnO wurde eine Nichtstöchiometrie beobachtet.
Die elektronische Bandlücke wurde zwischen 2,5 eV und 3 eV gemessen.
Verwendet
Die vorherrschende Verwendung von Zinn(II)-oxid ist als Vorläufer bei der Herstellung anderer, typischerweise zweiwertiger Zinnverbindungen oder Salze. Zinnoxid kann auch als Reduktionsmittel und bei der Herstellung von Rubinglas verwendet werden . Es hat eine untergeordnete Verwendung als Veresterungskatalysator .
Cer(III)-Oxid in keramischer Form wird zusammen mit Zinn(II)-Oxid (SnO) zur Beleuchtung mit UV-Licht verwendet.

