ATP7A - ATP7A
ATP7A , auch bekannt als Menkes-Protein ( MNK ), ist eine kupfertransportierende ATPase vom P-Typ, die die bei der ATP-Hydrolyse entstehende Energie nutzt , um Cu(I) durch Zellmembranen zu transportieren. Das ATP7A-Protein ist ein Transmembranprotein und wird im Darm und allen Geweben außer der Leber exprimiert. Im Darm reguliert ATP7A die Cu(I)-Resorption im menschlichen Körper, indem es Cu(I) aus dem Dünndarm ins Blut transportiert. In anderen Geweben pendelt ATP7A zwischen dem Golgi-Apparat und der Zellmembran, um die richtigen Cu(I)-Konzentrationen aufrechtzuerhalten (da kein freies Cu(I) in der Zelle vorhanden ist, sind alle Cu(I)-Ionen fest gebunden) in der Zelle und versorgt bestimmte Enzyme mit Cu(I) (zB Peptidyl-α-monooxygenase , Tyrosinase und Lysyloxidase ). Die X-chromosomal vererbte, tödliche genetische Störung des ATP7A- Gens verursacht die Menkes-Krankheit , einen Kupfermangel, der zum Tod im frühen Kindesalter führt.
Gen
Das ATP7A- Gen befindet sich auf dem langen (q) Arm des X-Chromosoms in der Bande Xq21.1. Das kodierte ATP7A-Protein hat 1.500 Aminosäuren. Mutationen/Additionen/Deletionen dieses Gens verursachen häufig einen Kupfermangel, der bei Kindern zu fortschreitender Neurodegeneration und zum Tod führt.
Struktur
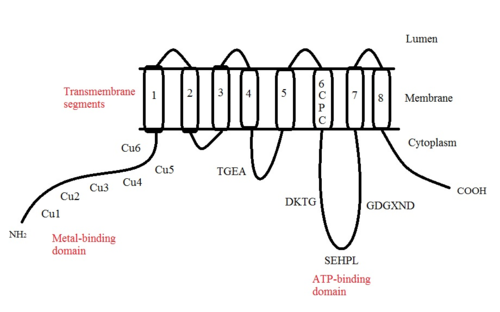
ATP7A ist ein Transmembranprotein, dessen N- und C-Termini beide zum Zytosol hin ausgerichtet sind (siehe Bild). Es ist hochgradig homolog zum Protein ATP7B . ATP7A enthält drei Hauptfunktionsdomänen:
- Acht Transmembransegmente , die einen Kanal bilden und Cu(I) durch die Membran passieren lassen;
- Eine ATP-bindende Domäne;
- Eine große N-terminale zytosolische Domäne, die sechs sich wiederholende Cu(I)-Bindungsstellen enthält, von denen jede ein GMTCXXC-Motiv enthält.
Viele Motive in der ATP7A-Struktur sind konserviert:
- Das TGEA-Motiv liegt im Loop auf der zytosolischen Seite zwischen den Transmembransegmenten 4 und 5 und ist am Energietransfer beteiligt.
- Das CPC-Motiv, das sich im Transmembransegment 6 befindet, ist allen Schwermetall-transportierenden ATPasen gemeinsam.
Zwischen den Transmembransegmenten 6 und 7 befindet sich eine große zytoplasmatische Schleife, in der sich drei Motive befinden: DKTG, SEHPL und GDGXND.
- Das DKTG-Motiv ist für die richtige Funktion der ATPase essentiell. Der Asparaginsäure (D)-Rest wird während der Transportzyklen phosphoryliert .
- Das SEHPL-Motiv existiert nur in Schwermetall-transportierenden P-Typ-ATPasen. Ohne den Histidin (H)-Rest kann ATP7A möglicherweise nicht richtig funktionieren.
- Es wird angenommen, dass das GDGXND-Motiv in der Nähe des Transmembransegments 7 hauptsächlich α-Helices enthält und als struktureller Träger dient.
Die sechs Cu(I)-Bindungsstellen am N-Terminus binden jeweils ein Cu(I). Diese Bindungsstelle ist für Cu(I) nicht spezifisch und kann verschiedene Übergangsmetallionen binden. Cd(II), Au(III) und Hg(II) binden fester an die Bindungsstelle als Zn(II), während Mn(II) und Ni(II) im Vergleich zu Zn(II) geringere Affinitäten aufweisen. Im Fall von Cu(I) wird ein möglicher kooperativer Bindungsmechanismus beobachtet. Wenn die Cu(I)-Konzentration niedrig ist, hat Cu(I) eine geringere Affinität für ATP7A im Vergleich zu Zn(II); mit steigender Cu(I)-Konzentration wird eine dramatisch ansteigende Affinität von Cu(I) für das Protein beobachtet.
Konformationsänderung
Die beiden Cystein (C)-Reste in jeder Cu(I)-Bindungsstelle sind an Cu(I) mit einem S-Cu(I)-S-Winkel zwischen 120 und 180° und einem Cu-S-Abstand von 2.16 koordiniert. Experimentelle Ergebnisse eines homologen Proteins ATP7B legen nahe, dass reduzierende Reagenzien beteiligt sind, und bei der Bindung von Cu(I) wird die Disulfidbindung zwischen den Cysteinresten unterbrochen, da Cystein beginnt, an Cu(I) zu binden, was zu einer Reihe von Konformationsänderungen an der N-terminal des Proteins und möglicherweise die Aktivierung der Cu(I)-transportierenden Aktivität anderer zytosolischer Schleifen.
Von den sechs Kupfer(I)-Bindungsstellen werden zwei als ausreichend für die Funktion des Cu(I)-Transports angesehen. Der Grund, warum es sechs Bindungsstellen gibt, ist noch nicht vollständig verstanden. Einige Wissenschaftler haben jedoch vorgeschlagen, dass die anderen vier Stellen als Cu(I)-Konzentrationsdetektor dienen könnten.
Transportmechanismus
ATP7A gehört zu einer Transporterfamilie genannt P-Typ - ATPasen , die auto- katalysieren die Phosphorylierung eines Schlüssels konservierten Asparaginsäure innerhalb des Enzyms (D) -Rest. Der erste Schritt ist die ATP-Bindung an die ATP-Bindungsdomäne und die Cu(I)-Bindung an die Transmembranregion. Dann wird ATP7A am Schlüsselrest der Asparaginsäure (D) im hochkonservierten DKTG-Motiv phosphoryliert, begleitet von einer Cu(I)-Freisetzung. Eine anschließende Dephosphorylierung des Intermediats beendet den Katalysezyklus. Innerhalb jedes Zyklus wandelt sich ATP7A zwischen mindestens zwei verschiedenen Konformationen, E1 und E2, um. Im E1-Zustand ist Cu(I) fest an die Bindungsstellen auf der zytoplasmatischen Seite gebunden; im E2-Zustand nimmt die Affinität von ATP7A für Cu(I) ab und Cu(I) wird auf der extrazellulären Seite freigesetzt.
Funktion
ATP7A ist wichtig für die Regulierung von Kupfer Cu(I) in Säugetieren. Dieses Protein kommt in den meisten Geweben vor, wird jedoch nicht in der Leber exprimiert. Im Dünndarm hilft das Protein ATP7A, die Aufnahme von Cu(I) aus der Nahrung zu kontrollieren. Nachdem Cu(I)-Ionen in Enterozyten absorbiert wurden , wird ATP7A benötigt, um sie über die basolaterale Membran in den Kreislauf zu überführen.
In anderen Organen und Geweben hat das ATP7A-Protein eine Doppelfunktion und pendelt zwischen zwei Orten innerhalb der Zelle. Das Protein befindet sich normalerweise in einer Zellstruktur namens Golgi-Apparat , die neu produzierte Enzyme und andere Proteine modifiziert und transportiert. Hier liefert ATP7A Cu(I) an bestimmte Enzyme (zB Peptidyl-α-Monooxygenase , Tyrosinase und Lysyloxidase ), die für die Strukturen und Funktionen von Gehirn, Knochen, Haut, Haar, Bindegewebe und Nervensystem entscheidend sind. Wenn der Cu(I)-Spiegel in der Zellumgebung jedoch erhöht ist, wandert ATP7A zur Zellmembran und eliminiert überschüssiges Cu(I) aus der Zelle.
Die Funktionen von ATP7A in einigen Geweben des menschlichen Körpers sind wie folgt:
| Gewebe | Ort | Funktion |
|---|---|---|
| Niere | Exprimiert in Epithelzellen der proximalen und distalen Nierentubuli | Entfernt überschüssiges Cu(I), um den Cu(I)-Spiegel in der Niere aufrechtzuerhalten |
| Parenchym | Im Cytotrophoblasten , Synzytiotrophoblasten und fetalen Gefäß endothelialen Zellen | Liefert Cu(I) an plazentare Cuproenzyme und transportiert Cu(I) in den fetalen Kreislauf |
| Zentrales Nervensystem | Verschiedene Orte | Verteilt Cu(I) in den verschiedenen Kompartimenten des Zentralnervensystems |
Interaktionen
Es wurde gezeigt, dass ATP7A mit ATOX1 und GLRX interagiert . Antioxidans 1 Kupfer-Chaperon (ATOX1) wird benötigt, um die Cu(I)-Kupfer-Homöostase in der Zelle aufrechtzuerhalten. Es kann zytosolisches Cu(I) an ATP7A im trans-Golgi-Netzwerk binden und transportieren. Glutaredoxin-1 (GRX1) ist auch für die ATP7A-Funktion essentiell. Es fördert die Cu(I)-Bindung für den nachfolgenden Transport, indem es die Reduktion von Disulfidbrücken katalysiert. Es kann auch de- katalysieren Glutathionylierung Reaktion der C (Cystein) Reste innerhalb der sechs Cu (I) -Bindung Motive GMTCXXC.
Klinische Bedeutung
Die Menkes-Krankheit wird durch Mutationen im ATP7A-Gen verursacht. Forscher haben verschiedene ATP7A-Mutationen identifiziert, die die Menkes-Krankheit und das Hinterhauptshorn-Syndrom (OHS), die mildere Form der Menkes-Krankheit, verursachen. Viele dieser Mutationen löschen einen Teil des Gens und es wird vorhergesagt, dass sie ein verkürztes ATP7A-Protein produzieren, das Cu(I) nicht transportieren kann. Andere Mutationen fügen zusätzliche DNA-Basenpaare ein oder verwenden die falschen Basenpaare, was zu ATP7A-Proteinen führt, die nicht richtig funktionieren.
Die veränderten Proteine, die aus ATP7A-Mutationen resultieren, beeinträchtigen die Aufnahme von Kupfer aus der Nahrung, liefern kein Kupfer an bestimmte Enzyme oder bleiben in der Zellmembran stecken und können nicht vom Golgi hin und her pendeln. Aufgrund der gestörten Aktivität des ATP7A-Proteins wird Kupfer schlecht an die Körperzellen verteilt. Kupfer sammelt sich in einigen Geweben wie dem Dünndarm und den Nieren an, während das Gehirn und andere Gewebe ungewöhnlich niedrige Werte aufweisen. Die verminderte Kupferzufuhr kann die Aktivität zahlreicher kupferhaltiger Enzyme reduzieren, die für den Aufbau und die Funktion von Knochen, Haut, Haaren, Blutgefäßen und dem Nervensystem notwendig sind. Kupfer ist auch entscheidend für die Ausbreitung von Prionen - Proteine und Mäuse mit Mutationen in ATP7A haben von Prion - Krankheit ein verzögertes Einsetzen. Eine umfassende Ressource klinisch kommentierter genetischer Varianten im ATP7A-Gen wurde zur Verfügung gestellt, um die Richtlinien des American College of Medical Genetics and Genomics für die Interpretation von Sequenzvarianten zu bestätigen.
Hemmung
Ein Protonenpumpenhemmer, Omeprazol, blockiert nachweislich ATP7A, zusätzlich zu seiner etablierteren Rolle, ATP4A zu blockieren.
Verweise
Weiterlesen
- Barnes N., Tsivkovskii R, Tsivkovskaia N, Lutsenko S (2005). "Die kupfertransportierenden ATPasen, Menkes- und Wilson-Krankheitsproteine haben unterschiedliche Rollen im erwachsenen und sich entwickelnden Kleinhirn" . J. Biol. Chem . . 280 (10): 9640–5. doi : 10.1074/jbc.M413840200 . PMID 15634671 .
- Greenough M, Pase L, Voskoboinik I, Petris MJ, O'Brien AW, Camakaris J (2004). „Signale, die den Handel von Menkes (MNK; ATP7A) kupfertranslozierender P-Typ-ATPase in polarisierten MDCK-Zellen regulieren“. Am J Physiol Cell Physiol . 287 (5): C1463–71. doi : 10.1152/ajpcell.00179.2004 . PMID 15269005 .
- Møller LB, Tümer Z, Lund C, Petersen C, Cole T, Hanusch R, Seidel J, Jensen LR, Horn N (2000). „Ähnliche Mutationen an der Spleißstelle des ATP7A-Gens führen zu unterschiedlichen Phänotypen: klassischer Menkes-Krankheit oder Hinterhauptshorn-Syndrom“ . Bin J Hum Genet . 66 (4): 1211–20. doi : 10.1086/302857 . PMC 1288188 . PMID 10739752 .
- Voskoboinik I, Camakaris J (2002). „Menkes Kupfer-translozierende P-Typ-ATPase (ATP7A): biochemische und zellbiologische Eigenschaften und Rolle bei der Menkes-Krankheit“. J Bioenerg Biomembr . 34 (5): 363–71. doi : 10.1023/A:10212500003104 . PMID 12539963 . S2CID 23109512 .
- Harris ED, Reddy MC, Qian Y, Tiffany-Castiglioni E, Majumdar S, Nelson J (1999). „Mehrere Formen der Menkes Cu-ATPase“. Kupfertransport und seine Störungen . Erw. Erw. Med. Biol . Fortschritte in der experimentellen Medizin und Biologie. 448 . S. 39–51. doi : 10.1007/978-1-4615-4859-1_4 . ISBN 978-1-4613-7204-2. PMID 10079814 .
- Cox DW, Moore SD (2003). „Kupfer, der P-Typ-ATPasen und Krankheiten des Menschen transportiert“. J. Bioenerg. Biomembr . 34 (5): 333–8. doi : 10.1023/A:1021293818125 . PMID 12539960 . S2CID 21471699 .
- Voskoboinik I, Camakaris J (2003). „Menkes Kupfer-translozierende P-Typ-ATPase (ATP7A): biochemische und zellbiologische Eigenschaften und Rolle bei der Menkes-Krankheit“. J. Bioenerg. Biomembr . 34 (5): 363–71. doi : 10.1023/A:10212500003104 . PMID 12539963 . S2CID 23109512 .
- La Fontaine S, Mercer JF (2007). „Trafficking der Kupfer-ATPasen, ATP7A und ATP7B: Rolle in der Kupferhomöostase“. Bogen. Biochem. Biophys . 463 (2): 149–67. doi : 10.1016/j.abb.2007.04.021 . PMID 17531189 .
- Lutsenko S, LeShane ES, Shinde U (2007). "Biochemische Grundlagen der Regulation von humanen Kupfer-transportierenden ATPasen" . Bogen. Biochem. Biophys . 463 (2): 134–48. doi : 10.1016/j.abb.2007.04.013 . PMC 2025638 . PMID 17562324 .
- Dierick HA, Ambrosini L, Spencer J, Glover TW, Mercer JF (1996). „Molekulare Struktur des Menkes-Krankheit-Gens (ATP7A)“. Genomik . 28 (3): 462–9. doi : 10.1006/geno.1995.1175 . PMID 7490081 .
- Tümer Z, Vural B, Tønnesen T, Chelly J, Monaco AP, Horn N (1995). „Charakterisierung der Exon-Struktur des Menkes-Krankheit-Gens mit Vectorette-PCR“. Genomik . 26 (3): 437–42. doi : 10.1016/0888-7543(95)80160-N . PMID 7607665 .
- Kaler SG, Gallo LK, Proud VK, Percy AK, Mark Y, Segal NA, Goldstein DS, Holmes CS, Gahl WA (1995). „Occipital-Horn-Syndrom und ein milder Menkes-Phänotyp im Zusammenhang mit Mutationen an der Spleißstelle am MNK-Locus“. Nat. Genet . 8 (2): 195–202. doi : 10.1038/ng1094-195 . PMID 7842019 . S2CID 12122103 .
- S. Das, B. Levinson, S. Whitney, C. Vulpe, S. Packman, J. Gitschier (1994). „Diverse Mutationen bei Patienten mit Menkes-Krankheit führen oft zum Exon-Skipping“ . Bin. J. Hum. Genet . 55 (5): 883–9. PMC 1918324 . PMID 7977350 .
- Chelly J, Tümer Z, Tønnesen T, Petterson A, Ishikawa-Brush Y, Tommerup N, Horn N, Monaco AP (1993). „Isolierung eines Kandidatengens für die Menkes-Krankheit, das ein potenzielles Schwermetall-bindendes Protein kodiert“. Nat. Genet . 3 (1): 14–9. doi : 10.1038/ng0193-14 . PMID 8490646 . S2CID 205341350 .
- Mercer JF, Livingston J, Hall B, Paynter JA, Begy C, Chandrasekharappa S, Lockhart P, Grimes A, Bhave M, Siemieniak D (1993). „Isolation eines partiellen Kandidatengens für die Menkes-Krankheit durch positionelles Klonen“. Nat. Genet . 3 (1): 20–5. doi : 10.1038/ng0193-20 . PMID 8490647 . S2CID 9148871 .
- Vulpe C, Levinson B, Whitney S, Packman S, Gitschier J (1993). „Isolierung eines Kandidatengens für die Menkes-Krankheit und Nachweis, dass es eine kupfertransportierende ATPase kodiert“. Nat. Genet . 3 (1): 7–13. doi : 10.1038/ng0193-7 . PMID 8490659 . S2CID 24883244 .
- Levinson B, Conant R, Schnur R, Das S, Packman S, Gitschier J (1997). "Ein wiederholtes Element in der regulatorischen Region des MNK-Gens und dessen Deletion bei einem Patienten mit Hinterhauptshorn-Syndrom" . Summen. Mol.-Nr. Genet . 5 (11): 1737–42. doi : 10.1093/hmg/5.11.1737 . PMID 8923001 .
- Yamaguchi Y, Heiny ME, Suzuki M, Gitlin JD (1997). "Biochemische Charakterisierung und intrazelluläre Lokalisation des Proteins der Menkes-Krankheit" . Proz. Natl. Akad. Wissenschaft USA . 93 (24): 14030–5. doi : 10.1073/pnas.93.24.14030 . PMC 19489 . PMID 8943055 .
- Petris MJ, Mercer JF, Culvenor JG, Lockhart P, Gleeson PA, Camakaris J (1997). „Ligandenregulierter Transport der Menkes-Kupfer-P-Typ-ATPase-Effluxpumpe vom Golgi-Apparat zur Plasmamembran: ein neuartiger Mechanismus des regulierten Handels“ . EMBO J . 15 (22): 6084–95. doi : 10.1002/j.1460-2075.1996.tb00997.x . PMC 452430 . PMID 8947031 .
- Tümer Z, Lund C, Tolshave J, Vural B, Tønnesen T, Horn N (1997). „Identifizierung von Punktmutationen bei 41 nicht verwandten Patienten mit Menkes-Krankheit“ . Bin. J. Hum. Genet . 60 (1): 63–71. PMC 1712537 . PMID 8981948 .
- Dierick HA, Adam AN, Escara-Wilke JF, Glover TW (1997). "Immunocytochemische Lokalisierung des Menkes Kupfertransportproteins (ATP7A) zum Trans-Golgi-Netzwerk" . Summen. Mol.-Nr. Genet . 6 (3): 409–16. doi : 10.1093/hmg/6.3.409 . PMC 7185191 . PMID 9147644 .
- Ronce N., Moizard MP, Robb L, Toutain A, Villard L, Moraine C (1997). "Ein C2055T-Übergang in Exon 8 des ATP7A-Gens ist mit Exon-Skipping in einer Familie des okzipitalen Hornsyndroms verbunden" . Bin. J. Hum. Genet . 61 (1): 233–8. doi : 10.1016/S0002-9297(07)64297-9 . PMC 1715861 . PMID 9246006 .
- Gitschier J, Moffat B, Reilly D, Wood WI, Fairbrother WJ (1998). „Lösungsstruktur der vierten Metallbindungsdomäne aus der Menkes-Kupfer-transportierenden ATPase“. Nat. Struktur. Biol . 5 (1): 47–54. doi : 10.1038/nsb0198-47 . PMID 9437429 . S2CID 172550 .
Externe Links
- ATP7A+protein,+human in der US National Library of Medicine Medical Subject Headings (MeSH)
- GeneReviews/NCBI/NIH/UW-Eintrag zu ATP7A-bedingten Kupfertransportstörungen umfasst: Menkes-Krankheit, okzipitales Hornsyndrom, ATP7A-bedingte distale motorische Neuropathie
- OMIM-Einträge zu ATP7A-bezogenen Kupfertransportstörungen
- GeneCard
- Standort des menschlichen ATP7A- Genoms und Seite mit Details zum ATP7A- Gen im UCSC-Genom-Browser .