Agouti-Signalprotein - Agouti-signaling protein
Das Agouti-Signalprotein ist ein Protein , das beim Menschen vom ASIP- Gen kodiert wird . Es ist für die Verteilung des Melaninpigments bei Säugetieren verantwortlich. Agouti interagiert mit dem Melanocortin-1-Rezeptor , um zu bestimmen, ob der Melanozyten (Pigmentzelle) Phäomelanin (ein rotes bis gelbes Pigment) oder Eumelanin (ein braunes bis schwarzes Pigment) produziert. Diese Interaktion ist dafür verantwortlich, dass in den Haaren von Tieren wie dem Agouti , nach dem das Gen benannt ist, unterschiedliche helle und dunkle Streifen entstehen . Bei anderen Arten wie Pferden ist die Agouti-Signalgebung dafür verantwortlich, zu bestimmen, welche Körperteile rot oder schwarz sind. Mäuse mit Wildtyp-Aguti sind grau , wobei jedes Haar teilweise gelb und teilweise schwarz ist. Funktionsverlust-Mutationen bei Mäusen und anderen Arten verursachen eine schwarze Fellfärbung, während Mutationen, die bei Mäusen eine Expression im ganzen Körper bewirken, zu gelbem Fell und Fettleibigkeit führen.
Das Agouti-Signalprotein (ASIP) ist ein kompetitiver Antagonist mit dem Alpha-Melanozyten-stimulierenden Hormon (α-MSH), um an Melanocortin-1-Rezeptor- (MC1R) -Proteine zu binden . Die Aktivierung durch α-MSH bewirkt die Produktion des dunkleren Eumelanins, während die Aktivierung durch ASIP die Produktion des röteren Phäomelanins bewirkt. Das bedeutet, wo und während Aguti ausgedrückt wird, wird der Teil des Haares, der wächst, eher gelb als schwarz herauskommen.
Funktion
Bei Mäusen kodiert das Agouti-Gen ein parakrines Signalmolekül, das Haarfollikel- Melanozyten veranlasst , das gelbe Pigment Phäomelanin anstelle des schwarzen oder braunen Pigments Eumelanin zu synthetisieren . Pleiotropen Wirkungen von konstitutiver Expression des Maus - Gens sind im Erwachsenenalter Übergewicht , erhöhte Tumoranfälligkeit und vorzeitige Unfruchtbarkeit. Dieses Gen ist dem Maus-Gen sehr ähnlich und kodiert ein sezerniertes Protein, das (1) die Qualität der Haarpigmentierung beeinflussen kann , (2) als inverser Agonist des Alpha-Melanozyten-stimulierenden Hormons wirkt , (3) eine Rolle bei neuroendokrinen . spielen Aspekte der Melanocortin- Wirkung und (4) spielen eine funktionelle Rolle bei der Regulierung des Lipidstoffwechsels in Adipozyten .
Bei Mäusen weist das Wildtyp- Aguti- Allel (A) einen grauen Phänotyp auf, jedoch wurden durch genetische Analysen viele Allelvarianten identifiziert, die zu einer breiten Palette von Phänotypen führen, die sich vom typischen grauen Fell unterscheiden. Die am häufigsten untersuchten Allelvarianten sind die letale gelbe Mutation (A y ) und die lebensfähige gelbe Mutation (A vy ), die durch ektopische Expression von Agouti verursacht werden . Diese Mutationen sind auch mit dem Yellow Adipositas-Syndrom verbunden, das durch früh einsetzende Fettleibigkeit , Hyperinsulinämie und Tumorentstehung gekennzeichnet ist . Der Agouti -Genlocus der Maus befindet sich auf Chromosom 2 und kodiert für ein Protein mit 131 Aminosäuren. Dieses Protein signalisiert die Verteilung von Melaninpigmenten in epithelialen Melanozyten, die sich an der Basis der Haarfollikel befinden, wobei die Expression auf ventralem Haar empfindlicher ist als auf dorsalem Haar. Agouti wird nicht direkt in den Melanozyten sezerniert, da es als parakriner Faktor auf dermalen Papillenzellen wirkt und die Freisetzung von Melanocortin hemmt . Melanocortin wirkt auf follikuläre Melanozyten, um die Produktion von Eumelanin zu erhöhen , einem Melaninpigment, das für braunes und schwarzes Haar verantwortlich ist. Wenn Agouti exprimiert wird, dominiert die Produktion von Phäomelanin , einem Melaninpigment, das gelb oder rot gefärbtes Haar produziert.
Struktur
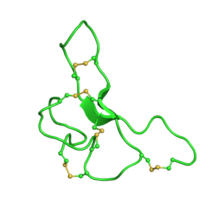
Das Agouti-Signalpeptid nimmt ein Inhibitor-Cystin-Knoten- Motiv an. Zusammen mit dem homologen Agouti-verwandten Peptid sind dies die einzigen bekannten Säugetierproteine, die diese Faltung annehmen. Das Peptid besteht aus 131 Aminosäuren.
Mutationen
Die letale gelbe Mutation (A y ) war die erste embryonale Mutation, die bei Mäusen charakterisiert wurde, da homozygote letale gelbe Mäuse (A y / A y ) früh in der Entwicklung aufgrund eines Fehlers in der Trophektodermdifferenzierung sterben . Tödliche gelbe Homozygoten sind heute selten, während tödliche gelbe und lebensfähige gelbe Heterozygoten (A y /a und A vy /a) häufiger vorkommen. Bei Wildtyp-Mäusen wird Agouti nur während des Haarwachstums in der Haut exprimiert, aber diese dominanten gelben Mutationen bewirken, dass es auch in anderen Geweben exprimiert wird . Diese ektopische Expression des Agouti- Gens ist mit dem Yellow-Obeese-Syndrom verbunden , das durch früh einsetzende Fettleibigkeit , Hyperinsulinämie und Tumorentstehung gekennzeichnet ist .
Die tödliche gelbe ( Ay )-Mutation ist auf eine stromaufwärts gelegene Deletion an der Startstelle der Agouti- Transkription zurückzuführen. Diese Deletion führt dazu, dass die genomische Sequenz von Agouti verloren geht, mit Ausnahme des Promotors und des ersten nicht-kodierenden Exons von Raly , einem ubiquitär exprimierten Gen in Säugern. Die kodierenden Exons von Agouti werden unter die Kontrolle des Raly- Promotors gestellt, was die ubiquitäre Expression von Agouti initiiert , die Produktion von Phäomelanin gegenüber Eumelanin erhöht und zur Entwicklung eines gelben Phänotyps führt.
Die lebensfähige gelbe (A vy ) Mutation ist auf eine Änderung der mRNA-Länge von Agouti zurückzuführen , da das exprimierte Gen länger als die normale Genlänge von Agouti wird. Dies wird durch die Insertion eines einzelnen intrazisternalen A-Partikels (IAP)-Retrotransposons stromaufwärts der Startstelle der Agouti- Transkription verursacht. Am proximalen Ende des Gens bewirkt ein unbekannter Promotor dann, dass Aguti konstitutionell aktiviert wird und Individuen sich mit Phänotypen präsentieren, die mit der tödlichen gelben Mutation übereinstimmen . Obwohl der Aktivierungsmechanismus des Promotors, der die lebensfähige gelbe Mutation kontrolliert, unbekannt ist, wurde die Stärke der Fellfarbe mit dem Grad der Genmethylierung korreliert , der durch die Ernährung der Mutter und die Umweltexposition bestimmt wird. Da Agouti selbst Melanocortin-Rezeptoren hemmt, die für die Eumelanin-Produktion verantwortlich sind, wird der gelbe Phänotyp sowohl bei tödlichen gelben als auch bei lebensfähigen gelben Mutationen verschlimmert, wenn die Agouti- Genexpression erhöht wird. Agouti ist einzigartig, denn obwohl es ein rezessives Allel ist, erscheinen Heterozygoten gelb, nicht das dominante Braun oder Schwarz.
Lebensfähige gelbe (A vy /a) und tödliche gelbe (A y /a) Heterozygoten haben eine verkürzte Lebensdauer und ein erhöhtes Risiko für die Entwicklung von früh einsetzender Fettleibigkeit, Typ-II-Diabetes mellitus und verschiedenen Tumoren. Das erhöhte Risiko, Fettleibigkeit zu entwickeln, ist auf die Fehlregulation des Appetits zurückzuführen, da Agouti das Agouti-Related Protein (AGRP) schmerzt , das für die Stimulation des Appetits über hypothalamische NPY/AGRP- oder exigene Neuronen verantwortlich ist. Agouti fördert auch Fettleibigkeit, indem es das Melanozyten-stimulierende Hormon (MSH) am Melanocortin-Rezeptor (MC4R) antagonisiert , da MC4R für die Regulierung der Nahrungsaufnahme durch Hemmung von Appetitsignalen verantwortlich ist. Die Zunahme des Appetits ist mit Veränderungen des Nährstoffstoffwechsels aufgrund der parakrinen Wirkung von Aguti auf das Fettgewebe, der Erhöhung der Leberlipogenese , der Verringerung der Lipolyse und der Erhöhung der Adipozytenhypertrophie verbunden. Dies erhöht die Körpermasse und führt zu Schwierigkeiten beim Abnehmen, da Stoffwechselwege fehlreguliert werden. Hyperinsulinämie wird durch Mutationen von Agouti verursacht , da das Agouti-Protein kalziumabhängig die Insulinsekretion in den Betazellen der Bauchspeicheldrüse erhöht, was das Risiko einer Insulinresistenz erhöht . Die erhöhte Tumorbildung ist auf die erhöhten mitotischen Raten von Agouti zurückzuführen , die in epithelialen und mesenchymalen Geweben lokalisiert sind.
Methylierung und Diätintervention

Das korrekte Funktionieren von Agouti erfordert DNA-Methylierung. Methylierung tritt in sechs Guanin-Cytosin (GC)-reichen Sequenzen in der 5' langen terminalen Wiederholung des IAP-Elements in der lebensfähigen gelben Mutation auf. Die Methylierung eines Gens führt dazu, dass das Gen nicht exprimiert wird, da der Promotor dadurch ausgeschaltet wird. In utero kann die Ernährung der Mutter eine Methylierung oder Demethylierung verursachen. Wenn dieser Bereich nicht methyliert ist, kommt es zu einer ektopischen Expression von Agouti , und es werden gelbe Phänotypen gezeigt, da das Phäomelanin anstelle von Eumelanin exprimiert wird. Wenn die Region methyliert ist, wird Agouti normal exprimiert und es treten graue und braune Phänotypen (Eumelanin) auf. Der epigenetische Zustand des IAP-Elements wird durch den Methylierungsgrad bestimmt, da Individuen basierend auf ihrem DNA-Methylierungsgrad eine breite Palette von Phänotypen aufweisen. Eine erhöhte Methylierung korreliert mit einer erhöhten Expression des normalen Agouti- Gens. Niedrige Methylierungsgrade können Gen-Imprinting induzieren, was dazu führt, dass Nachkommen konsistente Phänotypen für ihre Eltern aufweisen, da die ektopische Expression von Agouti durch nicht-genomische Mechanismen vererbt wird.
Die DNA-Methylierung wird in utero durch mütterliche Ernährung und Umweltbelastung bestimmt. Methyl wird de novo synthetisiert, aber über die Nahrung von Folsäure, Methionin, Betain und Cholin aufgenommen, da diese Nährstoffe in einen konsistenten Stoffwechselweg für die Methylsynthese einfließen. Für die Methylsynthese werden ausreichend Zink und Vitamin B12 benötigt, da sie als Cofaktoren für die Übertragung von Methylgruppen fungieren.
Wenn während der frühen Embryonalentwicklung unzureichend Methyl verfügbar ist, kann keine DNA-Methylierung auftreten, was die ektopische Expression von Agouti erhöht und zur Präsentation des tödlichen gelben und lebensfähigen gelben Phänotyps führt, die bis ins Erwachsenenalter bestehen bleiben. Dies führt zur Entwicklung des gelben Adipositas-Syndroms , das die normale Entwicklung beeinträchtigt und die Anfälligkeit für die Entwicklung chronischer Krankheiten erhöht. Sicherstellung mütterliche Ernährung mit hohen methyl Äquivalente sind , ist ein Schlüssel präventive Maßnahme zur Reduzierung ektopische Expression von Agouti in Nachkommen. Eine Ernährungsintervention durch Methylsupplementierung reduziert die Prägung am Agouti- Locus, da ein erhöhter Methylkonsum dazu führt, dass das IAP-Element vollständig methyliert wird und die ektope Expression von Agouti reduziert wird. Dies verringert den Anteil der Nachkommen mit dem gelben Phänotyp und erhöht die Anzahl der Nachkommen, die Agouti- Wildtyp-Mäusen mit grauem Fell ähneln . Zwei genetisch identische Mäuse könnten aufgrund der Ernährung der Mütter während der In-Utero-Phase der Mäuse phänotypisch sehr unterschiedlich aussehen. Wenn die Mäuse das Agouti-Gen haben, kann es dadurch exprimiert werden, dass die Mutter eine typische Ernährung isst und die Nachkommen ein gelbes Fell haben. Wenn dieselbe Mutter eine methylreiche Ernährung mit Zink, Vitamin B12 und Folsäure zu sich genommen hätte, würde das Agouti-Gen der Nachkommen wahrscheinlich methyliert, es würde nicht exprimiert und das Fell wäre stattdessen braun. Bei Mäusen wird die gelbe Fellfarbe auch mit Gesundheitsproblemen bei Mäusen wie Fettleibigkeit und Diabetes in Verbindung gebracht.
Menschliches Homolog
Das Agouti-Signalprotein (ASP) ist das menschliche Homolog des murinen Agouti . Es wird vom menschlichen Agouti-Gen auf Chromosom 20 kodiert und ist ein Protein, das aus 132 Aminosäuren besteht. Es wird viel breiter als Maus- Aguti exprimiert und kommt in Fettgewebe, Pankreas, Hoden und Eierstöcken vor, während Maus- Aguti ausschließlich in Melanozyten exprimiert wird. ASP hat 85% Ähnlichkeit mit der murinen Form von Agouti . Da die ektope Expression von murinem Agouti zur Entwicklung des Yellow-Adipose-Syndroms führt , wird erwartet, dass dies beim Menschen konsistent ist. Das gelbe Fettleibigkeitssyndrom fördert die Entwicklung vieler chronischer Krankheiten, darunter Fettleibigkeit, Diabetes mellitus Typ II und Tumorentstehung.
ASP hat eine ähnliche pharmakologische Aktivierung wie Maus- Aguti , da Melanocortin-Rezeptoren durch kompetitiven Antagonismus gehemmt werden. Die Hemmung von Melanocortin durch ASP kann auch durch nicht-kompetitive Methoden erfolgen, wodurch das Wirkungsspektrum erweitert wird. Die Funktion von ASP unterscheidet sich von der der Maus- Aguti . ASP beeinflusst die Qualität der Haarpigmentierung, während murines Agouti die Verteilung der Pigmente steuert, die die Fellfarbe bestimmen. ASP hat neuroendokrine Funktionen, die mit murinem Agouti übereinstimmen , da es über AgRP- Neuronen im Hypothalamus agonisiert und MSH bei MC4Rs antagonisiert, was die Sättigungssignale reduziert. AgRP wirkt als Appetitanreger und steigert den Appetit bei gleichzeitiger Verringerung des Stoffwechsels. Aufgrund dieser Mechanismen kann AgRP sowohl bei Menschen als auch bei Mäusen mit einer erhöhten Körpermasse und Fettleibigkeit in Verbindung gebracht werden. Eine Überexpression von AgRP wurde bei Männern mit Fettleibigkeit in Verbindung gebracht, während bestimmte Polymorphismen von AgRP mit Essstörungen wie Anorexia nervosa in Verbindung gebracht wurden . Der der Hyperinsulinämie beim Menschen zugrunde liegende Mechanismus stimmt mit dem murinen Agouti überein , da die Insulinsekretion durch kalziumsensitive Signale in den Betazellen der Bauchspeicheldrüse erhöht wird. Der Mechanismus der ASP-induzierten Tumorgenese beim Menschen bleibt unbekannt.
Siehe auch
Verweise
Weiterlesen
- Wilczynski AM, Joseph CG, Haskell-Luevano C (September 2005). „Aktuelle Trends in den Struktur-Aktivitäts-Beziehungsstudien des endogenen Agouti-related Protein (AGRP) Melanocortin-Rezeptor-Antagonisten“. Medizinische Forschung Bewertungen . 25 (5): 545–56. doi : 10.1002/med.20037 . PMID 16044415 . S2CID 116767 .
- Pritchard LE, White A (Oktober 2005). "Agouti-related protein: mehr als ein Melanocortin-4-Rezeptor-Antagonist?". Peptide . 26 (10): 1759–70. doi : 10.1016/j.peptides.2004.11.036 . PMID 15996791 . S2CID 21598037 .
- Stütz AM, Morrison CD, Argyropoulos G (Oktober 2005). „Das Agouti-verwandte Protein und seine Rolle in der Energiehomöostase“. Peptide . 26 (10): 1771–81. doi : 10.1016/j.peptides.2004.12.024 . PMID 15961186 . S2CID 9749408 .
- Millhauser GL, McNulty JC, Jackson PJ, Thompson DA, Barsh GS, Gantz I (Juni 2003). "Schleifen und Verknüpfungen: strukturelle Einblicke in die bemerkenswerte Funktion des Aguti-verwandten Proteins" (PDF) . Annalen der New Yorker Akademie der Wissenschaften . 994 (1): 27–35. Bibcode : 2003NYASA.994...27M . doi : 10.1111/j.1749-6632.2003.tb03159.x . hdl : 2027.42/75746 . PMID 12851295 . S2CID 46576434 .
- Barsh GS, He L, Gunn TM (2002). „Genetische und biochemische Studien des Agouti-Attractin-Systems“. Zeitschrift für Rezeptor- und Signaltransduktionsforschung . 22 (1–4): 63–77. doi : 10.1081/RRS-120014588 . PMID 12503608 . S2CID 25089838 .
- Millington GW (Mai 2006). „Proopiomelanocortin (POMC): die kutane Rolle seiner Melanocortin-Produkte und -Rezeptoren“. Klinische und experimentelle Dermatologie . 31 (3): 407–12. doi : 10.1111/j.1365-2230.2006.02128.x . PMID 16681590 . S2CID 25213876 .
Externe Links
- agouti+protein an der US National Library of Medicine Medical Subject Headings (MeSH)
Dieser Artikel enthält Texte der National Library of Medicine der Vereinigten Staaten , die gemeinfrei sind .



