Kobalt (II) fluorid - Cobalt(II) fluoride
|
|
|
|
| Namen | |
|---|---|
|
IUPAC-Name
Kobalt (II) fluorid
|
|
| Andere Namen
Kobaltdifluorid
|
|
| Kennungen | |
|
3D-Modell ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard |
100.030.044 |
| EG-Nummer | |
|
PubChem CID
|
|
| RTECS-Nummer | |
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Eigenschaften | |
| Co F 2 | |
| Molmasse | 96,93 g / mol |
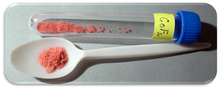
| Aussehen | Roter kristalliner Feststoff |
| Dichte | 4,46 g / cm 3 (wasserfrei) 2,22 g / cm 3 (Tetrahydrat) |
| Schmelzpunkt | 1.217 ° C (2.223 ° F; 1.490 K) |
| Siedepunkt | 1.400 ° C (1.650 K) |
| 1,4 g / 100 ml (25 ° C) | |
| Löslichkeit | löslich in HF unlöslich in Alkohol , Ether , Benzol |
| + 9490,0 · 10 –6 cm 3 / mol | |
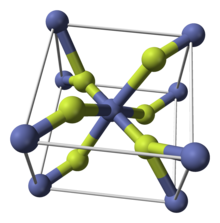
| Struktur | |
| tetragonales (a, wasserhaltiges) orthorhombisches (Tetrahydrat) |
|
| Gefahren | |
| NFPA 704 (Feuerdiamant) | |
| Tödliche Dosis oder Konzentration (LD, LC): | |
|
LD 50 ( mittlere Dosis )
|
oral (Ratte): 150 mg / kg |
| Verwandte Verbindungen | |
|
Andere Anionen
|
Kobalt (II) -oxid , Kobalt (II) -chlorid |
|
Andere Kationen
|
Eisen (II) fluorid , Nickel (II) fluorid |
|
Verwandte Verbindungen
|
Kobalttrifluorid |
|
Sofern nicht anders angegeben, werden Daten für Materialien in ihrem Standardzustand (bei 25 ° C, 100 kPa) angegeben. |
|
|
|
|
| Infobox-Referenzen | |
Kobalt (II) fluorid ist eine chemische Verbindung mit der Formel (CoF 2 ). Es ist eine rosa kristalline feste Verbindung, die bei niedrigen Temperaturen antiferromagnetisch ist (T N = 37,7 K). Die Formel wird sowohl für den roten tetragonalen Kristall (CoF 2 ) als auch für den roten orthogonalen Tetrahydratkristall (CoF 2 · 4H 2 O) angegeben ). CoF 2 wird in sauerstoffempfindlichen Bereichen eingesetzt, nämlich in der Metallherstellung. In geringen Konzentrationen wird es für die öffentliche Gesundheit verwendet. CoF 2 ist in Wasser schwer löslich. Die Verbindung kann in warmer Mineralsäure gelöst werden und zersetzt sich in kochendem Wasser. Das Hydrat ist jedoch wasserlöslich, insbesondere die Dihydrat-CoF 2 · 2H 2 O- und Trihydrat-CoF 2 · 3H 2 O-Formen der Verbindung. Das Hydrat zersetzt sich auch unter Hitzeeinwirkung.
Vorbereitung
Kobalt (II) fluorid kann aus wasserfreiem Kobalt (II) chlorid oder Kobalt (II) oxid in einem Fluorwasserstoffstrom hergestellt werden :
- CoCl 2 + 2HF → CoF 2 + 2HCl
- CoO + 2HF → CoF 2 + H 2 O.
Es entsteht bei der Reaktion von Kobalt (III) fluorid mit Wasser.
Das Tetrahydrat Cobalt (II) fluorid wird durch Auflösen von Cobalt (II) in Flusssäure gebildet. Das wasserfreie Fluorid kann durch Dehydratisierung daraus extrahiert werden . Andere Synthesen können bei höheren Temperaturen auftreten. Es wurde gezeigt, dass sich Fluor bei 500 ° C mit Kobalt verbindet und eine Mischung aus CoF 2 und CoF 3 erzeugt .
Verwendet
Kobalt (II) fluorid kann als Katalysator zum Legieren von Metallen verwendet werden. Es wird auch zur optischen Abscheidung verwendet, wodurch die optische Qualität erheblich verbessert wird. Kobalt (II) fluorid ist in den meisten Volumina in einer ultrahochreinen Zusammensetzung erhältlich. Hochreine Zusammensetzungen verbessern die optischen Eigenschaften und ihre Nützlichkeit als Standard.
Analyse
Zur Analyse dieser Verbindung kann Cobalt (II) fluorid in Salpetersäure gelöst werden. Die Lösung wird dann mit Wasser bis zur geeigneten Konzentration für die AA- oder ICP- Spektrophotometrie für das Kobalt verdünnt . Eine kleine Menge Salz kann in kaltem Wasser gelöst und durch eine fluoridionenselektive Elektrode oder Ionenchromatographie auf Fluoridionen analysiert werden .
Chemische Eigenschaften
CoF 2 ist eine schwache Lewis-Säure . Kobalt (II) -Komplexe sind normalerweise oktaedrisch oder tetraedrisch. Als 19-Elektronen-Spezies ist es ein gutes Reduktionsmittel, das ziemlich zu einer 18-Elektronen-Verbindung oxidierbar ist. Kobalt (II) fluorid kann bei 300 ° C durch Wasserstoff reduziert werden.
Verweise
- ^ Pradyot Patnaik (2002), Handbuch für anorganische Chemikalien , McGraw-Hill Professional, ISBN 978-0-07-049439-8
- ^ Pashkevich, DS; Radchenko SM; Mukhortov, DA, " Artikeltitel Wärmeaustausch zwischen Kobalt (II) -fluoridpulver und der Wand eines rotierenden Zylinders" (PDF) , Russisches Journal für Angewandte Chemie , Consultants Bureau, ISSN 1070-4272 , archiviert aus dem Original (PDF) von 2004 -09-29 , abgerufen am 07.03.2007
- ^ Ashcroft / Mermin: Festkörperphysik (Tab. 33.2)
- ^ JC Bailar (1973), Umfassende anorganische Chemie , Pergoamon

