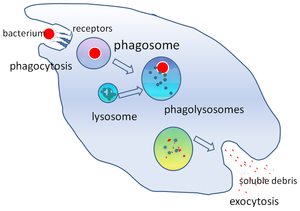
Phagosom - Phagosome
In der Zellbiologie ein phagosome ist ein Vesikel um einen Partikel durch eine verschlungen gebildet Phagocyten über Phagozytose . Professionelle Phagozyten umfassen Makrophagen , Neutrophile und dendritische Zellen (DCs). Ein Phagosom entsteht durch die Fusion der Zellmembran um einen Mikroorganismus , eine seneszente Zelle oder eine apoptotische Zelle . Phagosomen haben membrangebundene Proteine , um Lysosomen zu rekrutieren und mit ihnen zu verschmelzen , um reife Phagolysosomen zu bilden . Die Lysosomen enthalten hydrolytische Enzyme und reaktive Sauerstoffspezies (ROS), die die Krankheitserreger abtöten und verdauen . Phagosomen können sich auch in nicht professionellen Fresszellen bilden, aber sie können nur einen kleineren Partikelbereich verschlingen und enthalten kein ROS. Die Wertstoffe (zB Aminosäuren ) aus den verdauten Partikeln werden in das Zytosol überführt und Abfallstoffe durch Exozytose entfernt . Die Bildung von Phagosomen ist entscheidend für die Gewebehomöostase und sowohl die angeborene als auch die adaptive Wirtsabwehr gegen Krankheitserreger.
Einige Bakterien können jedoch die Phagozytose als Invasionsstrategie nutzen. Sie vermehren sich entweder innerhalb des Phagolysosoms (zB Coxiella spp.) oder entweichen ins Zytoplasma, bevor das Phagosom mit dem Lysosom verschmilzt (zB Rickettsia spp.). Viele Mycobakterien, einschließlich Mycobacterium tuberculosis und Mycobacterium avium paratuberculosis , kann der Host manipulieren Makrophagen zu Lysosomen aus Verschmelzen mit Phagosomen und die Schaffung von reifen Phagolysosome zu verhindern. Eine solche unvollständige Reifung des Phagosoms erhält eine günstige Umgebung für die darin befindlichen Krankheitserreger.
Formation
Phagosomen sind groß genug, um ganze Bakterien oder apoptotische und seneszente Zellen abzubauen , die normalerweise einen Durchmesser von > 0,5 μm haben. Das bedeutet, dass ein Phagosom um mehrere Größenordnungen größer ist als ein Endosom , das in Nanometern gemessen wird .
Phagosomen werden gebildet, wenn Krankheitserreger oder Opsonine an einen Transmembranrezeptor binden, die zufällig auf der Zelloberfläche der Fresszellen verteilt sind. Bei der Bindung löst die "Outside-In"-Signalgebung die Aktin- Polymerisation und die Pseudopodien- Bildung aus, die den Mikroorganismus umgibt und hinter ihm verschmilzt. Proteinkinase C , Phosphoinositid-3-Kinase und Phospholipase C (PLC) werden alle für die Signalübertragung und die Kontrolle der Partikelinternalisierung benötigt. Weitere Zelloberflächenrezeptoren an das Teilchen in einem Reißverschluß-ähnlicher Mechanismus wie die Erreger binden können , umgeben ist, um die Bindung zu erhöhen Avidität . Fc-Rezeptor (FcR), Komplement-Rezeptor (CR), Mannose-Rezeptor und Dectin-1 sind phagozytische Rezeptoren, was bedeutet, dass sie Phagozytose induzieren können, wenn sie in nicht-phagozytischen Zellen wie Fibroblasten exprimiert werden . Andere Proteine wie Toll-like-Rezeptoren sind an der Erkennung von Pathogenmustern beteiligt und werden oft an Phagosomen rekrutiert, lösen jedoch in nicht-phagozytischen Zellen keine spezifische Phagozytose aus, sodass sie nicht als phagozytische Rezeptoren betrachtet werden.
Opsonisierung
Opsonine sind molekulare Markierungen wie Antikörper und Komplemente , die an Krankheitserreger binden und die Phagozytose hochregulieren. Immunglobulin G (IgG) ist der wichtigste Antikörpertyp im Serum . Es ist Teil des adaptiven Immunsystems , aber es ist mit der angeborenen Reaktion verbunden, indem es Makrophagen für Phagozytose-Erreger rekrutiert. Der Antikörper bindet an Mikroben mit der variablen Fab-Domäne , und die Fc-Domäne bindet an Fc-Rezeptoren (FcR), um die Phagozytose zu induzieren.
Die komplementvermittelte Internalisierung weist viel weniger signifikante Membranvorsprünge auf, aber die stromabwärts gelegenen Signalwege beider Wege konvergieren, um Rho-GTPasen zu aktivieren . Sie steuern die Aktinpolymerisation, die für die Fusion des Phagosoms mit Endosomen und Lysosomen erforderlich ist.
Nicht-phagozytäre Zellen
Andere nicht-professionelle Phagozyten haben einen gewissen Grad an phagozytischer Aktivität, wie Schilddrüsen- und Blasenepithelzellen, die Erythrozyten verschlingen können, und Netzhautepithelzellen, die Netzhautstäbchen internalisieren. Nicht-professionelle Phagozyten exprimieren jedoch keine spezifischen phagozytischen Rezeptoren wie FcR und weisen eine viel geringere Internalisierungsrate auf.
Einige invasive Bakterien können auch Phagozytose in nicht-phagozytischen Zellen induzieren, um die Aufnahme durch den Wirt zu vermitteln. Shigella kann beispielsweise Toxine absondern, die das Zytoskelett des Wirts verändern und in die basolaterale Seite der Enterozyten eindringen .
Struktur
Da die Membran des Phagosoms durch die Fusion der Plasmamembran gebildet wird, ist die Grundzusammensetzung der Phospholipid-Doppelschicht dieselbe. Endosomen und Lysosomen verschmelzen dann mit dem Phagosom, um zur Membran beizutragen, insbesondere wenn das eingehüllte Partikel sehr groß ist, wie beispielsweise ein Parasit . Sie liefern auch verschiedene Membranproteine an das Phagosom und modifizieren die Organellenstruktur.
Phagosomen kann künstlich niedriger Dichte versenken Latex - Perlen und dann entlang einem gereinigten Sucrose Konzentrationsgradienten, die Struktur und die Zusammensetzung so dass untersucht werden. Durch die Reinigung von Phagosomen zu unterschiedlichen Zeitpunkten kann auch der Reifungsprozess charakterisiert werden. Frühe Phagosomen sind durch Rab5 gekennzeichnet, das in Rab7 übergeht, wenn das Vesikel zu späten Phagosomen reift.
Reifeprozess
Das entstehende Phagosom ist nicht von Natur aus bakterizid. Mit zunehmender Reife wird es von pH 6,5 bis pH 4 saurer und erhält charakteristische Proteinmarker und hydrolytische Enzyme. Die verschiedenen Enzyme funktionieren bei verschiedenen optimalen pH-Werten und bilden einen Bereich, sodass sie jeweils in engen Stadien des Reifungsprozesses arbeiten. Die Enzymaktivität kann durch Ändern des pH-Werts fein abgestimmt werden, was eine größere Flexibilität ermöglicht. Das Phagosom bewegt sich entlang der Mikrotubuli des Zytoskeletts und verschmilzt sequentiell mit Endosomen und Lysosomen in einer dynamischen "Kiss-and-Run" -Weise. Dieser intrazelluläre Transport hängt von der Größe der Phagosomen ab. Größere Organellen (mit einem Durchmesser von ca. 3 µm) werden sehr persistent von der Zellperipherie in Richtung perinukleärer Region transportiert, während kleinere Organellen (mit einem Durchmesser von ca. 1 µm) bidirektionaler zwischen Zellzentrum und Zellperipherie hin und her transportiert werden. Vakuoläre Protonenpumpen (v-ATPase) werden an das Phagosom abgegeben, um das Organellenkompartiment anzusäuern, wodurch eine feindlichere Umgebung für Krankheitserreger geschaffen und der Proteinabbau erleichtert wird. Die bakteriellen Proteine werden bei niedrigem pH-Wert denaturiert und werden für die Proteasen, die von der sauren Umgebung unbeeinflusst sind, leichter zugänglich. Die Enzyme werden später vor der Egestion aus dem Phagolysosom recycelt, damit sie nicht verschwendet werden. Auch die Zusammensetzung der Phospholipidmembran ändert sich mit der Reifung des Phagosoms.
Die Fusion kann je nach Inhalt des Phagosoms Minuten bis Stunden dauern; FcR- oder Mannoserezeptor-vermittelte Fusion dauert weniger als 30 Minuten, aber Phagosomen, die Latexkügelchen enthalten, können mehrere Stunden brauchen, um mit Lysosomen zu fusionieren. Es wird vermutet, dass die Zusammensetzung der Phagosomenmembran die Reifungsgeschwindigkeit beeinflusst. Mycobacterium tuberculosis hat eine sehr hydrophobe Zellwand , von der angenommen wird, dass sie das Membranrecycling und die Rekrutierung von Fusionsfaktoren verhindert, sodass das Phagosom nicht mit Lysosomen fusioniert und das Bakterium einen Abbau vermeidet.
Kleinere lumenale Moleküle werden durch Fusion schneller übertragen als größere Moleküle, was darauf hindeutet, dass sich beim „Kiss-and-Run“ zwischen dem Phagosom und anderen Vesikel ein kleiner wässriger Kanal bildet, durch den nur ein begrenzter Austausch möglich ist.
Fusionsregelung
Kurz nach der Internalisierung depolymerisiert F-Aktin aus dem neu gebildeten Phagosom, so dass es Endosomen für die Fusion und den Transport von Proteinen zugänglich wird. Der Reifungsprozess wird in Abhängigkeit von charakteristischen Proteinmarkern in frühe und späte Stadien unterteilt, die durch kleine Rab-GTPasen reguliert werden. Rab5 ist auf frühen Phagosomen vorhanden und kontrolliert den Übergang zu späten Phagosomen, die durch Rab7 markiert sind.
Rab5 rekrutiert PI-3-Kinase und andere Bindungsproteine wie Vps34 an die Phagosomenmembran, sodass Endosomen Proteine an das Phagosom liefern können. Rab5 ist über den CORVET-Komplex und den HOPS-Komplex in Hefe teilweise am Übergang zu Rab7 beteiligt. Der genaue Reifungsweg bei Säugetieren ist nicht gut verstanden, aber es wird vermutet, dass HOPS Rab7 binden und den Guanosinnukleotiddissoziationsinhibitor (GDI) verdrängen kann . Rab11 ist am Membranrecycling beteiligt.
Phagolysosom
Das Phagosom verschmilzt mit Lysosomen zu einem Phagolysosom, das verschiedene bakterizide Eigenschaften besitzt. Das Phagolysosom enthält reaktive Sauerstoff- und Stickstoffspezies (ROS und RNS) und hydrolytische Enzyme. Das Kompartiment ist auch sauer aufgrund von Protonenpumpen (v-ATPasen), die H + durch die Membran transportieren, um die bakteriellen Proteine zu denaturieren.
Die genauen Eigenschaften von Phagolysosomen variieren je nach Art der Fresszelle. Diejenigen in dendritischen Zellen haben schwächere bakterizide Eigenschaften als die in Makrophagen und Neutrophilen. Makrophagen werden auch in entzündungsfördernde "Killer" M1 und "Reparatur" M2 unterteilt. Die Phagolysosomen von M1 können Arginin zu hochreaktivem Stickstoffmonoxid metabolisieren , während M2 Arginin zur Produktion von Ornithin verwendet , um die Zellproliferation und Gewebereparatur zu fördern.
Funktion
Abbau von Krankheitserregern
Makrophagen und Neutrophile sind professionelle Fresszellen, die für den größten Teil des Pathogenabbaus verantwortlich sind, aber sie haben unterschiedliche bakterizide Methoden. Neutrophile haben Körnchen, die mit dem Phagosom verschmelzen. Das Granulat enthält NADPH-Oxidase und Myeloperoxidase , die giftigen Sauerstoff und Chlorderivate produzieren, um Krankheitserreger bei einem oxidativen Ausbruch abzutöten . Auch Proteasen und antimikrobielle Peptide werden in das Phagolysosom freigesetzt. Makrophagen haben kein Granulat und sind mehr auf die Ansäuerung von Phagolysosomen, Glykosidasen und Proteasen angewiesen , um Mikroben zu verdauen. Phagosomen in dendritischen Zellen sind weniger sauer und haben aufgrund einer geringeren Konzentration an lysosomalen Proteasen und sogar der Anwesenheit von Protease-Inhibitoren eine viel schwächere hydrolytische Aktivität.
Entzündung
Die Phagosomenbildung ist über gemeinsame Signalmoleküle mit Entzündungen verbunden. PI-3-Kinase und PLC sind sowohl am Internalisierungsmechanismus als auch an der Auslösung von Entzündungen beteiligt. Die beiden Proteine sind zusammen mit Rho GTPasen wichtige Komponenten der angeborenen Immunantwort, indem sie die Zytokinproduktion induzieren und die MAP-Kinase -Signalkaskade aktivieren . Pro-inflammatorische Zytokine einschließlich IL-1β , IL-6 , TNFα und IL-12 werden alle produziert.
Der Prozess ist streng reguliert und die Entzündungsreaktion variiert je nach Partikeltyp innerhalb des Phagosoms. Pathogen-infizierte apoptotische Zellen lösen eine Entzündung aus, beschädigte Zellen, die im Rahmen des normalen Gewebeumsatzes abgebaut werden, jedoch nicht. Die Reaktion unterscheidet sich auch entsprechend der Opsonin-vermittelten Phagozytose. FcR- und Mannoserezeptor-vermittelte Reaktionen produzieren proinflammatorische reaktive Sauerstoffspezies und Arachidonsäuremoleküle , aber CR-vermittelte Reaktionen führen nicht zu diesen Produkten.
Antigen-Präsentation
Unreife dendritische Zellen (DCs) können phagozytieren, reife DCs jedoch nicht aufgrund von Veränderungen der Rho-GTPasen, die am Zytoskelett-Remodelling beteiligt sind. Die Phagosomen von DCs sind weniger hydrolytisch und sauer als die von Makrophagen und Neutrophilen, da DCs hauptsächlich an der Antigenpräsentation und nicht am Pathogenabbau beteiligt sind. Sie müssen Proteinfragmente geeigneter Größe für die spezifische Bakterienerkennung zurückhalten, damit die Peptide nur teilweise abgebaut werden. Peptide aus den Bakterien werden zum Major Histocompatibility Complex (MHC) transportiert. Die Peptidantigene werden Lymphozyten präsentiert , wo sie an T-Zell-Rezeptoren binden und T-Zellen aktivieren , wodurch die Lücke zwischen angeborener und adaptiver Immunität geschlossen wird. Dies ist spezifisch für Säugetiere , Vögel und Kieferfische, da Insekten keine adaptive Immunität haben.
Nährstoff
Alte einzellige Organismen wie Amöben verwenden die Phagozytose eher als eine Möglichkeit, Nährstoffe zu erhalten, als eine Immunstrategie. Sie verschlingen andere kleinere Mikroben und verdauen sie im Phagosom von etwa einem Bakterium pro Minute, was viel schneller ist als bei professionellen Fresszellen. Für die Boden-Amöbe Dictyostelium discoideum ist ihre Hauptnahrungsquelle das Bakterium Legionella pneumophila , das beim Menschen die Legionärskrankheit verursacht. Die Reifung der Phagosomen bei Amöben ist der bei Makrophagen sehr ähnlich, daher werden sie als Modellorganismen verwendet, um den Prozess zu untersuchen.
Gewebebeseitigung
Phagosomen bauen alternde Zellen und apoptotische Zellen ab, um die Gewebehomöostase aufrechtzuerhalten. Erythrozyten haben eine der höchsten Umsatzraten im Körper und werden von Makrophagen in Leber und Milz phagozytiert . Im Embryo ist der Prozess der Entfernung abgestorbener Zellen nicht gut charakterisiert, wird jedoch nicht von Makrophagen oder anderen Zellen durchgeführt, die aus hämatopoetischen Stammzellen stammen . Nur beim Erwachsenen werden apoptotische Zellen von professionellen Fresszellen phagozytiert. Entzündung wird nur dann ausgelöst , durch bestimmte pathogen- oder beschädigungs associated molecular patterns (PAMPs oder DAMPS), die Entfernung von seneszenten Zellen nicht-entzündliche.
Autophagosom
Autophagosomen unterscheiden sich von Phagosomen dadurch, dass sie hauptsächlich zum selektiven Abbau beschädigter zytosolischer Organellen wie Mitochondrien ( Mitophagie ) verwendet werden. Wenn die Zelle jedoch ausgehungert oder gestresst ist, können Autophagosomen auch nicht selektiv Organellen abbauen, um die Zelle mit Aminosäuren und anderen Nährstoffen zu versorgen. Autophagie ist nicht auf professionelle Phagozyten beschränkt, wird es zunächst in Ratten entdeckt Hepatozyten durch Zellbiologen Christian de Duve . Autophagosomen haben eine Doppelmembran, die innere aus der umhüllten Organelle und die äußere Membran wird vermutlich aus dem endoplasmatischen Retikulum oder dem ER-Golgi Intermediate Compartment (ERGIC) gebildet. Das Autophagosom verschmilzt auch mit Lysosomen, um seinen Inhalt abzubauen. Wenn M. tuberculosis die Ansäuerung von Phagosomen hemmt, kann Interferon-gamma eine Autophagie induzieren und den Reifungsprozess retten.
Bakterienvermeidung und -manipulation
Viele Bakterien haben sich entwickelt, um die bakteriziden Eigenschaften von Phagosomen zu umgehen oder sogar die Phagozytose als Invasionsstrategie auszunutzen.
- Mycobacterium tuberculosis zielt auf M2-Makrophagen in den unteren Teilen der Atemwege ab, die keine ROS produzieren. M. tuberculosis kann die Signalwege auch durch die Sekretion von Phosphatasen wie PtpA und SapM manipulieren, die die Proteinrekrutierung stören und die Ansäuerung von Phagosomen blockieren.
- Legionella pneumophila kann die Phagosomenmembran umgestalten, um Vesikel in anderen Teilen des Sekretionsweges zu imitieren, sodass Lysosomen das Phagosom nicht erkennen und nicht mit ihm fusionieren. Das Bakterium sondert Toxine ab, die den Wirtshandel stören, sodass die Legionellen enthaltende Vakuole Membranproteine rekrutiert, die normalerweise auf dem endoplasmatischen Retikulum oder dem ERGIC zu finden sind. Dies leitet sekretorische Vesikel zum modifizierten Phagosom um und liefert Nährstoffe an das Bakterium.
- Listeria monocytogenes sondert ein porenbildendes Protein Listeriolysin O ab, damit das Bakterium aus dem Phagosom ins Zytosol entweichen kann. Listeriolysin wird durch die saure Umgebung des Phagosoms aktiviert. Darüber hinaussezernieren Listerien zwei Phospholipase-C-Enzyme, die das Entweichen von Phagosomen erleichtern.
Siehe auch
Verweise