Phenylalanin-Hydroxylase - Phenylalanine hydroxylase
Phenylalanin-Hydroxylase ( PAH ) ( EC 1.14.16.1 ) ist ein Enzym , das die Hydroxylierung der aromatischen Seitenkette von Phenylalanin katalysiert , um Tyrosin zu erzeugen . PAH ist eines von drei Mitgliedern der Biopterin- abhängigen aromatischen Aminosäure-Hydroxylasen , einer Klasse von Monooxygenase , die Tetrahydrobiopterin (BH 4 , ein Pteridin- Cofaktor) und ein Nicht-Häm-Eisen zur Katalyse verwendet. Während der Reaktion wird molekularer Sauerstoff heterolytisch gespalten, wobei sequentiell ein Sauerstoffatom in BH 4 und Phenylalanin-Substrat eingebaut wird. Beim Menschen können Mutationen in seinem kodierenden Gen PAH zur Stoffwechselstörung Phenylketonurie führen .
Enzymmechanismus
Es wird angenommen, dass die Reaktion über die folgenden Schritte verläuft:
- Bildung einer Fe(II)-OO-BH 4 -Brücke.
- heterolytische Spaltung der OO-Bindung unter Bildung des Ferreloxo-hydroxylierenden Intermediats Fe(IV)=O
- Angriff auf Fe(IV)=O, um das Phenylalaninsubstrat zu Tyrosin zu hydroxylieren.
Bildung und Spaltung der Eisen-Peroxypterin-Brücke. Obwohl die Beweise stark Fe(IV)=O als hydroxylierende Zwischenstufe unterstützen, bleiben die mechanistischen Details, die der Bildung der Fe(II)-OO-BH 4 -Brücke vor der heterolytischen Spaltung zugrunde liegen, umstritten. Basierend auf Modellen wurden zwei Wege vorgeschlagen, die sich in der Nähe des Eisens zum Pterin-Cofaktor und der Anzahl der Wassermoleküle unterscheiden, von denen angenommen wird, dass sie während der Katalyse eisenkoordiniert sind. Nach einem Modell wird zunächst ein Eisen-Disauerstoff-Komplex gebildet und als Resonanzhybrid aus Fe 2+ O 2 und Fe 3+ O 2 − stabilisiert . Das aktivierte O 2 greift dann BH 4 an und bildet einen Übergangszustand, der durch eine Ladungstrennung zwischen dem elektronenarmen Pterinring und der elektronenreichen Disauerstoffspezies gekennzeichnet ist. Anschließend wird die Fe(II)-OO-BH 4 -Brücke gebildet. Andererseits wurde die Bildung dieser Brücke unter der Annahme modelliert, dass sich BH4 in der ersten Koordinationsschale des Eisens befindet und das Eisen nicht an Wassermoleküle koordiniert. Dieses Modell sagt einen anderen Mechanismus voraus, an dem ein Pterinradikal und Superoxid als kritische Zwischenstufen beteiligt sind. Einmal gebildet, wird die Fe(II)-OO-BH 4 -Brücke durch heterolytische Spaltung der OO-Bindung zu Fe(IV)=O und 4a-Hydroxytetrahydrobiopterin gebrochen; somit ist molekularer Sauerstoff die Quelle für beide Sauerstoffatome, die verwendet werden, um den Pterinring und Phenylalanin zu hydroxylieren.
Hydroxylierung von Phenylalanin durch Ferreloxo-Zwischenprodukt. Da der Mechanismus ein Fe(IV)=O (im Gegensatz zu einem Peroxypterin)-Hydroxylierungsintermediat beinhaltet, können die Oxidation des BH 4 -Cofaktors und die Hydroxylierung von Phenylalanin entkoppelt werden, was zu einem unproduktiven Verbrauch von BH4 und zur Bildung von H2O2 führt. Wenn es jedoch produktiv ist, wird das Fe(IV)=O-Zwischenprodukt an Phenylalanin in einer elektrophilen aromatischen Substitutionsreaktion addiert, die Eisen vom Ferrel- in den Eisen(II)-Zustand reduziert. Obwohl ursprünglich ein Arenoxid oder ein radikalisches Intermediat vorgeschlagen wurde, haben Analysen der verwandten Tryptophan- und Tyrosinhydroxylasen nahegelegt, dass die Reaktion stattdessen über ein kationisches Intermediat verläuft, bei dem Fe(IV)=O an einen Wasserliganden und nicht an eine Hydroxogruppe koordiniert werden muss . Dieses kationische Intermediat durchläuft anschließend eine 1,2-Hydrid-NIH-Verschiebung, wodurch ein Dienon-Intermediat entsteht, das dann tautomerisiert, um das Tyrosinprodukt zu bilden. Der Pterin-Cofaktor wird durch Hydratisierung des Carbinolaminprodukts von PAH zu chinonoidem Dihydrobiopterin (qBH 2 ) regeneriert , das dann zu BH 4 reduziert wird .
Enzymregulation
PAH wird vorgeschlagen , das Morpheein - Modell der allosterischen Regulation zu verwenden .
Säugetier-PAH existiert in einem Gleichgewicht, das aus Tetrameren zweier unterschiedlicher Architekturen besteht, mit einer oder mehreren dimeren Formen als Teil des Gleichgewichts. Dieses Verhalten steht im Einklang mit einem dissoziativen allosterischen Mechanismus.
Viele Studien legen nahe, dass Säuger-PAH ein Verhalten zeigt, das mit Porphobilinogen-Synthase (PBGS) vergleichbar ist, wobei eine Vielzahl von Faktoren wie pH und Ligandenbindung Berichten zufolge die Enzymaktivität und Proteinstabilität beeinflussen.
Struktur
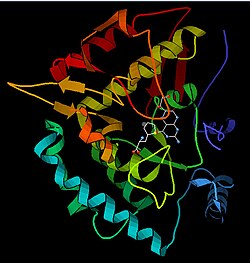
Das PAH-Monomer (51,9 kDa) besteht aus drei unterschiedlichen Domänen: einer regulatorischen N-terminalen Domäne (Reste 1–117), die eine Phe-bindende ACT-Subdomäne enthält, der katalytischen Domäne (Reste 118–427) und einer C-terminalen Domäne (Reste 428–453) verantwortlich für die Oligomerisierung identischer Monomere. Um das aktive Zentrum zu untersuchen, wurden umfangreiche kristallographische Analysen durchgeführt, insbesondere der Pterin- und Eisen-koordinierten katalytischen Domäne. Die Struktur der N-terminalen regulatorischen Domäne wurde ebenfalls bestimmt, und zusammen mit der gelösten Struktur der C-terminalen Tetramerisierungsdomäne der homologen Tyrosinhydroxylase wurde ein Strukturmodell für tetramere PAH vorgeschlagen. Unter Verwendung von Röntgenkristallographie wurde die Struktur von Ratten-Volllängen-PAH experimentell bestimmt und zeigte die auto-inhibierte oder Ruhezustandsform des Enzyms. Die Ruhezustandsform (RS-PAH) unterscheidet sich architektonisch von der aktivierten Form (A-PAH). Eine vollständige Struktur von A-PAH fehlt derzeit, aber die für A-PAH charakteristische Phe-stabilisierte ACT-ACT-Schnittstelle wurde bestimmt und ein Strukturmodell von A-PAH basierend auf der SAXS-Analyse vorgeschlagen.
Katalytische Domäne
Gelöste Kristallstrukturen der katalytischen Domäne weisen darauf hin, dass das aktive Zentrum aus einer offenen und geräumigen Tasche besteht, die hauptsächlich von hydrophoben Resten ausgekleidet ist, obwohl auch drei Glutaminsäurereste, zwei Histidine und ein Tyrosin vorhanden und eisenbindend sind. Es gibt widersprüchliche Hinweise auf den Koordinationszustand des Eisenatoms und seine Nähe zu BH4 im aktiven Zentrum. Laut kristallographischer Analyse wird Fe(II) von Wasser, His285, His290 und Glu330 (eine 2-His-1-Carboxylat-Gesichtstriadenanordnung) mit oktaedrischer Geometrie koordiniert. Die Aufnahme eines Phe-Analogons in die Kristallstruktur ändert sowohl Eisen von einem sechs- in einen fünffach koordinierten Zustand unter Beteiligung eines einzelnen Wassermoleküls als auch zweizähnige Koordination an Glu330 und öffnet eine Stelle für die Sauerstoffbindung. Gleichzeitig wird BH4 in Richtung des Eisenatoms verschoben, obwohl der Pterin-Cofaktor in der zweiten Koordinationssphäre verbleibt. Andererseits deutet ein konkurrierendes Modell auf der Grundlage von NMR- und Molecular-Modeling-Analysen darauf hin, dass alle koordinierten Wassermoleküle während des Katalysezyklus aus dem aktiven Zentrum verdrängt werden, während BH4 direkt an Eisen koordiniert wird. Wie oben diskutiert, ist die Auflösung dieser Diskrepanz wichtig, um den genauen Mechanismus der PAH-Katalyse zu bestimmen.
N-terminale regulatorische Domäne
Die regulatorische Natur der N-terminalen Domäne (Reste 1–117) wird durch ihre strukturelle Flexibilität verliehen. Die Analyse des Wasserstoff/Deuterium-Austauschs zeigt, dass die allosterische Bindung von Phe die Konformation von PAH global so verändert, dass das aktive Zentrum weniger verdeckt wird, da die Grenzfläche zwischen der regulatorischen und der katalytischen Domäne zunehmend dem Lösungsmittel ausgesetzt ist. Diese Beobachtung stimmt mit kinetischen Studien überein, die eine anfänglich niedrige Tyrosinbildungsrate für Volllängen-PAH zeigen. Diese Verzögerungszeit wird jedoch nicht bei einem verkürzten PAH beobachtet, dem die N-terminale Domäne fehlt, oder wenn das Enzym voller Länge mit Phe vorinkubiert wird. Die Deletion der N-terminalen Domäne eliminiert auch die Verzögerungszeit, während die Affinität für Phe um fast das Zweifache erhöht wird; kein Unterschied wird in V max oder K m für den Tetrahydrobiopterin-Cofaktor beobachtet. Zusätzliche Regulierung wird durch Ser16 bereitgestellt; die Phosphorylierung dieses Rests ändert die Enzymkonformation nicht, verringert jedoch die Konzentration von Phe, die für die allosterische Aktivierung erforderlich ist. Diese N-terminale regulatorische Domäne wird in bakteriellen PAHs nicht beobachtet, zeigt jedoch eine beträchtliche strukturelle Homologie zur regulatorischen Domäne der Phosphogylcerat-Dehydrogenase, einem Enzym im Serin-Biosyntheseweg.
Tetramerisierungsdomäne
Prokaryotisches PAH ist monomer, während eukaryotisches PAH in einem Gleichgewicht zwischen homotetrameren und homodimeren Formen existiert. Die Dimerisierungsschnittstelle besteht aus symmetriebezogenen Schleifen, die identische Monomere verbinden, während die überlappende C-terminale Tetramerisierungsdomäne die Assoziation von konformativ unterschiedlichen Dimeren vermittelt, die durch eine unterschiedliche relative Orientierung der katalytischen und der Tetramerisierungsdomäne gekennzeichnet sind (Flatmark, Erlandsen). Die resultierende Verzerrung der Tetramer-Symmetrie zeigt sich in der unterschiedlichen Oberfläche der Dimerisierungsgrenzflächen und unterscheidet PAH von der tetramerisch symmetrischen Tyrosin-Hydroxylase. Es wurde ein Domänenaustauschmechanismus vorgeschlagen, der die Bildung des Tetramers aus Dimeren vermittelt, bei dem C-terminale Alpha-Helixe ihre Konformation um eine flexible C-terminale Scharnierregion mit fünf Resten herum ändern, um eine Coiled-Coil-Struktur zu bilden, wodurch das Gleichgewicht verschoben wird in Richtung der tetrameren Form. Obwohl sowohl die homodimeren als auch die homotetrameren Formen von PAH katalytisch aktiv sind, zeigen beide eine unterschiedliche Kinetik und Regulation. Zusätzlich zu einer verringerten katalytischen Effizienz zeigt das Dimer keine positive Kooperativität gegenüber L-Phe (das bei hohen Konzentrationen das Enzym aktiviert), was darauf hindeutet, dass L-Phe PAH allosterisch durch Beeinflussung der Dimer-Dimer-Wechselwirkung reguliert.
Biologische Funktion
PAH ist ein kritisches Enzym im Phenylalanin- Stoffwechsel und katalysiert den geschwindigkeitsbestimmenden Schritt seines vollständigen Abbaus zu Kohlendioxid und Wasser. Die Regulierung des Flusses durch Phenylalanin-assoziierte Stoffwechselwege ist im Säugetierstoffwechsel von entscheidender Bedeutung, wie die Toxizität hoher Plasmaspiegel dieser Aminosäure bei Phenylketonurie zeigt (siehe unten). Die Hauptquelle für Phenylalanin sind aufgenommene Proteine, aber relativ wenig von diesem Pool wird für die Proteinsynthese verwendet. Stattdessen wird der Großteil des aufgenommenen Phenylalanins durch PAH zu Tyrosin katabolisiert ; die Zugabe der Hydroxylgruppe ermöglicht das Aufbrechen des Benzolrings in nachfolgenden katabolen Schritten. Die Transaminierung zu Phenylpyruvat , dessen Metaboliten mit dem Urin ausgeschieden werden, stellt einen anderen Weg des Phenylalaninumsatzes dar, jedoch überwiegt der Katabolismus durch PAH.
Beim Menschen wird dieses Enzym sowohl in der Leber als auch in der Niere exprimiert, und es gibt Hinweise darauf, dass es in diesen Geweben unterschiedlich reguliert wird. PAH ist unter den aromatischen Aminosäurehydroxylasen wegen seiner Beteiligung am Katabolismus ungewöhnlich; Tyrosin- und Tryptophan-Hydroxylasen hingegen werden hauptsächlich im Zentralnervensystem exprimiert und katalysieren geschwindigkeitsbestimmende Schritte in der Neurotransmitter-/Hormonbiosynthese.
Krankheitsrelevanz
Ein Mangel an PAH-Aktivität aufgrund von Mutationen in PAH verursacht eine Hyperphenylalaninämie (HPA), und wenn der Phenylalaninspiegel im Blut über das 20-fache der normalen Konzentration ansteigt, führt dies zur Stoffwechselerkrankung Phenylketonurie (PKU). PKU ist sowohl genotypisch als auch phänotypisch heterogen: Über 300 verschiedene pathogene Varianten wurden identifiziert, von denen die meisten Missense-Mutationen entsprechen, die auf die katalytische Domäne kartieren. Wenn eine Kohorte identifizierter PAH-Mutanten in rekombinanten Systemen exprimiert wurde, zeigten die Enzyme ein verändertes kinetisches Verhalten und/oder eine verringerte Stabilität, was mit der strukturellen Kartierung dieser Mutationen sowohl auf die katalytische als auch auf die Tetramerisierungsdomäne des Enzyms übereinstimmt. BH4 4 wurde als pharmakologische Behandlung verabreicht und es hat sich gezeigt, dass es bei einem Segment von PKU-Patienten, deren Genotypen zu einer gewissen Restaktivität von PAH führen, aber keinen Defekt in der BH4 4 -Synthese oder -Regeneration aufweisen, den Phenylalaninspiegel im Blut senkt . Folgestudien deuten darauf hin, dass bei bestimmten PAH-Mutanten überschüssiges BH4 4 als pharmakologisches Chaperon wirkt , um mutierte Enzyme mit gestörtem Tetrameraufbau und erhöhter Empfindlichkeit gegenüber proteolytischer Spaltung und Aggregation zu stabilisieren. Mutationen, die im PAH-Locus identifiziert wurden, sind in der Phenylalanin-Hydroxylase-Locus-Knowledgbase (PAHdb, https://web.archive.org/web/20130718162051/http://www.pahdb.mcgill.ca/ ) dokumentiert .
Da eine Phenylketonurie irreversible Schäden verursachen kann, ist es zwingend erforderlich, Mängel der Phenylalanin-Hydroxylase frühzeitig in der Entwicklung festzustellen. Ursprünglich wurde dies unter Verwendung eines Bakterienhemmungstests, der als Guthrie-Test bekannt ist, durchgeführt . Inzwischen ist die PKU in vielen Ländern Teil des Neugeborenenscreenings , und durch Messungen mit Tandem-Massenspektrometrie werden erhöhte Phenylalaninspiegel kurz nach der Geburt identifiziert . Die Umstellung auf eine Diät mit niedrigem Phenylalanin- und Tyrosingehalt kann dazu beitragen, langfristige Schäden an seiner Entwicklung zu verhindern.
Verwandte Enzyme
Die Phenylalanin-Hydroxylase ist eng mit zwei anderen Enzymen verwandt:
- Tryptophan-Hydroxylase (EC-Nummer 1.14.16.4), die den Serotoninspiegel im Gehirn und im Magen-Darm-Trakt kontrolliert
- Tyrosinhydroxylase (EC-Nummer 1.14.16.2), die den Dopamin- , Adrenalin- und Noradrenalinspiegel im Gehirn und im Nebennierenmark kontrolliert .
Die drei Enzyme sind homolog, d. h. es wird angenommen, dass sie sich aus derselben alten Hydroxylase entwickelt haben.
Verweise
Weiterlesen
- Eisensmith RC, Woo SL (1993). „Molekulare Grundlage der Phenylketonurie und verwandte Hyperphenylalaninämien: Mutationen und Polymorphismen im menschlichen Phenylalanin-Hydroxylase-Gen“. Menschliche Mutation . 1 (1): 13–23. doi : 10.1002/humu.138010104 . PMID 1301187 . S2CID 19476605 .
- Konecki DS, Lichter-Konecki U (August 1991). „Der Phenylketonurie-Locus: aktuelles Wissen über Allele und Mutationen des Phenylalanin-Hydroxylase-Gens in verschiedenen Populationen“. Humangenetik . 87 (4): 377–88. doi : 10.1007/BF00197152 . PMID 1679029 . S2CID 25627287 .
- Baumwolle RG (1991). „Heterogenität der Phenylketonurie auf klinischer, Protein- und DNA-Ebene“. Zeitschrift für vererbte Stoffwechselkrankheiten . 13 (5): 739–50. doi : 10.1007/BF01799577 . PMID 2246858 . S2CID 21931016 .
- Erlandsen H, Fusetti F, Martinez A, Hough E, Flatmark T, Stevens RC (Dezember 1997). „Die Kristallstruktur der katalytischen Domäne der menschlichen Phenylalanin-Hydroxylase zeigt die strukturelle Grundlage für Phenylketonurie“. Natur-Strukturbiologie . 4 (12): 995–1000. doi : 10.1038/nsb1297-995 . PMID 9406548 . S2CID 6293946 .
- Waters PJ, Parniak MA, Nowacki P, Scriver CR (1998). „In-vitro-Expressionsanalyse von Mutationen in der Phenylalanin-Hydroxylase: Verknüpfung des Genotyps mit dem Phänotyp und der Struktur mit der Funktion“. Menschliche Mutation . 11 (1): 4-17. doi : 10.1002/(SICI)1098-1004(1998)11:1<4::AID-HUMU2>3.0.CO;2-L . PMID 9450897 .
- Waters PJ (April 2003). "Wie PAH-Genmutationen Hyper-Phenylalaninämie verursachen und warum der Mechanismus wichtig ist: Erkenntnisse aus der In-vitro-Expression" . Menschliche Mutation . 21 (4): 357–69. doi : 10.1002/humu.10197 . PMID 12655545 . S2CID 23769500 .
Externe Links
- GeneReviews/NCBI/NIH/UW-Eintrag zum Phenylalanin-Hydroxylase-Mangel
- Locus-spezifische Datenbank der humanen Phenylalanin-Hydroxylase-Genvarianten
- Molekül des Monats: Phenylalanin-Hydroxylase
- Übersicht über alle in der PDB für UniProt verfügbaren Strukturinformationen : P00439 (Humane Phenylalanin-Hydroxylase) bei der PDBe-KB .