Pyrrolidin - Pyrrolidine
|
|
|||
| Namen | |||
|---|---|---|---|
|
Bevorzugter IUPAC-Name
Pyrrolidin |
|||
| Andere Namen
Azolidin
Azacyclopentan Tetrahydropyrrol Prolamin Azolan |
|||
| Bezeichner | |||
|
3D-Modell ( JSmol )
|
|||
| 102395 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA-InfoCard |
100.004.227 |
||
| EG-Nummer | |||
| 1704 | |||
|
PubChem- CID
|
|||
| RTECS-Nummer | |||
| UNII | |||
| UN-Nummer | 1922 | ||
|
CompTox-Dashboard ( EPA )
|
|||
|
|||
|
|||
| Eigenschaften | |||
| C 4 H 9 N | |||
| Molmasse | 71,123 g·mol -1 | ||
| Aussehen | Klare farblose Flüssigkeit | ||
| Dichte | 0,866 g / cm 3 | ||
| Schmelzpunkt | −63 °C (−81 °F; 210 K) | ||
| Siedepunkt | 87 °C (189 °F; 360 K) | ||
| Mischbar | |||
| Säure (p K a ) | 11,27 (p K a der konjugierten Säure in Wasser), 19.56 (p K a der konjugierten Säure in Acetonitril) |
||
| -54,8·10 -6 cm 3 /mol | |||
|
Brechungsindex ( n D )
|
1.4402 bei 28°C | ||
| Gefahren | |||
| Hauptgefahren | leicht entzündlich, gesundheitsschädlich, ätzend, möglicherweise mutagen | ||
| Sicherheitsdatenblatt | Sicherheitsdatenblatt | ||
| GHS-Piktogramme |
  
|
||
| GHS-Signalwort | Achtung | ||
| H225 , H302 , H314 , H318 , H332 | |||
| P210 , P233 , P240 , P241 , P242 , P243 , P260 , P261 , P264 , P270 , P271 , P280 , P301+312 , P301+330+331 , P303+361+353 , P304+312 , P304+340 , P305+ 351+338 , P310 , P312 , P321 , P330 , P363 , P370+378 , P403+235 | |||
| NFPA 704 (Feuerdiamant) | |||
| Flammpunkt | 3 °C (37 °F; 276 K) | ||
| 345 °C (653 °F; 618 K) | |||
| Verwandte Verbindungen | |||
|
Verwandte heterocyclische Stickstoffverbindungen
|
Pyrrol (aromatisch mit zwei Doppelbindungen) Pyrrolin (eine Doppelbindung) Pyrrolizidin (zwei fünfeckige Ringe) |
||
|
Sofern nicht anders angegeben, beziehen sich die Daten auf Materialien im Standardzustand (bei 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Infobox-Referenzen | |||
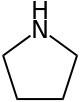
Pyrrolidin , auch bekannt als Tetrahydropyrrol , ist eine organische Verbindung mit der Summenformel (CH 2 ) 4 NH. Es ist ein cyclisches sekundäres Amin , das auch als gesättigter Heterocyclus klassifiziert wird . Es ist eine farblose Flüssigkeit, die mit Wasser und den meisten organischen Lösungsmitteln mischbar ist. Es hat einen charakteristischen Geruch, der als "ammoniakalisch, fischig, schalentierartig" beschrieben wurde. Neben Pyrrolidin selbst sind viele substituierte Pyrrolidine bekannt.
Produktion und Synthese
Industrielle Produktion
Pyrrolidin wird industriell durch die Reaktion von 1,4-Butandiol und Ammoniak bei einer Temperatur von 165–200 °C und einem Druck von 17–21 MPa in Gegenwart eines Kobalt- und Nickeloxid- Katalysators hergestellt, der auf Aluminiumoxid geträgert ist .
Die Umsetzung erfolgt in flüssiger Phase in einem kontinuierlichen Rohr- oder Rohrbündelreaktor, der in Kreisgasfahrweise betrieben wird. Der Katalysator ist als Festbett angeordnet und die Umsetzung erfolgt in Rieselfahrweise. Das Produkt wird nach mehrstufiger Reinigung und Trennung durch extraktive und azeotrope Destillation gewonnen .
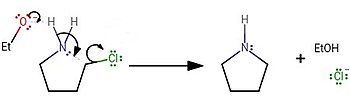
Laborsynthese
Im Labor wurde Pyrrolidin normalerweise durch Behandlung von 4-Chlorbutan-1-amin mit einer starken Base synthetisiert:
Auftreten
Viele Modifikationen von Pyrrolidin finden sich in der natürlichen und synthetischen Chemie. Die Pyrrolidin-Ringstruktur ist in zahlreichen natürlichen Alkaloiden wie Nikotin und Hygrin vorhanden . Es ist in vielen Drogen wie gefunden Procyclidin und Bepridil . Es bildet auch die Basis für die Racetamverbindungen ( zB Piracetam , Aniracetam ). Die Aminosäuren Prolin und Hydroxyprolin sind im strukturellen Sinne Derivate des Pyrrolidins.
Reaktionen
Pyrrolidin ist eine Base. Seine Basizität ist typisch für andere Dialkylamine. Gegenüber vielen sekundären Aminen zeichnet sich Pyrrolidin durch seine Kompaktheit als Folge seiner cyclischen Struktur aus.
Pyrrolidin wird als Baustein bei der Synthese komplexerer organischer Verbindungen verwendet. Es wird verwendet, um Ketone und Aldehyde durch Bildung von Enaminen zur nukleophilen Addition zu aktivieren (z. B. verwendet bei der Stork-Enamin-Alkylierung ):
Verweise
- ^ Internationale Union für reine und angewandte Chemie (2014). Nomenklatur der organischen Chemie: IUPAC-Empfehlungen und bevorzugte Namen 2013 . Die Königliche Gesellschaft für Chemie . s. 142. doi : 10.1039/9781849733069 . ISBN 978-0-8504-182-4.
- ^ Halle, HK (1957). „Korrelation der Basisstärken von Aminen“. Zeitschrift der American Chemical Society . 79 (20): 5441–5444. doi : 10.1021/ja01577a030 .
- ^ Kaljurand, I.; Kütt, A.; Sooväli, L.; Rodima, T.; Mäemets, V.; Leito, I.; Koppel, IA (2005). „Erweiterung der selbstkonsistenten spektrophotometrischen Basizitätsskala in Acetonitril auf eine volle Spanne von 28 pKa-Einheiten: Vereinheitlichung verschiedener Basizitätsskalen“. Die Zeitschrift für Organische Chemie . 70 (3): 1019–1028. doi : 10.1021/jo048252w . PMID 15675863 .
- ^ Pyrrolidin archiviert 2017-11-21 bei der Wayback Machine , The Good Scents Company
- ^ a b Bou Chedid, Roland; Melder, Johann-Peter; Dostalek, Roman; Pastre, Jörg; Tan, Aik Meam. "Verfahren zur Herstellung von Pyrrolidin" . Google-Patente . BASF SE. Archiviert vom Original am 5. Juli 2019 . Abgerufen am 5. Juli 2019 .
- ^ HK Hall, Jr. (1957). „Korrelation der Basisstärken von Aminen“. Marmelade. Chem.-Nr. Soz . 79 (20): 5441. doi : 10.1021/ja01577a030 .
- ^ RB Woodward , IJ Pachter und ML Scheinbaum (1974). "2,2-(Trimethylendithio)cyclohexanon" . Organische Synthesen . 54 : 39.CS1-Wartung: mehrere Namen: Autorenliste ( Link ); Sammelband , 6 , p. 1014
Externe Links
-
 Medien im Zusammenhang mit Pyrrolidin bei Wikimedia Commons
Medien im Zusammenhang mit Pyrrolidin bei Wikimedia Commons