Toremifen - Toremifene
 | |
 | |
| Klinische Daten | |
|---|---|
| Aussprache | / T ɔːr ə m ɪ f í n / |
| Namen austauschen | Fareston, andere |
| Andere Namen | ( Z )-Toremifen; 4-Chlorotamoxifen; 4-CT; Acapoden; CCRIS-8745; FC-1157; FC-1157a; GTx-006; NK-622; NSC-613680 |
| AHFS / Drugs.com | Monographie |
| MedlinePlus | a608003 |
| Lizenzdaten | |
| Wege Verwaltung |
Mit dem Mund |
| Wirkstoffklasse | Selektiver Östrogenrezeptor-Modulator |
| ATC-Code | |
| Pharmakokinetische Daten | |
| Bioverfügbarkeit | Gut/~100% |
| Proteinbindung | 99,7% |
| Stoffwechsel | Leber ( CYP3A4 ) |
| Metaboliten | N-Desmethyltoremifen; 4-Hydroxytoremifen; Ospemifen |
| Beseitigung Halbwertszeit | Toremifen: 3–7 Tage Metaboliten: 4–21 Tage |
| Ausscheidung | Kot : 70% (als Metaboliten) |
| Bezeichner | |
| |
| CAS-Nummer | |
| PubChem- CID | |
| IUPHAR/BPS | |
| Arzneimittelbank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| PDB-Ligand | |
| CompTox-Dashboard ( EPA ) | |
| ECHA-InfoCard |
100.125.139 |
| Chemische und physikalische Daten | |
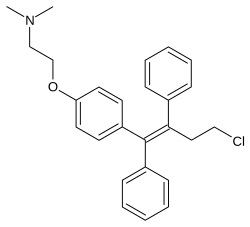
| Formel | C 26 H 28 Cl N O |
| Molmasse | 405,97 g·mol -1 |
| 3D-Modell ( JSmol ) | |
| |
| |
| (verifizieren) | |
Toremifen , das unter anderem unter dem Markennamen Fareston vertrieben wird , ist ein Medikament, das zur Behandlung von fortgeschrittenem Brustkrebs bei postmenopausalen Frauen eingesetzt wird. Es wird genommen durch den Mund .
Nebenwirkungen von Toremifen sind Hitzewallungen , Schwitzen , Übelkeit , Erbrechen , Schwindel , Ausfluss aus der Scheide und Blutungen aus der Scheide . Es kann auch Blutgerinnsel , unregelmäßigen Herzschlag , Katarakte , Sehstörungen , erhöhte Leberenzyme , Endometriumhyperplasie und Endometriumkarzinom verursachen . Bei Frauen mit Knochenmetastasen können hohe Calciumspiegel im Blut auftreten .
Das Medikament ist ein selektiver Östrogenrezeptor-Modulator (SERM) und somit ein gemischter Agonist – Antagonist des Östrogenrezeptors (ER), dem biologischen Ziel von Östrogenen wie Östradiol . Es hat östrogene Wirkungen auf Knochen , Leber und Gebärmutter und antiöstrogene Wirkungen auf die Brüste . Es ist ein Triphenylethylen- Derivat und eng mit Tamoxifen verwandt .
Toremifen wurde 1997 für medizinische Zwecke eingeführt. Es war das erste Antiöstrogen , das seit Tamoxifen im Jahr 1978 eingeführt wurde. Es ist als Generikum in den Vereinigten Staaten erhältlich .
Medizinische Anwendungen
Toremifen ist für die Behandlung von metastasierendem Brustkrebs bei postmenopausalen Frauen mit Östrogenrezeptor-positiven oder unbekannten Tumoren zugelassen . Dies ist die einzige zugelassene Verwendung in den Vereinigten Staaten . Es zeigt für diese Indikation eine gleichwertige Wirksamkeit wie Tamoxifen. Toremifen hat sich bei der Behandlung von Brustschmerzen als wirksam erwiesen und kann für diese Indikation ein wirksameres Medikament als Tamoxifen sein. Es hat auch überlegene Auswirkungen auf die Knochenmineraldichte und das Lipidprofil , einschließlich des Cholesterin- und Triglyceridspiegels , im Vergleich zu Tamoxifen. Es wurde berichtet, dass Toremifen die Symptome der Gynäkomastie bei Männern signifikant verbessert .
Verfügbare Formulare
Toremifen wird in Form von 60 mg vorgesehen oralen Tabletten .
Nebenwirkungen
Die Nebenwirkungen von Toremifen sind denen von Tamoxifen ähnlich. Die häufigste Nebenwirkung sind Hitzewallungen . Andere Nebenwirkungen sind Schwitzen , Übelkeit , Erbrechen , Schwindel , Ausfluss aus der Scheide und Blutungen aus der Scheide . Bei Frauen mit Knochenmetastasen kann eine Hyperkalzämie auftreten. Toremifen hat ein geringes Risiko für thromboembolische Ereignisse . Katarakte , Sehstörungen und Erhöhung der Leberenzyme wurden berichtet. Das Medikament verlängert das QT-Intervall und birgt daher das Risiko potenziell tödlicher Rhythmusstörungen . Das Risiko von Rhythmusstörungen kann verringert werden, indem die Anwendung bei Patienten mit Hypokaliämie , Hypomagnesiämie , vorbestehender QT-Verlängerung und bei Patienten , die andere QT-verlängernde Medikamente einnehmen, vermieden wird . Da Toremifen eine östrogene Wirkung in der Gebärmutter hat , kann es das Risiko einer Endometriumhyperplasie und eines Endometriumkarzinoms erhöhen .
Toremifen scheint sicherer zu sein als Tamoxifen. Es hat ein geringeres Risiko für venöse Thromboembolien (VTE) (z. B. Lungenembolie ), Schlaganfall und Katarakte . Das geringere VTE-Risiko kann damit zusammenhängen, dass Tamoxifen die Antithrombin-III- Spiegel signifikant stärker senkt als entweder 60 oder 200 mg/Tag Toremifen.
Interaktionen
Toremifen ist ein Substrat von CYP3A4 , einem Cytochrom-P450- Enzym , und daher können Arzneimittel, die dieses Enzym induzieren oder hemmen , die Toremifen-Spiegel im Körper senken bzw. erhöhen.
Pharmakologie
Pharmakodynamik
Toremifen ist ein selektiver Östrogenrezeptor-Modulator (SERM). Das heißt, es ist ein selektiver gemischter Agonist-Antagonist der Östrogenrezeptoren (ERs), mit östrogenen Wirkungen in einigen Geweben und antiöstrogenen Wirkungen in anderen Geweben. Das Medikament hat östrogene Wirkungen auf die Knochen , teilweise östrogene Wirkungen auf Uterus und Leber und antiöstrogene Wirkungen auf die Brüste .
| Medikation | Brust | Knochen | Leber | Uterus | Vagina | Gehirn | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Lipide | Gerinnung | SHBG | IGF-1 | Hitzewallungen | Gonadotropine | |||||||||
| Östradiol | + | + | + | + | + | + | + | + | + | + | ||||
| "Ideales SERM" | – | + | + | ± | ± | ± | – | + | + | ± | ||||
| Bazedoxifen | – | + | + | + | + | ? | – | ± | – | ? | ||||
| Clomifen | – | + | + | ? | + | + | – | ? | – | ± | ||||
| Lasofoxifen | – | + | + | + | ? | ? | ± | ± | – | ? | ||||
| Ospemifen | – | + | + | + | + | + | ± | ± | – | ± | ||||
| Raloxifen | – | + | + | + | + | + | ± | – | – | ± | ||||
| Tamoxifen | – | + | + | + | + | + | + | – | – | ± | ||||
| Toremifen | – | + | + | + | + | + | + | – | – | ± | ||||
| Wirkung: + = Östrogen / agonistisch . ± = gemischt oder neutral. – = Antiöstrogen / Antagonist . Hinweis: SERMs erhöhen im Allgemeinen die Gonadotropinspiegel bei hypogonadalen und eugonadalen Männern sowie bei prämenopausalen Frauen (antiöstrogen), senken jedoch die Gonadotropinspiegel bei postmenopausalen Frauen (östrogen). Quellen: Siehe Vorlage. | ||||||||||||||
Die Affinität von Toremifen für das ER ist ähnlich der von Tamoxifen. In Studien mit Ratten-ER hatte Toremifen etwa 1,4 % und Tamoxifen etwa 1,6 % der Affinität von Östradiol zum ER. Die Affinitäten (K i ) von Toremifen an den menschlichen ERs wurden mit 20,3 ± 0,1 nM für den ERα und 15,4 ± 3,1 nM für den ERβ angegeben . In anderen ER-Studien an Ratten hatte Toremifen 3–9 % der Affinität von Estradiol für das ER, während seine Metaboliten N- Desmethyltoremifen und 4-Hydroxytoremifen 3–5 % bzw. 64–158 % der Affinität von Estradiol für das ER aufwiesen . Die Affinität eines anderen Metaboliten, 4- Hydroxy - N- desmethyltoremifen, wurde nicht bewertet. 4-Hydroxytoremifen zeigte in einer Studie in vitro eine etwa 100-fach höhere antiöstrogene Wirksamkeit als Toremifen, in einer anderen jedoch nicht. Es wurde auch gefunden, dass 4- Hydroxy - N- desmethyltoremifen in vitro stark antiöstrogen wirkt . Die Metaboliten von Toremifen, insbesondere 4-Hydroxytoremifen, können einen wichtigen Beitrag zur klinischen Wirksamkeit des Medikaments leisten. Andererseits betrachten einige Behörden Toremifen nicht als Prodrug .
Toremifen ist Tamoxifen sehr ähnlich und teilt die meisten seiner Eigenschaften. Es gibt einige Hinweise darauf , dass toremifene sicherer als Tamoxifen sein kann , wie es sich nicht um eine hepatocarcinogen bei Tieren und weniger Potenzial für haben Genotoxizität . Klinische Studien haben jedoch keine signifikanten Unterschiede zwischen Toremifen und Tamoxifen gefunden, einschließlich in Bezug auf Wirksamkeit , Verträglichkeit und Sicherheit , und daher war die klinische Anwendung von Toremifen etwas eingeschränkt. Es wird angenommen, dass Toremifen etwa ein Drittel der Wirksamkeit von Tamoxifen besitzt; dh 60 mg Toremifen entsprechen ungefähr 20 mg Tamoxifen bei der Behandlung von Brustkrebs.
Toremifen hat antigonadotrope Wirkungen bei postmenopausalen Frauen, progonadotrope Wirkungen bei Männern, erhöht den Spiegel von Sexualhormon-bindendem Globulin und senkt den Spiegel des insulinähnlichen Wachstumsfaktors 1 um etwa 20 % bei postmenopausalen Frauen und Männern.
Neben seiner Aktivität als SERM ist 4-Hydroxytoremifen ein Antagonist des Östrogen-Related Rezeptor γ (ERRγ).
Pharmakokinetik
Absorption
Die Bioverfügbarkeit von Toremifen wurde nicht genau bestimmt, ist aber als gut bekannt und wird auf etwa 100 % geschätzt. Die Toremifenspiegel im Steady State bei einer Dosierung von 60 mg/Tag betragen 800 bis 879 ng/ml. Die Konzentrationen von N- Desmethyltoremifen im Steady State mit Toremifen betrugen 3.058 ng/ml bei 60 mg/Tag, 5.942 ng/ml bei 200 mg/Tag und 11.913 ng/ml bei 400 mg/Tag. Die 4-Hydroxytoremifen-Spiegel im Steady State mit Toremifen betrugen 438 ng/ml bei 200 mg/Tag und 889 ng/ml bei 400 mg/Tag. Die Konzentrationen von Toremifen steigen linear über einen Dosisbereich von 10 bis 680 mg an.
Verteilung
Toremifen beträgt 99,7% an Plasmaproteine gebunden und mit 92%, spezifisch an gebundenen Albumin , etwa 6% bis & bgr; 1 - Globulin - Fraktion und etwa 2% auf einen Bruchteil zwischen Albumin und α 1 Globulinen . Das scheinbare Verteilungsvolumen von Toremifen lag zwischen 457 und 958 l.
Stoffwechsel
Toremifen wird metabolisiert in der Leber in erster Linie durch CYP3A4 und durchläuft dann sekundäre Hydroxylierung . Zu den Metaboliten von Toremifen gehören unter anderem N- Desmethyltoremifen, 4-Hydroxytoremifen und 4- Hydroxy - N- Desmethyltoremifen. Ospemifen (Deaminohydroxytoremifen) ist auch ein Hauptmetabolit von Toremifen.
Beseitigung
Die Eliminationshalbwertszeit von Toremifen beträgt bei gesunden Personen 3 bis 7 Tage. Bei Menschen mit eingeschränkter Leberfunktion beträgt die Halbwertszeit 11 Tage. Die Eliminationshalbwertszeiten der Metaboliten von Toremifen betragen 5 bis 21 Tage für N- Desmethyltoremifen, 5 Tage für 4-Hydroxytoremifen und 4 Tage für Ospemifen. Es wird angenommen, dass die langen Eliminationshalbwertszeiten von Toremifen und seinen Metaboliten auf die enterohepatische Rezirkulation und die hohe Plasmaproteinbindung zurückzuführen sind. Toremifen wird eliminiert 70% in den Kot , als Metaboliten.
Chemie
Toremifen, auch bekannt als 4-Chlortamoxifen , ist ein Derivat von Triphenylethylen und ein enges Analogon von Tamoxifen . Es ist auch eng mit Afimoxifen (4-Hydroxytamoxifen) und Ospemifen (Deaminohydroxytoremifen) verwandt.
Geschichte
Toremifen wurde 1997 in den Vereinigten Staaten eingeführt . Es war das erste Antiöstrogen , das in diesem Land seit Tamoxifen im Jahr 1978 eingeführt wurde.
Gesellschaft und Kultur
Generische Namen
Toremifen ist der generische Name des Medikaments und sein INN und BAN , während Toremifencitrat seine USAN und JAN ist und Toremifen sein DCF ist .
Markennamen
Toremifene wird fast ausschließlich unter dem Markennamen Fareston vertrieben.
Verfügbarkeit
Toremifene wird weltweit vermarktet und ist in den Vereinigten Staaten , Großbritannien , Irland , vielen anderen europäischen Ländern, Südafrika , Australien , Neuseeland und anderswo auf der ganzen Welt erhältlich.
Forschung
Toremifene wurde auch zur Vorbeugung von Prostatakrebs untersucht und hatte den vorläufigen Markennamen Acapodene.
Im Jahr 2007 führte das Pharmaunternehmen GTx, Inc. zwei verschiedene klinische Studien der Phase 3 durch ; Erstens eine zulassungsrelevante klinische Phase-Studie zur Behandlung schwerwiegender Nebenwirkungen der Androgenentzugstherapie (ADT) (insbesondere Wirbel-/Wirbelsäulenfrakturen und Hitzewallungen , Lipidprofil und Gynäkomastie ) bei fortgeschrittenem Prostatakrebs, und zweitens eine zulassungsrelevante klinische Phase-III-Studie Studie zur Vorbeugung von Prostatakrebs bei Männern mit hohem Risiko mit hochgradiger intraepithelialer Prostataneoplasie oder PIN. Ergebnisse dieser Studien werden im ersten Quartal 2008 erwartet
Ein NDA für den ersten Antrag (Beseitigung von Prostatakrebs-ADT-Nebenwirkungen) wurde im Februar 2009 eingereicht, und im Oktober 2009 sagte die FDA, dass sie weitere klinische Daten benötigen würde, zB eine weitere Phase-III-Studie.
Letztendlich wurde die Entwicklung eingestellt und Toremifen wurde nie für Komplikationen im Zusammenhang mit ADT oder zur Behandlung oder Vorbeugung von Prostatakrebs vermarktet.
Toremifen kann bei der Vorbeugung von Bicalutamid- induzierter Gynäkomastie nützlich sein .
Ergebnisse der Phase-III-Studie
Eine doppelblinde, placebokontrollierte, randomisierte, 3-jährige klinische Studie mit Toremifen wurde mit einer Stichprobe von 1.260 Männern durchgeführt. Die Probanden hatten ein Durchschnittsalter von 64 Jahren und wurden mit einer hochgradigen intraepithelialen Prostataneoplasie (HGPIN) diagnostiziert, die als prämaligne gilt, obwohl Thompson und Leach der Meinung sind, dass eine niedriggradige PIN auch als prämaligne angesehen werden könnte.
Der Sponsor GTx, der die Studie konzipiert und geleitet hat, stellte fest, dass 34,7% der Placebo- und 32,3% der Toremifen-Gruppen Krebsereignisse hatten. In den Gleason-Scores beider Gruppen wurde kein Unterschied gefunden .
Frühere Studien an Mäusen mit transgenen Adenokarzinomen der Prostata der Maus (TRAMP) zeigten, dass Toremifen bei 60 % der Tiere tastbare Tumore verhinderte. In dieser Studie wurde Toremifen als Frühprophylaxe eingesetzt, was sie von den Phase-III-Studien am Menschen unterscheidet.
Verweise
Weiterlesen
- Taras TL, Wurz GT, Linares GR, DeGregorio MW (2000). „Klinische Pharmakokinetik von Toremifen“. Clin Pharmacokinet . 39 (5): 327–34. doi : 10.2165/00003088-200039050-00002 . PMID 11108432 . S2CID 26647296 .
- Harvey HA, Kimura M, Hajba A (2006). „Toremifene: eine Bewertung seines Sicherheitsprofils“. Brust . 15 (2): 142–57. doi : 10.1016/j.breast.2005.09.007 . PMID 16289904 .
- Taneja SS, Smith MR, Dalton JT, Raghow S, Barnette G, Steiner M, Veverka KA (2006). „Toremifen – eine vielversprechende Therapie zur Vorbeugung von Prostatakrebs und Komplikationen der Androgenentzugstherapie“. Expertenmeinung zur Untersuchung von Medikamenten . 15 (3): 293–305. doi : 10.1517/13543784.15.3.293 . PMID 16503765 . S2CID 29510508 .
- Zhou WB, Ding Q, Chen L, Liu XA, Wang S (2011). „Toremifen ist eine wirksame und sichere Alternative zu Tamoxifen in der adjuvanten endokrinen Therapie von Brustkrebs: Ergebnisse von vier randomisierten Studien“. Brustkrebs Res. Behandeln . 128 (3): 625–31. doi : 10.1007/s10549-011-1556-5 . PMID 21553116 . S2CID 36985808 .
- Gennari L, Merlotti D, Stolakis K, Nuti R (2012). „Pharmakokinetische Bewertung von Toremifen und seine klinischen Auswirkungen auf die Behandlung von Osteoporose“. Expertenmeinung Medikament Metab Toxicol . 8 (4): 505–13. doi : 10.1517/17425255.2012.665873 . PMID 22356442 . S2CID 19547631 .
- Mao C, Yang ZY, He BF, Liu S, Zhou JH, Luo RC, Chen Q, Tang JL (2012). „Toremifen versus Tamoxifen bei fortgeschrittenem Brustkrebs“ . Cochrane Database Syst Rev . 2021 (7): CD008926. doi : 10.1002/14651858.CD008926.pub2 . PMC 8407374 . PMID 22786516 .
- Vogel CL, Johnston MA, Capers C, Braccia D (2014). "Toremifen für Brustkrebs: ein Überblick über 20 Jahre Daten" . Klin. Brustkrebs . 14 (1): 1–9. doi : 10.1016/j.clbc.2013.10.014 . PMID 24439786 .
- Mustonen MV, Pyrhönen S, Kelokumpu-Lehtinen PL (2014). "Toremifen in der Behandlung von Brustkrebs" . Welt J Clin Oncol . 5 (3): 393–405. doi : 10.5306/wjco.v5.i3.393 . PMC 4127610 . PMID 25114854 .
