ACTG1 - ACTG1
Gamma-Aktin ist ein Protein , das beim Menschen vom ACTG1- Gen kodiert wird . Gamma-Aktin wird in zellulären Zytoskeletten vieler Gewebe weithin exprimiert ; in erwachsenen quergestreiften Muskelzellen ist Gamma-Aktin in Z-Scheiben und Costamere- Strukturen lokalisiert , die für die Kraftübertragung und -übertragung in Muskelzellen verantwortlich sind. Mutationen in ACTG1 wurden mit nicht- syndromalem Hörverlust und Baraitser-Winter-Syndrom sowie der Anfälligkeit jugendlicher Patienten für Vincristin- Toxizität in Verbindung gebracht.
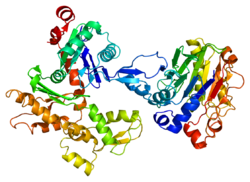
Struktur
Humanes Gamma-Aktin hat ein Molekulargewicht von 41,8 kDa und eine Länge von 375 Aminosäuren . Aktine sind hochkonservierte Proteine, die an verschiedenen Arten der Zellmotilität und der Aufrechterhaltung des Zytoskeletts beteiligt sind. Bei Wirbeltieren wurden drei Hauptgruppen von Aktin- Isoformen , Alpha, Beta und Gamma, identifiziert.
Die Alpha-Aktine kommen im Muskelgewebe vor und sind ein Hauptbestandteil des kontraktilen Sarkomerapparates . Die Beta- und Gamma-Aktine koexistieren in den meisten Zelltypen als Komponenten des Zytoskeletts und als Mediatoren der inneren Zellmotilität. Aktin, gamma 1, das von diesem Gen kodiert wird, findet sich in Nicht-Muskelzellen im Zytoplasma und in Muskelzellen an Costamere- Strukturen oder transversalen Punkten der Zell-Zell-Adhäsion, die senkrecht zur Längsachse der Myozyten verlaufen .
Funktion
In Myozyten , Sarkomeren sich an die Sarkolemm über Costameren , welche align bei Z-Scheiben und M-Linien . Die beiden primären Zytoskelettkomponenten von Costamere sind Desmin- Zwischenfilamente und Gamma-Aktin-Mikrofilamente. Es wurde gezeigt, dass die Wechselwirkung von Gamma-Aktin mit einem anderen costamerischen Protein, Dystrophin, für Costamere entscheidend ist, die mechanisch starke Verbindungen zwischen dem Zytoskelett und der Sarkolemmalmembran bilden . Zusätzliche Studien haben gezeigt, dass Gamma-Aktin mit Alpha -Aktin und GFP- markiertem Gamma-Aktin, das auf Z-Scheiben lokalisiert ist, kolokalisiert , wohingegen GFP- Alpha-Aktin an spitzen Enden dünner Filamente lokalisiert ist, was darauf hindeutet, dass Gamma-Aktin spezifisch auf Z-Scheiben in . lokalisiert ist quergestreifte Muskelzellen .
Es wird angenommen, dass Gamma-Aktin während der Entwicklung von Myozyten eine Rolle bei der Organisation und dem Zusammenbau von sich entwickelnden Sarkomeren spielt , was teilweise durch seine frühe Kolokalisation mit Alpha-Aktinin belegt wird . Gamma-Aktin wird schließlich durch sarkomerische Alpha-Aktin- Isoformen ersetzt, wobei geringe Mengen an Gamma-Aktin in adulten Myozyten bestehen bleiben, die mit Z-Scheiben- und Costamere- Domänen assoziieren .
Einblicke in die Funktion von Gamma-Aktin im Muskel stammen aus Studien mit Transgenese. Bei einem skelettmuskelspezifischen Knockout von Gamma-Aktin bei Mäusen zeigten diese Tiere keine nachweisbaren Entwicklungsstörungen; jedoch Knockout - Mäuse zeigten , Muskelschwäche und Faser Nekrose , zusammen mit verringerter isometrischen Zuckungskraftmessungen , gestört intrafibrilläre und interfibrilläre Verbindungen zwischen Myozyten und Myopathie .
Klinische Bedeutung
Bei Patienten mit Hörverlust wurde eine autosomal-dominante Mutation in ACTG1 im DFNA20/26-Locus bei 17q25-qter identifiziert. In Helix 9 des Gamma-Aktin- Proteins wurde eine Thr 278 Ile- Mutation identifiziert , von der vorhergesagt wird, dass sie die Proteinstruktur verändert. Diese Studie identifizierte die erste krankheitsverursachende Mutation von Gamma-Aktin und unterstreicht die Bedeutung von Gamma-Aktin als Strukturelement der Haarzellen des Innenohrs. Seitdem wurden andere ACTG1- Mutationen mit nicht- syndromalem Hörverlust in Verbindung gebracht , darunter Met 305 Thr .
Eine Missense-Mutation in ACTG1 bei Ser 155 Phe wurde auch bei Patienten mit Baraitser-Winter-Syndrom identifiziert , einer Entwicklungsstörung, die durch angeborene Ptosis , übermäßig gewölbte Augenbrauen, Hypertelorismus , okuläre Kolobome , Lissenzephalie , Kleinwuchs, Krampfanfälle und Hörverlust gekennzeichnet ist .
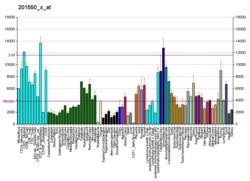
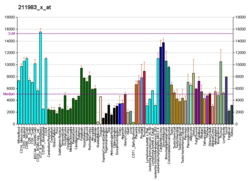
Die differentielle Expression von ACTG1- mRNA wurde auch bei Patienten mit sporadischer amyotropher Lateralsklerose , einer verheerenden Krankheit mit unbekannter Kausalität, mithilfe eines ausgeklügelten bioinformatischen Ansatzes unter Verwendung von Affymetrix- Lang-Oligonukleotid-BaFL-Methoden identifiziert.
Einzelnukleotidpolymorphismen in ACTG1 wurden mit Vincristin- Toxizität in Verbindung gebracht, die Teil des Standardbehandlungsschemas für akute lymphatische Leukämie im Kindesalter ist . Neurotoxizität trat häufiger bei Patienten auf, die Träger der ACTG1 Gly 310 Ala- Mutation waren, was darauf hindeutet, dass dies eine Rolle bei den Behandlungsergebnissen der Patienten nach einer Vincristin- Behandlung spielen könnte.
Interaktionen
ACTG1 interagiert nachweislich mit:
Siehe auch
Verweise
Externe Links
- Standort des menschlichen ACTG1- Genoms und Seite mit Details zum ACTG1- Gen im UCSC-Genom-Browser .
Weiterlesen
- Snásel J, Pichová I (1997). „Die Spaltung von Wirtszellproteinen durch HIV-1-Protease“. Folia Biologica . 42 (5): 227–30. doi : 10.1007/BF02818986 . PMID 8997639 . S2CID 7617882 .
- Rodríguez Del Castillo A, Vitale ML, Trifaró JM (Nov. 1992). "Ca2+ und pH bestimmen die Interaktion von chromaffinem Zellscinderin mit Phosphatidylserin und Phosphatidylinositol 4,5,-biphosphat und seine zelluläre Verteilung während der Nikotinrezeptorstimulation und Proteinkinase C Aktivierung" . Die Zeitschrift für Zellbiologie . 119 (4): 797–810. doi : 10.1083/jcb.119.4.797 . PMC 2289683 . PMID 1331119 .
- Adams LD, Tomasselli AG, Robbins P, Moss B, Heinrikson RL (Februar 1992). "HIV-1-Protease spaltet Aktin während einer akuten Infektion von menschlichen T-Lymphozyten" . AIDS-Forschung und menschliche Retroviren . 8 (2): 291–5. doi : 10.1089/aid.1992.8.291 . PMID 1540415 .
- Dawson SJ, White LA (Mai 1992). „Behandlung von Haemophilus Aphrophilus Endokarditis mit Ciprofloxacin“. Das Journal der Infektion . 24 (3): 317–20. doi : 10.1016/S0163-4453(05)80037-4 . PMID 1602151 .
- Tomasselli AG, Hui JO, Adams L, Chosay J, Lowery D, Greenberg B, Yem A, Deibel MR, Zürcher-Neely H, Heinrikson RL (Aug 1991). "Aktin, Troponin C, Alzheimer-Amyloid-Vorläuferprotein und Pro-Interleukin 1 beta als Substrate der Protease aus dem humanen Immunschwächevirus" . Die Zeitschrift für biologische Chemie . 266 (22): 14548–53. doi : 10.1016/S0021-9258(18)98721-1 . PMID 1907279 .
- Shoeman RL, Kesselmier C, Mothes E, Höner B, Traub P (Jan 1991). "Nicht-virale zelluläre Substrate für die Protease des humanen Immunschwächevirus Typ 1" . FEBS-Briefe . 278 (2): 199–203. doi : 10.1016/0014-5793(91)80116-K . PMID 1991513 . S2CID 37002682 .
- Erba HP, Eddy R, Shows T, Kedes L, Gunning P (Apr 1988). „Struktur, Chromosomenlage und Expression des humanen Gamma-Aktin-Gens: Differenzielle Evolution, Lage und Expression der Beta- und Gamma-Aktin-Gene im Zytoskelett“ . Molekular- und Zellbiologie . 8 (4): 1775–89. doi : 10.1128/mcb.8.4.1775 . PMC 363338 . PMID 2837653 .
- Vandekerckhove J, Schering B, Bärmann M, Aktories K (Jan 1988). "Botulinum C2-Toxin ADP-Ribosylate zytoplasmatisches Beta/Gamma-Aktin in Arginin 177" . Die Zeitschrift für biologische Chemie . 263 (2): 696–700. doi : 10.1016/S0021-9258(19)35408-0 . PMID 3335520 .
- Chou CC, Davis RC, Fuller ML, Slovin JP, Wong A, Wright J, Kania S, Shaked R, Gatti RA, Salser WA (Mai 1987). "Gamma-Aktin: ungewöhnliche mRNA 3'-untranslatierte Sequenzkonservierung und Aminosäuresubstitutionen, die möglicherweise mit Krebs in Zusammenhang stehen" . Proceedings of the National Academy of Sciences of the United States of America . 84 (9): 2575–9. Bibcode : 1987PNAS...84.2575C . doi : 10.1073/pnas.84.9.2575 . PMC 304700 . PMID 3472224 .
- Hesterberg LK, Weber K (Jan 1986). "Isolierung einer Domäne von Villin, die eine Calcium-abhängige Wechselwirkung mit G-Aktin beibehält, aber keine F-Aktin-Fragmentierungsaktivität aufweist" . Europäische Zeitschrift für Biochemie / FEBS . 154 (1): 135–40. doi : 10.1111/j.1432-1033.1986.tb09368.x . PMID 3510866 .
- Erba HP, Gunning P, Kedes L (Juli 1986). "Nukleotidsequenz der humanen Gamma-Zytoskelett-Aktin-mRNA: anomale Evolution von Nicht-Muskel-Aktin-Genen von Vertebraten" . Nukleinsäureforschung . 14 (13): 5275–94. doi : 10.1093/nar/14.13.5275 . PMC 311540 . PMID 3737401 .
- Fuchs E, Kim KH, Hanukoglu I, Tanese N (1984). „Die Evolution und Komplexität der Gene, die für die Zytoskelettproteine menschlicher Epidermiszellen kodieren“. Aktuelle Probleme in der Dermatologie . 11 : 27–44. doi : 10.1159/000408662 . ISBN 978-3-8055-3752-0. PMID 6686106 .
- P. Gunning, P. Ponte, H. Okayama, J. Engel, H. Blau, L. Kedes (Mai 1983). "Isolierung und Charakterisierung von cDNA-Klonen voller Länge für humane Alpha-, Beta- und Gamma-Aktin-mRNAs: Skelett-, aber nicht zytoplasmatische Aktine haben ein aminoterminales Cystein, das anschließend entfernt wird" . Molekular- und Zellbiologie . 3 (5): 787–95. doi : 10.1128/mcb.3.5.787 . PMC 368601 . PMID 6865942 .
- Bretscher A, Weber K (Juli 1980). „Villin ist ein Hauptprotein des Mikrovillus-Zytoskeletts, das sowohl G- als auch F-Aktin kalziumabhängig bindet“. Zelle . 20 (3): 839–47. doi : 10.1016/0092-8674(80)90330-X . PMID 6893424 . S2CID 568395 .
- Pedrotti B, Colombo R, Islam K (1995). „Mikrotubulus-assoziiertes Protein MAP1A ist ein Aktin-bindendes und quervernetzendes Protein“. Zellmotilität und das Zytoskelett . 29 (2): 110–6. doi : 10.1002/cm.970290203 . PMID 7820861 .
- Papst B, Maciver S, Weeds A (Februar 1995). „Lokalisierung der Calcium-sensitiven Aktinmonomer-Bindungsstelle in Gelsolin bis Segment 4 und Identifizierung von Calcium-Bindungsstellen“. Biochemie . 34 (5): 1583–8. doi : 10.1021/bi00005a014 . PMID 7849017 .
- Jesaitis AJ, Erickson RW, Klotz KN, Bommakanti RK, Siemsen DW (Nov. 1993). „Funktionale molekulare Komplexe von humanen N-Formyl-Chemoattractant-Rezeptoren und Aktin“. Zeitschrift für Immunologie . 151 (10): 5653–65. PMID 8228254 .
- Hawkins M., Papst B, Maciver SK, Weeds AG (September 1993). „Der menschliche Aktin-Depolymerisierungsfaktor vermittelt eine pH-sensitive Zerstörung von Aktinfilamenten“. Biochemie . 32 (38): 9985–93. doi : 10.1021/bi00089a014 . PMID 8399167 .
- Yu FX, Lin SC, Morrison-Bogorad M, Atkinson MA, Yin HL (Januar 1993). "Thymosin beta 10 und Thymosin beta 4 sind beide Aktinmonomer-sequestrierende Proteine" . Die Zeitschrift für biologische Chemie . 268 (1): 502–9. doi : 10.1016/S0021-9258(18)54179-X . PMID 8416954 .
- S. Jalaguier, D. Mornet, D. Mesnier, J.J. Léger, G. Auzou (Apr 1996). "Der menschliche Mineralocorticoid-Rezeptor interagiert mit Aktin unter Mineralocorticoid-Liganden-Modulation" . FEBS-Briefe . 384 (2): 112–6. doi : 10.1016/0014-5793(96)00295-5 . PMID 8612804 . S2CID 34685894 .